下列说法正确的是
| A.醋酸溶液的浓度增大,醋酸的电离度随之增大 |
| B.0.1 mol·L-1的CH3COOH溶液,升高温度,CH3COOH的电离度增大 |
| C.在0.1 mol·L-1的醋酸溶液中,水电离出的H+浓度为10-13mol·L-1 |
| D.盐酸溶液中的c(H+)比醋酸溶液中的c(H+)大 |
更新时间:2021-09-01 20:34:14
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】能使水的电离平衡:H2O+H2O H3O++OH-发生向电离的方向移动,且使溶液呈酸性的是
H3O++OH-发生向电离的方向移动,且使溶液呈酸性的是
 H3O++OH-发生向电离的方向移动,且使溶液呈酸性的是
H3O++OH-发生向电离的方向移动,且使溶液呈酸性的是| A.在水中加KHCO3 | B.在水中加HCl |
| C.在水中加CuCl2 | D.将水加热至100℃ |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】由水电离出来的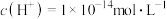 的溶液中,一定能大量共存且溶液为无色的离子组是
的溶液中,一定能大量共存且溶液为无色的离子组是
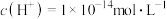 的溶液中,一定能大量共存且溶液为无色的离子组是
的溶液中,一定能大量共存且溶液为无色的离子组是A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】下列离子方程式正确的是
A.NaHS溶于水: NaHS  H++S2-+ Na+ H++S2-+ Na+ |
B.NaHCO3溶液中的水解平衡:HCO +H2O +H2O H3O++ CO H3O++ CO |
C.(NH4)2SO4溶于水:(NH4)2SO4 2NH 2NH +SO +SO |
D.HF溶于水:HF+H2O H3O++F- H3O++F- |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】下列化学用语错误的是
A.Na2S中阴离子的结构示意图为: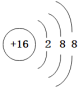 |
B.NH3●H2O的电离方程式:NH3●H2O=NH +OH- +OH- |
C.NH3的电子式为: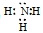 |
D.中子数为8的碳原子为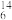 C C |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】氢氰酸 的下列性质中,可以证明它是弱电解质的是
的下列性质中,可以证明它是弱电解质的是
 的下列性质中,可以证明它是弱电解质的是
的下列性质中,可以证明它是弱电解质的是| A.HCN易溶于水 |
| B.HCN溶液的导电性比盐酸溶液的弱 |
C. 氢氰酸溶液的pH约为3 氢氰酸溶液的pH约为3 |
D.10mL HCN恰好与10mL HCN恰好与10mL NaOH溶液完全反应 NaOH溶液完全反应 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】常温下,pH=2的a、b两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是
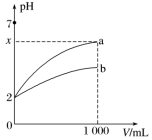

| A.a、b两酸溶液的物质的量浓度一定相等 | B.稀释后,a酸溶液的酸性比b酸溶液强 |
| C.x=5时,a 和b都是强酸 | D.若a、b都是弱酸,则2<x<5 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】如图表示25℃时,0.1mol/L稀氨水加水稀释过程中某物理量随加水量的变化情况,则图中纵坐标y可以是
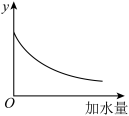

| A.NH3•H2O的电离平衡常数 | B.NH3•H2O的电离程度 |
| C.溶液的pH | D.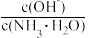 |
您最近一年使用:0次
【推荐2】下列叙述中不正确的是
| A.常温下,NH3(g)+HCl(g)=NH4Cl(s)能够自发进行,则该反应的△H<0 |
| B.反应H2(g)+I2(g)⇌2HI(g)到达平衡状态后,恒温恒容下充入H2,则正反应速率增大,逆反应速率减小 |
| C.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
D.常温下,0.1mol·L-1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
您最近一年使用:0次

 、Mg2+、Cl-、NO
、Mg2+、Cl-、NO
 时,相同
时,相同 的两种一元弱酸
的两种一元弱酸 与
与 溶液分别加水稀释,溶液
溶液分别加水稀释,溶液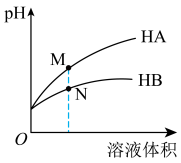
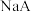 与
与 溶液中,
溶液中,
 点溶液的导电性大于
点溶液的导电性大于 点溶液的导电性
点溶液的导电性 点的
点的
 溶液中的
溶液中的 杂质
杂质 溶液遇到闪锌矿(ZnS),会慢慢转化为铜蓝(CuS)
溶液遇到闪锌矿(ZnS),会慢慢转化为铜蓝(CuS)

