甲醇是一种重要的化工原料又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如图1所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图1所示。
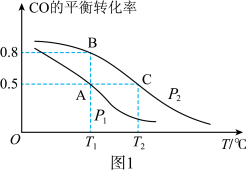
由图可判断△H____ 0,A、B两点对应的平衡常数关系是KA____ KB(填“>、<、=”)。
(2)某温度下,充分反应后,达到平衡时测得c(CO)=0.02mol/L,则此温度下的平衡常数K=____ 。
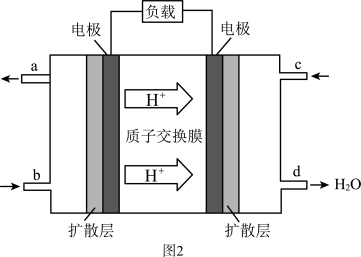
(3)我国在甲醇燃料电池技术方面获得新突破,组装出自呼吸电池及主动式电池。其工作原理如图2所示。该电池工作时,c口通入的物质为___  (填化学式)
(填化学式) ;电池负极的电极反应式为
;电池负极的电极反应式为____ 。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度,压强的关系如图1所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图1所示。
由图可判断△H
(2)某温度下,充分反应后,达到平衡时测得c(CO)=0.02mol/L,则此温度下的平衡常数K=
(3)我国在甲醇燃料电池技术方面获得新突破,组装出自呼吸电池及主动式电池。其工作原理如图2所示。该电池工作时,c口通入的物质为
 (填化学式)
(填化学式) ;电池负极的电极反应式为
;电池负极的电极反应式为
更新时间:2019-11-10 21:58:55
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】化学平衡常数的应用
(1)判断可逆反应的反应热
若升高温度,K值增大,则正反应为____ 反应;
若升高温度,K值减小,则正反应为____ 反应。
(1)判断可逆反应的反应热
若升高温度,K值增大,则正反应为
若升高温度,K值减小,则正反应为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】在1L密闭容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2(g)+H2(g) CO(g)+H2O(g),回答下列问题:
CO(g)+H2O(g),回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下的化学平衡常数K1=_______ 。(写出该反应的化学平衡常数的表达式并计算出结果)
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知该反应的正反应为_______ 反应(填“吸热”或“放热”)。
(3)在(1)的基础上,压缩容器体积为0.5L。该条件下的平衡常数为K3。则K3_______ K1(填“<”或”>”或“=”)。
(4)830℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应_______ (填“向正反应方向进行”或“向逆反应方向进行”或“处于平衡状态”)。
(5)某温度时,在2L密闭容器中发生:C(s)+H2O(g) CO(g)+H2(g)。起始时C为2mol, H2O 为3mol,平衡时CO转化率为60%,则平衡时氢气的浓度为
CO(g)+H2(g)。起始时C为2mol, H2O 为3mol,平衡时CO转化率为60%,则平衡时氢气的浓度为_______ ,此时容器内总压强与起始时的压强之比为_______ 。
 CO(g)+H2O(g),回答下列问题:
CO(g)+H2O(g),回答下列问题:(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下的化学平衡常数K1=
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知该反应的正反应为
(3)在(1)的基础上,压缩容器体积为0.5L。该条件下的平衡常数为K3。则K3
(4)830℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应
(5)某温度时,在2L密闭容器中发生:C(s)+H2O(g)
 CO(g)+H2(g)。起始时C为2mol, H2O 为3mol,平衡时CO转化率为60%,则平衡时氢气的浓度为
CO(g)+H2(g)。起始时C为2mol, H2O 为3mol,平衡时CO转化率为60%,则平衡时氢气的浓度为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】Ⅰ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g) CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___ 。
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为___ L(连通管中气体体积忽略不计,且不考虑温度的影响)。

Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应___ (填“正向”或“逆向”)进行。
(2)要提高CO的转化率,可以采取的措施是___ (填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
 CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为

Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)
 CH3OH(g)
CH3OH(g)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.27 | 0.012 |
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应
(2)要提高CO的转化率,可以采取的措施是
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】SO2与O2反应生成SO3,是接触法制硫酸的关键步骤,有关化学方程式为2SO2+O2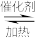 2SO3。回答下列问题:
2SO3。回答下列问题:
(1)将2mol SO2、2mol O2置于恒容密闭绝热反应器中合成三氧化硫,反应速率与反应时间的关系如图:
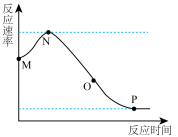
①M、N、O、P四点中,_____ 点反应速率最大,_____ 点反应处于平衡态。
②M到N反应速率变大的原因为______________________ 。
(2)某兴趣小组以恒温恒容(温度、体积均不变)反应器合成SO3,各物质的物质的量浓度与时间的关系如图:
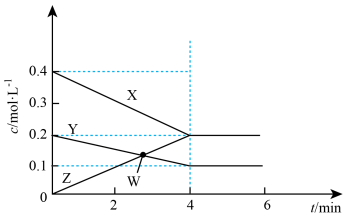
①________ 线表示SO2,前4min二氧化硫的平均反应速率为_______ mol/(L·min)。
②W点SO3物质的量浓度为__________ (用分数表示)mol/L。
 2SO3。回答下列问题:
2SO3。回答下列问题:(1)将2mol SO2、2mol O2置于恒容密闭绝热反应器中合成三氧化硫,反应速率与反应时间的关系如图:

①M、N、O、P四点中,
②M到N反应速率变大的原因为
(2)某兴趣小组以恒温恒容(温度、体积均不变)反应器合成SO3,各物质的物质的量浓度与时间的关系如图:

①
②W点SO3物质的量浓度为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是___________ 。
(2)在实际生产中,选定的温度为400℃~500℃,原因是___________
(3)在实际生产中,采用的压强为常压,原因是___________
(4)在实际生产中,通入过量的空气,原因是___________
(5)尾气中的SO2必须回收,原因是___________ 。
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=___________ 。
 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 95.0 | 97.7 | 98.3 |
(2)在实际生产中,选定的温度为400℃~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中的SO2必须回收,原因是
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10−3。请回答下列问题。
2NO(g) ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10−3。请回答下列问题。
(1)该反应的平衡常数表达式为__ ,升高温度N2的转化率__ (填“变大”、“变小”或“不变”)。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是___ %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10−1 mol∙L−1、4.0×10−2 mol∙L−1和3.0×10−3 mol∙L−1,此时反应___ (填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是__ 。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数___ (填“变大”、“变小”或“不变”)。
 2NO(g) ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10−3。请回答下列问题。
2NO(g) ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10−3。请回答下列问题。(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10−1 mol∙L−1、4.0×10−2 mol∙L−1和3.0×10−3 mol∙L−1,此时反应
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度):

(1)图像中 和
和 的关系是:
的关系是:
_______  (填“>、<或=”)。
(填“>、<或=”)。
(2)a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是_______ (填字母)。

(1)图像中
 和
和 的关系是:
的关系是:
 (填“>、<或=”)。
(填“>、<或=”)。(2)a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】羧基硫(COS)是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在容积不变的密闭容器中,将CO和 混合加热并达到下列平衡:
混合加热并达到下列平衡: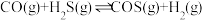
(1)若反应前CO的物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,下列说法正确的是___________ (填字母)。
a.升高温度, 的浓度增大,表明该反应是吸热反应
的浓度增大,表明该反应是吸热反应
b.通入CO后,正反应速率逐渐增大
c.反应前 的物质的量为7mol
的物质的量为7mol
d.达到平衡时CO的转化率为80%
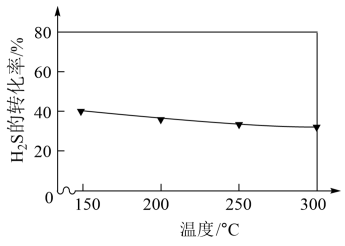
(2)在不同温度下达到化学平衡时, 的转化率如图所示,则该反应是
的转化率如图所示,则该反应是___________ 反应(填“吸热”或“放热”)。
(3)在某温度下,向1L的密闭容器中通入10molCO和10mol ,平衡时测得CO的转化率为40%,则该温度下反应的平衡常数为
,平衡时测得CO的转化率为40%,则该温度下反应的平衡常数为___________ 。
 混合加热并达到下列平衡:
混合加热并达到下列平衡: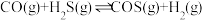
(1)若反应前CO的物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,下列说法正确的是
a.升高温度,
 的浓度增大,表明该反应是吸热反应
的浓度增大,表明该反应是吸热反应b.通入CO后,正反应速率逐渐增大
c.反应前
 的物质的量为7mol
的物质的量为7mold.达到平衡时CO的转化率为80%
(2)在不同温度下达到化学平衡时,
 的转化率如图所示,则该反应是
的转化率如图所示,则该反应是
(3)在某温度下,向1L的密闭容器中通入10molCO和10mol
 ,平衡时测得CO的转化率为40%,则该温度下反应的平衡常数为
,平衡时测得CO的转化率为40%,则该温度下反应的平衡常数为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】如图1是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:


(1)B极电极反应式为_______ 。
(2)目前已开发出用电解法制取ClO2的新工艺,简易装置如图2所示:
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的_______ (填“左”或“右”)边电极;写出阳极产生ClO2的电极反应式_______ 。
②电解一段时间,当阴极产生的气体体积为224mL(标准状况下)时,停止电解。阴极区得到的产物的量_______ mol。


图1 图2
(1)B极电极反应式为
(2)目前已开发出用电解法制取ClO2的新工艺,简易装置如图2所示:
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的
②电解一段时间,当阴极产生的气体体积为224mL(标准状况下)时,停止电解。阴极区得到的产物的量
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
(1)已知CH3OH(g)+ O2(g)
O2(g) CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
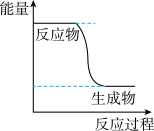
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)=__________ ,则CH3OH的转化率为______ 。
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH(电解质溶液)构成,则下列说法正确的是 ______
(4)写出甲醇燃料电池在酸性条件下负极的反应式为 ______ 。
(1)已知CH3OH(g)+
 O2(g)
O2(g) CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
| A.CH3OH转变成H2的过程是一个吸收能量的过程 |
| B.H2的生成速率与CH3OH的消耗速率之比为1:2 |
| C.化学变化不仅有新物质生成,同时也一定有能量变化 |
| D.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度 |
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH(电解质溶液)构成,则下列说法正确的是 ______
| A.电池放电时通入空气的电极为负极 |
| B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O |
| C.电池放电时,电解质溶液的碱性逐渐减弱 |
| D.电池放电时每消耗6.4gCH3OH转移1.2mol电子 |
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】利用铝与空气中的氧气发生反应,可设计为原电池,实现化学能转化为电能。
(1)回答下列问题:
①写出铝与空气反应的化学方程式:_______________ ,
②Al片上发生的电极反应式是:__________________ ,
③石墨棒上发生的电极反应式是:________________ ,
④消耗27g铝时,转移的电子数为:__________ mol。

(2)25℃、101kPa乙醇的燃烧热为1366.8 kJ·mol−1。
①写出该反应的热化学方程式:______________ 。
②利用该反应设计如图所示的原电池,在图中适当的位置标出该电池的正、负极及电子转移的方向_____________ 。

(1)回答下列问题:
①写出铝与空气反应的化学方程式:
②Al片上发生的电极反应式是:
③石墨棒上发生的电极反应式是:
④消耗27g铝时,转移的电子数为:

(2)25℃、101kPa乙醇的燃烧热为1366.8 kJ·mol−1。
①写出该反应的热化学方程式:
②利用该反应设计如图所示的原电池,在图中适当的位置标出该电池的正、负极及电子转移的方向

您最近一年使用:0次

 2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。
2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。


