我国科学家率先合成了新拓扑结构的储氢材料,镁、钛、钒、铁等一些金属形成的化合物及合金有异乎寻常的储氢能力。回答下列问题:
(1)基态铁原子失电子成为Fe3+,Fe3+的价电子排布图是___________ 。
(2)V2+与N2H4、H2O2、乙二胺(H2NCH2CH2NH2)等能形成配离子,在N2H4和H2O2中的非金属元素第一电离能由大到小的顺序是___________ ,N2H4中氮原子的杂化方式为___________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)莫氏硬度是衡量矿物硬度的一种标准,其值越大则硬度越大。已知NaF和MgF2的莫氏硬度值分别为3.2和6.0,引起这种差异的主要原因是___________ 。
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。 的空间构型为
的空间构型为___________ ,再写出与其互为等电子体的分子和离子___________ 、___________ 。
(5)配合物[Cu(CH3C≡N)4]BF4中铜的配位数为___________ ,配位体中σ键与π键个数之比为___________ 。
(6)某种铁镁合金储氢效率很高,其晶胞如图所示,
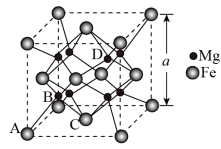
已知铁镁合金的晶胞参数为a pm,则铁镁之间的最短距离为___________ pm,该合金的密度为___________ g∙cm−3(只列出计算式即可)。
(1)基态铁原子失电子成为Fe3+,Fe3+的价电子排布图是
(2)V2+与N2H4、H2O2、乙二胺(H2NCH2CH2NH2)等能形成配离子,在N2H4和H2O2中的非金属元素第一电离能由大到小的顺序是
(3)莫氏硬度是衡量矿物硬度的一种标准,其值越大则硬度越大。已知NaF和MgF2的莫氏硬度值分别为3.2和6.0,引起这种差异的主要原因是
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
 的空间构型为
的空间构型为(5)配合物[Cu(CH3C≡N)4]BF4中铜的配位数为
(6)某种铁镁合金储氢效率很高,其晶胞如图所示,

已知铁镁合金的晶胞参数为a pm,则铁镁之间的最短距离为
更新时间:2021-01-08 14:33:41
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】已知:元素X基态原子的3p轨道上有4个电子,元素Y与Mn、Fe同周期,Y基态原子的内层轨道全部排满电子,且最外层电子数为2.按要求回答下列问题:
(1)Fe元素位于周期表中的第______ 周期第______ 族,属于______ 区。
(2)写出Y简化的电子排布式______ 。
(3)在X的氢化物(H2X)分子中,X原子轨道的杂化轨道类型是______ 。
(4)Mn与Fe两元素的部分电离能数据如下表所示,比较两元素的I2、I3可知,气态Mn2+再失去一个电子的能力比气态Fe2+更难,原因是______ 。(从“原子结构角度”分析、解释原因)。
(1)Fe元素位于周期表中的第
(2)写出Y简化的电子排布式
(3)在X的氢化物(H2X)分子中,X原子轨道的杂化轨道类型是
(4)Mn与Fe两元素的部分电离能数据如下表所示,比较两元素的I2、I3可知,气态Mn2+再失去一个电子的能力比气态Fe2+更难,原因是
| 元素 | Mn | Fe | |
| 电离能kJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】根据下列5种元素的电离能数据(单位:kJ·mol-1),回答下列问题。
(1)在元素周期表中,最有可能处于同一族的是______ (填序号,下同)。
A.Q和R
B.S和T
C.T和V
D.R和T
E.R和V
(2)它们的氯化物的化学式,最有可能正确的是________ 。
A.QCl2 B.RCl C.SCl3 D.TCl E.VCl4
(3)下列元素中,最有可能与Q元素处于同一族的是________ 。
A.硼 B.铍 C.锂 D.氢 E.氦
(4)在这5种元素中,最容易与氯元素形成离子化合物的是________ 。
A.Q B.R C.S D.T E.V
(5)利用表中的数据判断,V元素最有可能是下列元素中的________ 。
A.H B.Li C.Na D.K
理论根据是____________________________________ 。
元素符号 | I1 | I2 | I3 | I4 |
Q | 2 080 | 4 000 | 6 100 | 9 400 |
R | 500 | 4 600 | 6 900 | 9 500 |
S | 740 | 1 500 | 7 700 | 10 500 |
T | 580 | 1 800 | 2 700 | 11 600 |
V | 420 | 3 100 | 4 400 | 5 900 |
A.Q和R
B.S和T
C.T和V
D.R和T
E.R和V
(2)它们的氯化物的化学式,最有可能正确的是
A.QCl2 B.RCl C.SCl3 D.TCl E.VCl4
(3)下列元素中,最有可能与Q元素处于同一族的是
A.硼 B.铍 C.锂 D.氢 E.氦
(4)在这5种元素中,最容易与氯元素形成离子化合物的是
A.Q B.R C.S D.T E.V
(5)利用表中的数据判断,V元素最有可能是下列元素中的
A.H B.Li C.Na D.K
理论根据是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4•H2O。
(1)Cu2+价电子排布式为_______ ;[Cu(NH3)4]SO4•H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为_____ 。
(2)SO42-中S原子轨道杂化类型为_____ ,H2O与H+以配位键形成H3O+,则H3O+的空间构型为____ (用文字描述)。
(3)N、O、S第一电离能由大到小的顺序为___________ 。
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是________ 。
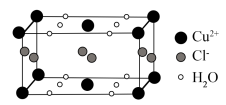
(1)Cu2+价电子排布式为
(2)SO42-中S原子轨道杂化类型为
(3)N、O、S第一电离能由大到小的顺序为
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)写出M原子的外围电子排布式_____ 。
(2)画出Y的负一价离子的电子式_____ ,元素Y的含氧酸中,酸性最强的是_____ (写化学式)。
(3)Y的同周期元素中,第一电离能最大的是______ (写元素符号);同周期主族元素从左到右,原子半径逐渐______ ,原因是______ 。
(4)M与Y形成的一种化合物MY,该化合物难溶于水但易溶于氨水,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______ 。
(1)写出M原子的外围电子排布式
(2)画出Y的负一价离子的电子式
(3)Y的同周期元素中,第一电离能最大的是
(4)M与Y形成的一种化合物MY,该化合物难溶于水但易溶于氨水,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。
(1)图甲表示多硼酸根的一种无限长的链式结构,其化学式可表示为___________ 。(以n表示硼原子的个数)

(2)硼酸晶体是片层结构图乙表示的是其中一层的结构。每一层内存在的作用力有___________ 。
(3)三氯化硼的熔点比氯化镁的熔点低,原因是___________ 。
(4)镁单质晶体中原子的堆积模型如图,紧邻的四个镁原子的中心连线构成的正四面体的体积是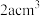 ,镁单质的密度为
,镁单质的密度为 ,已知阿伏加德罗常数的值为
,已知阿伏加德罗常数的值为 ,则镁的摩尔质量的计算式是
,则镁的摩尔质量的计算式是_____ 。

(1)图甲表示多硼酸根的一种无限长的链式结构,其化学式可表示为

(2)硼酸晶体是片层结构图乙表示的是其中一层的结构。每一层内存在的作用力有
(3)三氯化硼的熔点比氯化镁的熔点低,原因是
(4)镁单质晶体中原子的堆积模型如图,紧邻的四个镁原子的中心连线构成的正四面体的体积是
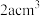 ,镁单质的密度为
,镁单质的密度为 ,已知阿伏加德罗常数的值为
,已知阿伏加德罗常数的值为 ,则镁的摩尔质量的计算式是
,则镁的摩尔质量的计算式是

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质.请回答下列问题:
(1)科学家常利用_______ 区分晶体硼和无定形硼,二者之关的关系互为_________ .第二周期元素的第一电离能按由小到大的顺序排列,B元素排在第__________ 位,其基态能量最低的能极电子云轮廊图为_____ .
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为_____ ,Si原子的杂化类型为_________ .
(3)N元素位于元素周期表____________ 区;该元素形成的氢化物的沸点比同族元素的氢化物沸点高,其原因为____________
(4)[Co (NH3)6]3+的几何构型为正八面体形,Co在中心.[Co (NH3)6]3+中,1个Co提供____________ 个空轨道.该配位离子的作用力为_______ (填序号).
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
②若将[Co (NH3)6]3+中的两个 NH3 分子换成两个Cl ,可以形成__________ 种不同的结构形式。
(5)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示.与Ti紧邻的Ca有______ 个.
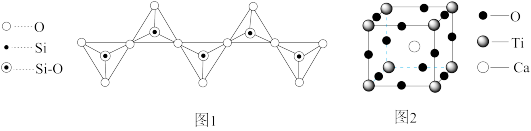
(1)科学家常利用
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为
(3)N元素位于元素周期表
(4)[Co (NH3)6]3+的几何构型为正八面体形,Co在中心.[Co (NH3)6]3+中,1个Co提供
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
②若将[Co (NH3)6]3+中的两个 NH3 分子换成两个Cl ,可以形成
(5)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示.与Ti紧邻的Ca有

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐1】A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
(1)Cu2+基态核外电子排布式为____ 。
(2) 的空间构型为
的空间构型为____ (用文字描述);Cu2+与OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为____ (填元素符号)。
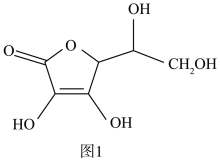
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____ ;推测抗坏血酸在水中的溶解性:____ (填“难溶于水”或“易溶于水”)。
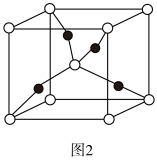
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为____ 。
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
(1)Cu2+基态核外电子排布式为
(2)
 的空间构型为
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为


(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为
您最近一年使用:0次
【推荐2】完成下列问题:
(1)基态Cu原子的核外电子排布式为___ 。
(2)NH3的空间结构是___ 。
(3)[Cu(NH3)4]2+中的配体为___ ,提供孤电子对的配位原子是___ 。中心离子是___ 。
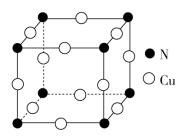
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为___ 。该化合物的相对分子质量为M,NA为阿伏加德罗常数的值。若该晶胞的边长为apm,则该晶体的密度是__ g·cm-3。
(1)基态Cu原子的核外电子排布式为
(2)NH3的空间结构是
(3)[Cu(NH3)4]2+中的配体为
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】茉莉醛具有优雅的茉莉花香味,是一种广泛应用于化妆品、洗涤剂和空气清新剂的合成香料。
制备茉莉醛的一种反应原理、发生装置、工艺流程和有关数据如下:
I.反应原理:
II.发生装置:

III.工艺流程:

IV.关数据:
V.色谱分离图

回答下列问题:
(1)仪器b的名称是______ ;a与普通分液漏斗相比,其优点是______ 。
(2)“搅拌”中加入乙醇的作用是______ ;“加热”中需保持温度为60~65℃,应采取的加热方法是______ ;“操作I”的名称是______ 。
(3)柱色谱分离法是利用吸附剂对物质吸附能力的不同,进行物质分离提纯的一种方法。吸附剂一般难溶于水、表面积比较大,可选用下列物质中______ 作吸附剂。(填正确选项)
a.氯化钠 B.活性炭
(4)茉莉醛分子中碳原子的杂化方式为______ 。
(5)根据题中所给数据,所得茉莉醛产率约为______ %(保留三位有效数字)。
制备茉莉醛的一种反应原理、发生装置、工艺流程和有关数据如下:
I.反应原理:

II.发生装置:

III.工艺流程:

IV.关数据:
相对分子质量 | 密度/ | 沸点/℃ | |
苯甲醛 | 106 | 1.04 | 179 |
庚醛 | 114 | 0.85 | 153 |
茉莉醛 | 202 | 0.97 | 287 |

回答下列问题:
(1)仪器b的名称是
(2)“搅拌”中加入乙醇的作用是
(3)柱色谱分离法是利用吸附剂对物质吸附能力的不同,进行物质分离提纯的一种方法。吸附剂一般难溶于水、表面积比较大,可选用下列物质中
a.氯化钠 B.活性炭
(4)茉莉醛分子中碳原子的杂化方式为
(5)根据题中所给数据,所得茉莉醛产率约为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】回答下列问题:
(1) 常温下是一种无色气体,可与一定量的水形成
常温下是一种无色气体,可与一定量的水形成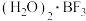 ,在一定条件下
,在一定条件下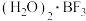 可发生如图所示转化:
可发生如图所示转化:

①H、O、B中电负性最强的元素是_______ ;基态B原子核外能量最高的电子,其电子云的轮廓图形状为_______ 。
②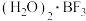 中含有的化学键为
中含有的化学键为_______ ; 与
与 形成
形成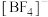 ,则
,则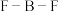 键的键角将变小,原因是
键的键角将变小,原因是_______ 。
(2)B可以与金属 形成
形成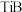 、
、 、
、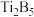 等多种硼化物,金属
等多种硼化物,金属 位于周期表中的位置为
位于周期表中的位置为_______ ,其基态原子的外围电子排布式为_______ 。
(3)三价B易形成 、
、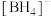 等配离子,
等配离子, 的空间立体构型为
的空间立体构型为_______ ,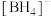 的一种阳离子等电子体为
的一种阳离子等电子体为_______ 。
(4)以天然硼砂为原料,经过一系列反应可以制得 :
:

请写出由 制得
制得 的化学方程式
的化学方程式_______ ; 有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方
有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方 ,可用作耐磨材料的新型无机材料。若晶胞的边长为
,可用作耐磨材料的新型无机材料。若晶胞的边长为 ,则晶胞的密度为
,则晶胞的密度为_______  (用含a、
(用含a、 的计算式表示)。
的计算式表示)。
(1)
 常温下是一种无色气体,可与一定量的水形成
常温下是一种无色气体,可与一定量的水形成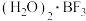 ,在一定条件下
,在一定条件下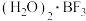 可发生如图所示转化:
可发生如图所示转化:
①H、O、B中电负性最强的元素是
②
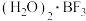 中含有的化学键为
中含有的化学键为 与
与 形成
形成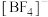 ,则
,则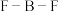 键的键角将变小,原因是
键的键角将变小,原因是(2)B可以与金属
 形成
形成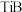 、
、 、
、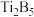 等多种硼化物,金属
等多种硼化物,金属 位于周期表中的位置为
位于周期表中的位置为(3)三价B易形成
 、
、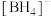 等配离子,
等配离子, 的空间立体构型为
的空间立体构型为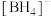 的一种阳离子等电子体为
的一种阳离子等电子体为(4)以天然硼砂为原料,经过一系列反应可以制得
 :
:
请写出由
 制得
制得 的化学方程式
的化学方程式 有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方
有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方 ,可用作耐磨材料的新型无机材料。若晶胞的边长为
,可用作耐磨材料的新型无机材料。若晶胞的边长为 ,则晶胞的密度为
,则晶胞的密度为 (用含a、
(用含a、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】翡翠的主要成分为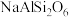 ,还含有其他多种金属阳离子。
,还含有其他多种金属阳离子。
(1)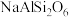 所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物的名称为:
所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物的名称为:___________ 。
(2)Al的电子排布式为___________ 。
(3)配合物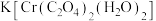 中的配体是:
中的配体是:___________ ,Cr的价层电子的电子排布图:___________ 。
(4)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中 ,
, 采用面心立方最密堆积方式。
采用面心立方最密堆积方式。

①该晶体的化学式为:___________ 。
②已知钙离子、氧离子半径分别为apm、bpm,该晶胞的参数(边长)为___________ pm。
(5)Ga可以形成 等一系列配位数为6的配合物,向上述某物质的溶液中加入足量
等一系列配位数为6的配合物,向上述某物质的溶液中加入足量 溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2.则该溶液中溶质的化学式为
溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2.则该溶液中溶质的化学式为___________ 。
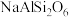 ,还含有其他多种金属阳离子。
,还含有其他多种金属阳离子。(1)
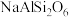 所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物的名称为:
所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物的名称为:(2)Al的电子排布式为
(3)配合物
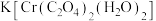 中的配体是:
中的配体是:(4)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中
 ,
, 采用面心立方最密堆积方式。
采用面心立方最密堆积方式。
①该晶体的化学式为:
②已知钙离子、氧离子半径分别为apm、bpm,该晶胞的参数(边长)为
(5)Ga可以形成
 等一系列配位数为6的配合物,向上述某物质的溶液中加入足量
等一系列配位数为6的配合物,向上述某物质的溶液中加入足量 溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2.则该溶液中溶质的化学式为
溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2.则该溶液中溶质的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐3】新冠期间受“谣言”影响蒙脱石散曾一度脱销。蒙脱石散的有效成分可表示(AlMg)2(SixOy)(OH)z•nH2O,常用于成人及儿童急、慢性腹泻。
(1)基态Si原子的电子排布式为_______ 。
(2)比较B、Al第一电离能大小:I1(Al)_______ I1(B)(填“>”或“<”),说明判断理由_______ 。
(3)SiCl4能用于制取纯硅、硅酸乙酯等,也能用于制取烟幕剂。
①将用毛皮摩擦过的橡胶棒靠近SiCl4液流,液流_______ (填“会”或“不会”)发生偏转。
②SiH4、CH4中较稳定的是_______ ;SiCl4、CCl4中沸点较高是_______ 。
(4)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。
①蒙脱石散中的“(SixOy)”是一种大片层状的多硅酸根,其可能结构如图所示:

据此分析,x:y=_______ 。
②SiO2晶胞可理解成将金刚石晶胞(如图)中的C原子置换成Si原子,然后在Si-Si之间插入O原子而形成。若SiO2晶胞的密度为dg•cm-3,NA表示阿伏加德罗常数的值,则晶胞中Si与Si之间的最短距离为_______ nm(用含NA表和d的式子表示)。

(1)基态Si原子的电子排布式为
(2)比较B、Al第一电离能大小:I1(Al)
(3)SiCl4能用于制取纯硅、硅酸乙酯等,也能用于制取烟幕剂。
①将用毛皮摩擦过的橡胶棒靠近SiCl4液流,液流
②SiH4、CH4中较稳定的是
(4)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。
①蒙脱石散中的“(SixOy)”是一种大片层状的多硅酸根,其可能结构如图所示:

据此分析,x:y=
②SiO2晶胞可理解成将金刚石晶胞(如图)中的C原子置换成Si原子,然后在Si-Si之间插入O原子而形成。若SiO2晶胞的密度为dg•cm-3,NA表示阿伏加德罗常数的值,则晶胞中Si与Si之间的最短距离为

您最近一年使用:0次




