(1)将等质量的Zn粉分别投入:试管A:10mL 0.1mol·L-1 HCl和试管B::10mL 0.1mol·L-1醋酸中。开始时,反应速率A____ B(填>,=或<,下同),若Zn过量,产生H2的体积A____ B。
(2)将等质量Zn粉分别投入pH=1体积均为10mL的试管A:盐酸和试管B:醋酸中,开始时,反应速率A____ B(填>,=或<,下同),若Zn过量,产生H2的体积A____ B。
(2)将等质量Zn粉分别投入pH=1体积均为10mL的试管A:盐酸和试管B:醋酸中,开始时,反应速率A
11-12高二·吉林长春·阶段练习 查看更多[4]
甘肃省永昌四中2019-2020学年高二上学期期末考试化学试题青海省西宁市第四高级中学2017-2018学年高二上学期第二次月考化学试题(已下线)2012-2013学年吉林省长春外国语学校高二第二次月考化学试卷甘肃省武威第五中学2016-2017学年高二下学期第二次月考化学试题
更新时间:2013-01-04 11:30:17
|
【知识点】 弱电解质在水溶液中的电离平衡解读
相似题推荐
填空题
|
适中
(0.65)
【推荐1】弱电解质的研究是重要课题。
(1)已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法不 正确的是_______

a.pH=8时,溶液中含碳元素的微粒主要是
b.A点,溶液中 和
和 浓度相同
浓度相同
c.当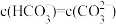 时,
时,
(2)H2CO3以及其它部分弱酸的电离平衡常数如表:
按要求回答下列问题:
①H2S、H2CO3、HClO的酸性由强到弱的顺序为_______ 。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式:_______ 。
③测得0.1mol·L−1BaS溶液pH≈13,溶液中OH-、S2−、HS-三种离子浓度由大到小的顺序依次是____ 。
(3)常温下,已知0.1mol/L一元酸HCOOH(甲酸)溶液中
①0.1mol/LHCOOH的pH=_______ 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是_______ (填写序号)
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的pH=5
C.稀释后甲酸的电离度会增大
D.与稀释前比较,稀释后水的电离程度增大
(1)已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法

a.pH=8时,溶液中含碳元素的微粒主要是

b.A点,溶液中
 和
和 浓度相同
浓度相同c.当
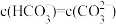 时,
时,
(2)H2CO3以及其它部分弱酸的电离平衡常数如表:
| 弱酸 | H2S | H2CO3 | HClO |
| 电离平衡常数(25℃) | 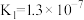 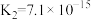 |  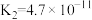 |  |
①H2S、H2CO3、HClO的酸性由强到弱的顺序为
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式:
③测得0.1mol·L−1BaS溶液pH≈13,溶液中OH-、S2−、HS-三种离子浓度由大到小的顺序依次是
(3)常温下,已知0.1mol/L一元酸HCOOH(甲酸)溶液中

①0.1mol/LHCOOH的pH=
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的pH=5
C.稀释后甲酸的电离度会增大
D.与稀释前比较,稀释后水的电离程度增大
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】醋酸和醋酸盐在日常生活和生产中的应用很广泛。
(1)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m_____ n (填“大于、等于、小于”)。
(2)室温下,如果将0.l mol CH3COONa固体和0.05 mol HCl全部溶于水形成混合溶液2 L。在混合溶液中:
①_______ 和______ 两种粒子的物质的量之和等于0.1mol。
②c(CH3COO-)+c(OH-)-c(H+)=_____ mol/L
(3)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。

回答下列问题:
①由图中信息可知HA为___________ 酸(填“强”或“弱”)。
② K点对应的溶液中,c(M+)+c(MOH)=___________ mol·L-1。
(4)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是___________ ;将各溶液分别稀释100倍,pH变化最小的是___________ (填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
(5)25℃时,将a mol 醋酸钠溶于水,向该溶液滴加b L稀醋酸后溶液呈中性,则所滴加稀醋酸的浓度为___________ mol·L-1.(25℃时CH3COOH的电离平衡常数Ka=2×10-5)
(1)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m
(2)室温下,如果将0.l mol CH3COONa固体和0.05 mol HCl全部溶于水形成混合溶液2 L。在混合溶液中:
①
②c(CH3COO-)+c(OH-)-c(H+)=
(3)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。

回答下列问题:
①由图中信息可知HA为
② K点对应的溶液中,c(M+)+c(MOH)=
(4)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.H2CO3 D.CH3COOH
(5)25℃时,将a mol 醋酸钠溶于水,向该溶液滴加b L稀醋酸后溶液呈中性,则所滴加稀醋酸的浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】硒(34Se)与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥(主要成分是Se,含有CuSe、Ag2Se等杂质)为原料,提炼硒的流程如图:

请回答下列问题:
(1)写出高温下用焦炭还原B的化学方程式_________ 。
(2)溶液C中析出硒的离子方程式___________ 。
(3)向Na2SeO3溶液中滴加稍过量的乙酸,其离子方程式为_________ 。已知:Ka1(H2SeO3)=2.7×10-3、Ka2(H2SeO3)=2.5×10-8、Ka(CH3COOH)=1.8×10-5。

请回答下列问题:
(1)写出高温下用焦炭还原B的化学方程式
(2)溶液C中析出硒的离子方程式
(3)向Na2SeO3溶液中滴加稍过量的乙酸,其离子方程式为
您最近一年使用:0次



