已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
(1)上述反应平衡常数K的表达式为________________ 。
(2)既能提高反应速率,又能提高H2转化率的方法是__________ (填写一条即可)。
(3)若T K时,化学平衡常数K=15,则10s 时v(正)______ v(逆)(填“>”“<”或“=”),此时CO2的转化率=________________ 。
(4)能说明上述可逆反应达到化学平衡的是___________ 。
A. 混合气体的平均摩尔质量不再变化
B. 混合气体的密度不再变化
C. c(H2)/c(CH3OCH3)的比值不再变化
D. 容器内的压强不再变化
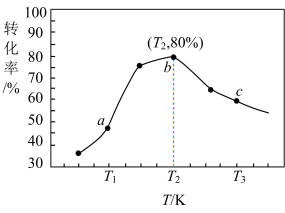
(5)一定条件下,向某恒容密闭容器中充入2 mol CO2和3 mol H2,发生的反应为 CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。测得在相同时间内不同温度下H2的转化率如图所示,则在该时间段内恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为
CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。测得在相同时间内不同温度下H2的转化率如图所示,则在该时间段内恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为___________ 。
 CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:| c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
| 开始时 | a | b | 0 | 0 |
| 10 s时 | 3 | 0.5 | c | 1.5 |
(1)上述反应平衡常数K的表达式为
(2)既能提高反应速率,又能提高H2转化率的方法是
(3)若T K时,化学平衡常数K=15,则10s 时v(正)
(4)能说明上述可逆反应达到化学平衡的是
A. 混合气体的平均摩尔质量不再变化
B. 混合气体的密度不再变化
C. c(H2)/c(CH3OCH3)的比值不再变化
D. 容器内的压强不再变化

(5)一定条件下,向某恒容密闭容器中充入2 mol CO2和3 mol H2,发生的反应为 CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。测得在相同时间内不同温度下H2的转化率如图所示,则在该时间段内恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为
CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。测得在相同时间内不同温度下H2的转化率如图所示,则在该时间段内恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为
更新时间:2019-12-31 12:51:09
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:
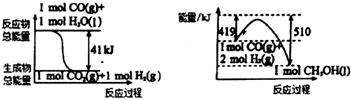
则CO2与H2反应生成液态CH3OH 的热化学方程式为_______________________ 。
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g) CO(g)+3H2(g); △H1>0
CO(g)+3H2(g); △H1>0
II.CO(g)+2H2(g) CH3OH(g); △H2<0
CH3OH(g); △H2<0
将1.0molCH4和3.0molH2O (g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。
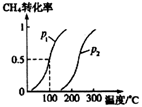
① 图中的P1___ P2(填“<”、“>”或“=”) ,判断的理由是________________ 。
② 若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是______ (填序号)。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol· L-1)变化如下表所示:
若5min时只改变了某一条件,则所改变的条件是_______________ 。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成液态CH3OH 的热化学方程式为
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g)
 CO(g)+3H2(g); △H1>0
CO(g)+3H2(g); △H1>0II.CO(g)+2H2(g)
 CH3OH(g); △H2<0
CH3OH(g); △H2<0将1.0molCH4和3.0molH2O (g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。

① 图中的P1
② 若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是
| A.生成CH3OH 的速率与消耗CO 的速率相等 | B.混合气体的密度不变 |
| C.混合气体的总物质的量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】Ⅰ.对于可逆反应:2SO2(g)+O2(g) ⇌2SO3(g),在容积固定的密闭容器中充入等物质的量的SO2、O2,①单位时间内消耗2n mol SO2的同时生成2n mol SO3;②单位时间内消耗2n mol SO2的同时生成2n mol SO2;③用SO2、O2、SO3表示的反应速率之比为2:1:2的状态;④SO2的质量分数不再改变;⑤c(SO2): c(O2): c(SO3)=2:1:2;⑥c(SO2) : c(SO3)的比值不再改变;⑦c(SO2): c(O2)的比值不再改变;⑧混合气体的压强不再改变;⑨混合气体的密度不再改变;⑩混合气体的平均相对分子质量不再改变
(1)以上达到平衡状态的标志是___________________________
(2)若在恒温恒压条件下,以上可判断达到化学平衡状态的是______________________
II.在一密闭容器中发生反应:H2(g)+I2(g) ⇌2HI(g) △H<0,已达平衡:
①保持容器容积不变,充入1mlH2;②保持容器容积不变,充入1mlHe;③保持容器内气体压强不变,充入1mlHe;④升高温度;⑤加入正催化剂
(1)改变条件,反应速率加快的是__________ ,其中活化分子百分数增大的是________ 。
(2)改变条件,平衡正向移动的是______________ 。
(1)以上达到平衡状态的标志是
(2)若在恒温恒压条件下,以上可判断达到化学平衡状态的是
II.在一密闭容器中发生反应:H2(g)+I2(g) ⇌2HI(g) △H<0,已达平衡:
①保持容器容积不变,充入1mlH2;②保持容器容积不变,充入1mlHe;③保持容器内气体压强不变,充入1mlHe;④升高温度;⑤加入正催化剂
(1)改变条件,反应速率加快的是
(2)改变条件,平衡正向移动的是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】将玉米秸秆进行热化学裂解可制备出以CO、 、
、 、
、 为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
(1)已知:几种常见共价键的键能如下表所示。
由此可估算反应 的焓变
的焓变
_______  。
。
(2)若在恒容绝热的密闭容器中进行上述反应,下列说法正确的是_______(填标号)。
(3) 和
和 合成乙醇的反应为
合成乙醇的反应为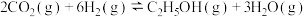 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的变化关系如图所示。
的体积分数随温度和压强的变化关系如图所示。
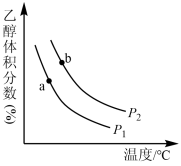
①压强
_______  (填“>”“<”或“=”,下同)。判断依据是
(填“>”“<”或“=”,下同)。判断依据是_______ 。
②a、b两点的平衡常数
_______  。
。
③已知Arrhenius经验公式为 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得下图所示曲线。在m催化剂作用下,该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得下图所示曲线。在m催化剂作用下,该反应的活化能Ea=_______  。从图中信息获知催化效能较高的催化剂是
。从图中信息获知催化效能较高的催化剂是_______ (填“m”或“n”)。

 、
、 、
、 为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。(1)已知:几种常见共价键的键能如下表所示。
| 共价键 | C—H | C—O |  | H—H | O—H |
键能( ) ) | 413 | 358 | 839 | 436 | 467 |
 的焓变
的焓变
 。
。(2)若在恒容绝热的密闭容器中进行上述反应,下列说法正确的是_______(填标号)。
| A.体系温度不再发生变化时,反应达到化学平衡状态 |
B.平衡体系中, 和 和 的物质的量之比为2:1 的物质的量之比为2:1 |
C.加入催化剂,可以提高 的平衡产率 的平衡产率 |
D.其他条件不变,增大CO的浓度,能提高 的平衡转化率 的平衡转化率 |
 和
和 合成乙醇的反应为
合成乙醇的反应为 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的变化关系如图所示。
的体积分数随温度和压强的变化关系如图所示。
①压强

 (填“>”“<”或“=”,下同)。判断依据是
(填“>”“<”或“=”,下同)。判断依据是②a、b两点的平衡常数

 。
。③已知Arrhenius经验公式为
 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得下图所示曲线。在m催化剂作用下,该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得下图所示曲线。在m催化剂作用下,该反应的活化能Ea= 。从图中信息获知催化效能较高的催化剂是
。从图中信息获知催化效能较高的催化剂是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】CO在工农业生产中有广泛用途。
(1)工业上可用C与水蒸气在高温下制CO,反应原理为:C(s)+H2O(g) CO(g)+H2(g)△H>0。写出该反应的平衡常数表达式K=
CO(g)+H2(g)△H>0。写出该反应的平衡常数表达式K=_______ 。
(2)向1L容积不变的密闭容器中,加入24gC,并使之均匀地平铺在容器底部,然后再加入18gH2O(g),发生上述反应。达到平衡后,测得H2的浓度为0.75mol/L。若按如下配比改变起始加入量,则达到平衡后,H2的浓度仍为0.75mol/L的是_______(填字母)。
(3)工业上可用CO制备甲醇(CH3OH)。
原理为:CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
①达到平衡后,若保持容器体积恒定,充入氦气,则平衡_______ (填“正向移动”、“逆向移动”或“不移动”,下同);若保持容器压强恒定,充入氦气,则平衡_______ 。
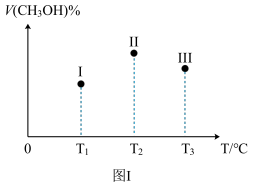
②在Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中充入相同的CO和H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到tmin时CH3OH(g)的体积分数如图I所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”);据此判断上述反应的△H_______ 0(填“>”或“<”)。
(4)CO可用于工业炼铁:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。在T℃、2L恒容密闭容器甲和乙中,分别按下表所示的物质的量加入各物质,反应经过一段时间后达到平衡。
2Fe(s)+3CO2(g)。在T℃、2L恒容密闭容器甲和乙中,分别按下表所示的物质的量加入各物质,反应经过一段时间后达到平衡。
若甲容器中CO的平衡转化率为60%,则T℃时,乙容器中CO的平衡转化率为_______ 。
(1)工业上可用C与水蒸气在高温下制CO,反应原理为:C(s)+H2O(g)
 CO(g)+H2(g)△H>0。写出该反应的平衡常数表达式K=
CO(g)+H2(g)△H>0。写出该反应的平衡常数表达式K=(2)向1L容积不变的密闭容器中,加入24gC,并使之均匀地平铺在容器底部,然后再加入18gH2O(g),发生上述反应。达到平衡后,测得H2的浓度为0.75mol/L。若按如下配比改变起始加入量,则达到平衡后,H2的浓度仍为0.75mol/L的是_______(填字母)。
| A.8gC(s)+18gH2O(g) |
| B.2molCO+2molH2 |
| C.0.5molCO+0.5molH2 |
| D.27gC(s)+9gH2O+0.5molCO+0.5molH2 |
原理为:CO(g)+2H2(g)
 CH3OH(g)△H
CH3OH(g)△H①达到平衡后,若保持容器体积恒定,充入氦气,则平衡
②在Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中充入相同的CO和H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到tmin时CH3OH(g)的体积分数如图I所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是

(4)CO可用于工业炼铁:Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)。在T℃、2L恒容密闭容器甲和乙中,分别按下表所示的物质的量加入各物质,反应经过一段时间后达到平衡。
2Fe(s)+3CO2(g)。在T℃、2L恒容密闭容器甲和乙中,分别按下表所示的物质的量加入各物质,反应经过一段时间后达到平衡。| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
若甲容器中CO的平衡转化率为60%,则T℃时,乙容器中CO的平衡转化率为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】醇烃化新技术是近几年合成氨工业净化精炼原料气、除去少量CO的一种新方法。其原理可分为甲醇化和甲烷化两个部分。
甲醇化:CO(g)+2H2(g) CH3OH(g) ΔH1=-111 kJ·mol-1
CH3OH(g) ΔH1=-111 kJ·mol-1
甲烷化:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
(1)下列措施有利于提高醇烃化过程中CO转化率的是___________。
(2)甲醇化平衡常数可用Kα= 表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=
表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=___________ (用含w的表达式表示)。
(3)测试a、b两种催化剂在不同压强和温度条件下,甲醇化过程中催化效率如图:
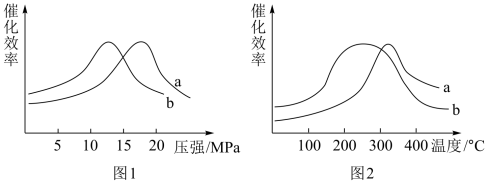
从上图可知选择哪种催化剂较好___________ (填a或b),理由是___________ 。
甲醇化:CO(g)+2H2(g)
 CH3OH(g) ΔH1=-111 kJ·mol-1
CH3OH(g) ΔH1=-111 kJ·mol-1甲烷化:CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1(1)下列措施有利于提高醇烃化过程中CO转化率的是___________。
| A.及时分离出CH3OH | B.适当升高反应温度 |
| C.使用高效的催化剂 | D.适当增大压强 |
 表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=
表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=(3)测试a、b两种催化剂在不同压强和温度条件下,甲醇化过程中催化效率如图:

从上图可知选择哪种催化剂较好
您最近一年使用:0次
【推荐3】由于温室效应和资源短缺等问题,如何降低大气中的 含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用
含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用 生产燃料甲醇。一定条件下发生反应:
生产燃料甲醇。一定条件下发生反应:

 ,如图表示该反应进行过程中能量(单位为
,如图表示该反应进行过程中能量(单位为 )的变化。
)的变化。
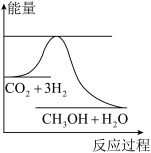
(1)该反应平衡常数K的表达式为_______________ 。
(2)温度降低,平衡常数K__________ (填“增大”、“不变”或“减小”)。
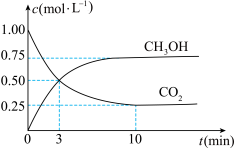
(3)在体积为1L的恒容密闭容器中,充入1mol 和3mol
和3mol ,测得
,测得 和
和 的浓度随时间变化如图所示。从反应开始到平衡,用
的浓度随时间变化如图所示。从反应开始到平衡,用 浓度变化表示的平均反应速率
浓度变化表示的平均反应速率 为
为__________  ,
, 的转化率为
的转化率为__________ ,平衡常数
__________ 。
(4)下列措施中能使(3)题中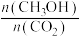 增大的有__________。(填字母)
增大的有__________。(填字母)
 含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用
含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用 生产燃料甲醇。一定条件下发生反应:
生产燃料甲醇。一定条件下发生反应:
 ,如图表示该反应进行过程中能量(单位为
,如图表示该反应进行过程中能量(单位为 )的变化。
)的变化。
(1)该反应平衡常数K的表达式为
(2)温度降低,平衡常数K
(3)在体积为1L的恒容密闭容器中,充入1mol
 和3mol
和3mol ,测得
,测得 和
和 的浓度随时间变化如图所示。从反应开始到平衡,用
的浓度随时间变化如图所示。从反应开始到平衡,用 浓度变化表示的平均反应速率
浓度变化表示的平均反应速率 为
为 ,
, 的转化率为
的转化率为

(4)下列措施中能使(3)题中
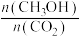 增大的有__________。(填字母)
增大的有__________。(填字母)| A.降低温度 | B.加入催化剂 |
C.将 从体系中分离 从体系中分离 | D.充入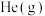 ,使体系总压强增大 ,使体系总压强增大 |
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】努力实现碳达峰、碳中和展现了我国积极参与和引领全球气候治理的大国担当,其中对于CO2的综合利用是实现碳中和的保证。
I.回收利用CO2解决空间站供氧问题物质转化如图所示:
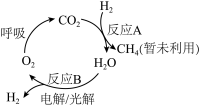
反应A为CO2(g)+4H2(g) CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
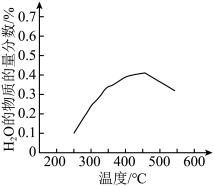
(1)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示。理论上能提高CO2平衡转化率的措施为______ (单选)。
(2)下列能说明反应A已达平衡的是______ (单选)。
(3)空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,可能的原因是______ 。
(4)在容积为1L的密闭容器中充入4molH2(g)和1molCO2(g)发生反应,测得10min时反应达到平衡状态,此时容器内H2O(g)的体积分数为0.25,若此时向容器内额外充入1molH2(g)和0.5molH2O(g),则该平衡将向着______ 方向移动(填“正”或“逆”)。
II.某研究团队利用2CO2(g)+6H2(g) C2H4(g)+4H2O(g)生产乙烯。
C2H4(g)+4H2O(g)生产乙烯。
在三个容积均为1L的密闭容器中以不同的氢碳比[ ]充入H2(g)和CO2(g),在一定条件下CO2(g)的平衡转化率与温度的关系如图所示。
]充入H2(g)和CO2(g),在一定条件下CO2(g)的平衡转化率与温度的关系如图所示。
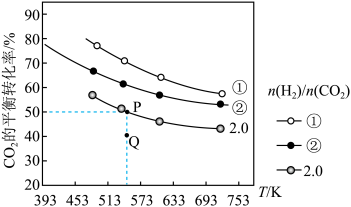
(5)下列说法不正确的是______ (不定项)。
(6)在上述2L的密闭容器中充入2molH2(g)和1molCO2(g)发生反应,10min后到达P点,那么这10min内H2O(g)的反应速率为______ 。
I.回收利用CO2解决空间站供氧问题物质转化如图所示:

反应A为CO2(g)+4H2(g)
 CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。(1)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示。理论上能提高CO2平衡转化率的措施为

| A.升高温度 | B.及时从体系中移走水蒸气 |
| C.恒容条件下向容器中冲入氩气 | D.提高原料气中CO2的比例 |
| A.生成4molH2(g)的同时消耗2mol2H2O(g) |
| B.容器内混合气体的密度保持不变 |
| C.容器内混合气体的平均相对分子质量保持不变 |
| D.容器内CO2与H2物质的量之比保持不变 |
(4)在容积为1L的密闭容器中充入4molH2(g)和1molCO2(g)发生反应,测得10min时反应达到平衡状态,此时容器内H2O(g)的体积分数为0.25,若此时向容器内额外充入1molH2(g)和0.5molH2O(g),则该平衡将向着
II.某研究团队利用2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)生产乙烯。
C2H4(g)+4H2O(g)生产乙烯。在三个容积均为1L的密闭容器中以不同的氢碳比[
 ]充入H2(g)和CO2(g),在一定条件下CO2(g)的平衡转化率与温度的关系如图所示。
]充入H2(g)和CO2(g),在一定条件下CO2(g)的平衡转化率与温度的关系如图所示。
(5)下列说法不正确的是
| A.该反应的正反应活化能E1>逆反应活化能E2 |
| B.氢碳比:①>② |
| C.在氢碳比为2.0时,Q点:v(正)<v(逆) |
| D.该反应发生前后C原子的杂化方式发生改变 |
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】如图所示是工业生产硝酸铵的流程。
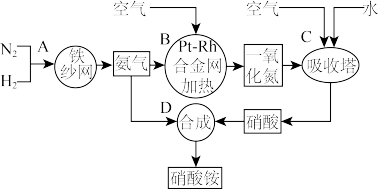
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:_____ 。
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为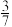 ,此时H2的转化率为
,此时H2的转化率为_____ 。
(3)设备B中反应的化学方程式为____ 。
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取_____ 吨硝酸铵。
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:
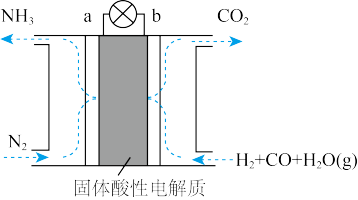
该装置的负极为_____ (填a或b),试写出a极的电极反应式_______ 。

(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为
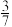 ,此时H2的转化率为
,此时H2的转化率为(3)设备B中反应的化学方程式为
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:

该装置的负极为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】合成氨时,在某个密闭容器中发生反应:3H2(g)+N2(g) 2NH3(g)
2NH3(g)
(1)下列能使反应速率加快的是_____________________
①升高温度 ②减小容器体积 ③通入N2④通入Ar使压强增大 ⑤通入HCl气体 ⑥加入合适的催化剂
A.①③④⑤ B.①②③⑥ C.①②③④ D.②④⑤⑥
(2)在恒温、恒容的条件下,下列说法能表示反应达到化学平衡状态的是__________
①当有1molN2被消耗,就有2molNH3生成
②当有6molH—H键形成时,就有12molN—H键形成
③2 正(N2)=
正(N2)= 逆(NH3)
逆(NH3)
④N2的物质的量不再变化
⑤H2、N2、NH3的浓度之比等于3:1:2
⑥混合气体的密度不变
⑦混合气体的压强不变
⑧混合气体的平均相对分子质量不变
A.①③④⑤⑦ B.①②③④⑧ C.②③④⑦⑧ D.②④⑤⑥
(3)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g) 2NH3(g)(放热反应)。测得压强-时间图象如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图象。
2NH3(g)(放热反应)。测得压强-时间图象如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图象。

①如图甲,反应开始至平衡时NH3的平均反应速率为_____________________ ,平衡时氢气的转化率为_________ 。
②如图乙,下列说法正确的是_________
A.t1时刻可能是加入了催化剂
B.改变条件可以使H2 100℅转化为NH3
C.增大N2的浓度,可以提高H2的转化率
D.t2时刻,N2的浓度与NH3的浓度之比为1:2
 2NH3(g)
2NH3(g)(1)下列能使反应速率加快的是
①升高温度 ②减小容器体积 ③通入N2④通入Ar使压强增大 ⑤通入HCl气体 ⑥加入合适的催化剂
A.①③④⑤ B.①②③⑥ C.①②③④ D.②④⑤⑥
(2)在恒温、恒容的条件下,下列说法能表示反应达到化学平衡状态的是
①当有1molN2被消耗,就有2molNH3生成
②当有6molH—H键形成时,就有12molN—H键形成
③2
 正(N2)=
正(N2)= 逆(NH3)
逆(NH3) ④N2的物质的量不再变化
⑤H2、N2、NH3的浓度之比等于3:1:2
⑥混合气体的密度不变
⑦混合气体的压强不变
⑧混合气体的平均相对分子质量不变
A.①③④⑤⑦ B.①②③④⑧ C.②③④⑦⑧ D.②④⑤⑥
(3)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)
 2NH3(g)(放热反应)。测得压强-时间图象如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图象。
2NH3(g)(放热反应)。测得压强-时间图象如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图象。
①如图甲,反应开始至平衡时NH3的平均反应速率为
②如图乙,下列说法正确的是
A.t1时刻可能是加入了催化剂
B.改变条件可以使H2 100℅转化为NH3
C.增大N2的浓度,可以提高H2的转化率
D.t2时刻,N2的浓度与NH3的浓度之比为1:2
您最近一年使用:0次



