回答下列问题:
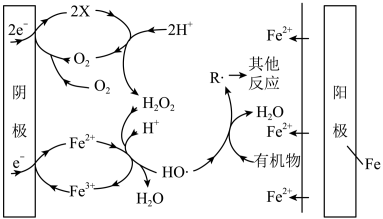
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为____ ,X微粒的化学式为____ ,阴极附近Fe2+参与反应的离子方程式为___ 。
(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是___ 。
a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g) CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
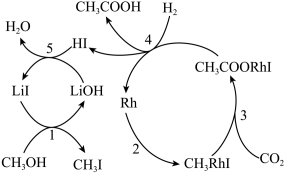
反应历程中,能降低反应活化能的物质有___ (填化学式);中间产物有___ 种。
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为

(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g)
 CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
反应历程中,能降低反应活化能的物质有
更新时间:2021-11-10 12:55:07
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】I.某研究性学习小组利用草酸(H2C2O4)溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)草酸为弱酸,写出草酸与高锰酸钾反应的离子方程式___________ 。
(2)通过实验A、B,可探究出___________ (填外部因素)的改变对化学反应速率的影响,其中V1=___________ 、T1=___________ ;通过实验___________ (填实验序号)可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由此实验可以得出的结论是___________ ;忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4) ___________ 。
Ⅱ.催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图1所示的实验,用控制变量法比较和对分解的催化效果。请回答相关问题;
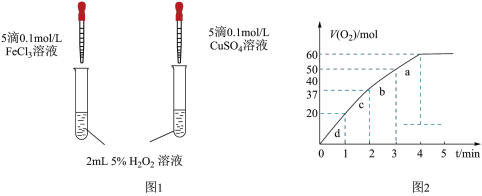
(4)定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论___________ 填(“合理”或“不合理”),原因___________ 。
| 实验序号 | 实验 温度 | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
| V/mL | c/ mol∙L-1 | V/mL | c/ mol∙L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(2)通过实验A、B,可探究出
(3)若t1<8,则由此实验可以得出的结论是
Ⅱ.催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图1所示的实验,用控制变量法比较和对分解的催化效果。请回答相关问题;

(4)定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某小组欲探究 与
与 的反应,实验过程如下:
的反应,实验过程如下:
资料:碘单质溶于水呈棕黄色
实验I:探究 与
与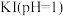 )的反应,得到如下实验数据
)的反应,得到如下实验数据
(1)依据数据,本实验探究的是_______ 对速率的影响
(2)上述反应变色后继续进行,编号①中的反应 后测得过氧化氢浓度为
后测得过氧化氢浓度为 ,则
,则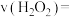
_______ 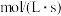 。
。
实验II:小组同学用 做上述实验时,观察到有无色气体,并未观察到上述现象,于是进行了如下实验。
做上述实验时,观察到有无色气体,并未观察到上述现象,于是进行了如下实验。
(3)实验a中:
①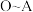 段溶液变为浅黄色,加入淀粉检验溶液变为浅蓝色。该过程中作氧化剂的物质是
段溶液变为浅黄色,加入淀粉检验溶液变为浅蓝色。该过程中作氧化剂的物质是_______ 。
②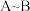 段溶液逐渐变为黄色,加入淀粉检验溶液变为蓝色。该过程中
段溶液逐渐变为黄色,加入淀粉检验溶液变为蓝色。该过程中 的主要作用是
的主要作用是_______ 。
③ 段
段 ,消耗
,消耗 产生
产生 ,导致
,导致 逐渐下降,则该反应的方程式是
逐渐下降,则该反应的方程式是_______ 。
(4)实验b中加入淀粉检验溶液几乎无色。 的主要作用是
的主要作用是_______ 。
(5)通过以上实验探究得出结论:
 在反应中主要作用是还原剂还是催化剂受
在反应中主要作用是还原剂还是催化剂受_______ 影响。
 与
与 的反应,实验过程如下:
的反应,实验过程如下:资料:碘单质溶于水呈棕黄色
实验I:探究
 与
与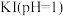 )的反应,得到如下实验数据
)的反应,得到如下实验数据| 实验编号 | ① | ② | ③ | ④ | ⑤ |
 | 0.1 | 0.1 | 0.1 | 0.2 | 0.3 |
 | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 从开始到棕黄色的时间/s | 13 | 6.5 | 4.3 | 6.6 | 4.4 |
(2)上述反应变色后继续进行,编号①中的反应
 后测得过氧化氢浓度为
后测得过氧化氢浓度为 ,则
,则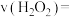
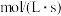 。
。实验II:小组同学用
 做上述实验时,观察到有无色气体,并未观察到上述现象,于是进行了如下实验。
做上述实验时,观察到有无色气体,并未观察到上述现象,于是进行了如下实验。| 编号 | 操作 | 现象 |
| a | 将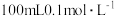 的 的 溶液不断搅拌,在A点逐滴加入 溶液不断搅拌,在A点逐滴加入 的 的 溶液(注 溶液(注 溶液起始 溶液起始 大于7是由于配置过程中溶解氧气所致)。 大于7是由于配置过程中溶解氧气所致)。 |  变化曲线如下图所示,反应过程始终无气体生成。 变化曲线如下图所示,反应过程始终无气体生成。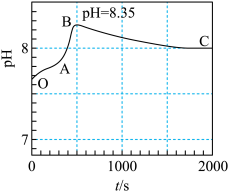 |
| b | 向 的 的 溶液中逐滴加入 溶液中逐滴加入 的 的 溶液。 溶液。 | 有大量无色气泡产生,溶液几乎无色。 |
①
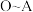 段溶液变为浅黄色,加入淀粉检验溶液变为浅蓝色。该过程中作氧化剂的物质是
段溶液变为浅黄色,加入淀粉检验溶液变为浅蓝色。该过程中作氧化剂的物质是②
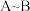 段溶液逐渐变为黄色,加入淀粉检验溶液变为蓝色。该过程中
段溶液逐渐变为黄色,加入淀粉检验溶液变为蓝色。该过程中 的主要作用是
的主要作用是③
 段
段 ,消耗
,消耗 产生
产生 ,导致
,导致 逐渐下降,则该反应的方程式是
逐渐下降,则该反应的方程式是(4)实验b中加入淀粉检验溶液几乎无色。
 的主要作用是
的主要作用是(5)通过以上实验探究得出结论:
 在反应中主要作用是还原剂还是催化剂受
在反应中主要作用是还原剂还是催化剂受
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的量来探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的量来探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
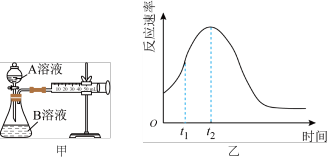
(1)该实验探究的是________ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小系是________ >________ (填实验序号)。
(2)若实验①在2min末收集了4.48LCO2(标准状况下),则在2min末,c( )=
)=___ mol·L-1(假设混合溶液的体积为5L)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定________________________________________ 来比较化学反应速率。
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②________________________________ 。
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的量来探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的量来探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:| 实验序号 | A溶液 | B溶液 |
| ① | 2L0.1mol·L-1H2C2O4溶液 | 3L0.1mol·L-1KMnO4溶液 |
| ② | 2L0.2mol·L-1H2C2O4溶液 | 3L0.1mol·L-1KMnO4溶液 |

(1)该实验探究的是
(2)若实验①在2min末收集了4.48LCO2(标准状况下),则在2min末,c(
 )=
)=(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】化学反应速率和限度与生产、生活密切相关。
Ⅰ.某同学探究外界条件对 分解速率的影响。
分解速率的影响。
(1)实验1、2的目的是探究___________ 对 分解速率的影响,结论为
分解速率的影响,结论为___________ 。
(2)对比实验3、4,能推测出 对
对 分解的催化效果比
分解的催化效果比 的好吗?
的好吗?___________ (填“能”或“不能”),请说明理由:___________ 。
(3)若实验3、5是探究 浓度对
浓度对 分解速率的影响。m为10,则还应添加的试剂及用量为
分解速率的影响。m为10,则还应添加的试剂及用量为___________ (混合后溶液体积变化忽略不计)。推测n___________ 45(填“>”“<”“=”)。
Ⅱ. (红棕色)和
(红棕色)和 (无色)之间可发生反应:
(无色)之间可发生反应: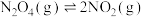 。在一定温度下,将0.08mol
。在一定温度下,将0.08mol 气体充入容积为2L的密闭容器中,容器中
气体充入容积为2L的密闭容器中,容器中 的物质的量浓度随时间变化的曲线如图所示。
的物质的量浓度随时间变化的曲线如图所示。 的点有
的点有___________ (填数字)。
(5)反应进行到16min时, 的转化率是
的转化率是___________ 。
(6)下列不能说明该反应达到平衡状态的是___________ (填字母)。
A.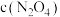 不再改变
不再改变
B.v正(N2O4)=v逆(N2O4)
C.N2O4 与NO2物质的量之比为1:2
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
Ⅰ.某同学探究外界条件对
 分解速率的影响。
分解速率的影响。| 实验序号 |  溶液 溶液 | 温度 | 催化剂 | 收集112mL 所需时间(s) 所需时间(s) | |
| 浓度(mol/L) | V(mL) | ||||
| 1 | 0.4 | 20 | 室温 | 无 | 几乎无气体产生 |
| 2 | 0.4 | 20 | 50℃ | 无 | 296 |
| 3 | 0.4 | 20 | 室温 | 0.5g 粉末 粉末 | 45 |
| 4 | 0.4 | 20 | 室温 | 0.5g 粉末 粉末 | 100 |
| 5 | 0.2 | m | 室温 | 0.5g 粉末 粉末 | n |
(1)实验1、2的目的是探究
 分解速率的影响,结论为
分解速率的影响,结论为(2)对比实验3、4,能推测出
 对
对 分解的催化效果比
分解的催化效果比 的好吗?
的好吗?(3)若实验3、5是探究
 浓度对
浓度对 分解速率的影响。m为10,则还应添加的试剂及用量为
分解速率的影响。m为10,则还应添加的试剂及用量为Ⅱ.
 (红棕色)和
(红棕色)和 (无色)之间可发生反应:
(无色)之间可发生反应: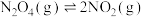 。在一定温度下,将0.08mol
。在一定温度下,将0.08mol 气体充入容积为2L的密闭容器中,容器中
气体充入容积为2L的密闭容器中,容器中 的物质的量浓度随时间变化的曲线如图所示。
的物质的量浓度随时间变化的曲线如图所示。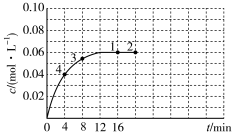
 的点有
的点有(5)反应进行到16min时,
 的转化率是
的转化率是(6)下列不能说明该反应达到平衡状态的是
A.
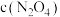 不再改变
不再改变B.v正(N2O4)=v逆(N2O4)
C.N2O4 与NO2物质的量之比为1:2
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)已知汽车尾气排放时容易发生以下反应:
①
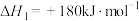
②

若在恒温恒容密闭容器中充入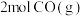 和
和 ,发生反应②,下列选项中能说明反应已达到平衡状态的是__________(填标号)。
,发生反应②,下列选项中能说明反应已达到平衡状态的是__________(填标号)。
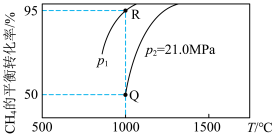
(2)一定条件下,利用甲烷可将 还原为CO。在一密闭容器中充入
还原为CO。在一密闭容器中充入 、
、 气体各
气体各 ,发生反应
,发生反应
 。测得
。测得 的平衡转化率随温度、压强的变化曲线如图所示,
的平衡转化率随温度、压强的变化曲线如图所示,
______ 0(填“>”“<”或“=”),
______  (填“>”“<”或“=”);Q点的压强平衡常数
(填“>”“<”或“=”);Q点的压强平衡常数
________  (用平衡分压代替平衡浓度计算,气体的分压=气体总压强×该气体的物质的量分数)。
(用平衡分压代替平衡浓度计算,气体的分压=气体总压强×该气体的物质的量分数)。
(3)以熔融碳酸钠燃料电池(图1)为电源, 可通过图2装置电解制备:
可通过图2装置电解制备:
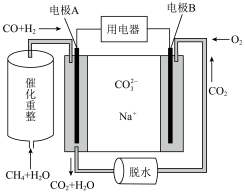
①燃料电池(图1)中电极A上 参与的电极反应式为
参与的电极反应式为__________ 。
②图2左边的电极名称为__________ ,电解池中若通电前a、b两室溶液的质量相等,若有 个
个 通过交换膜,则两室溶液的质量差为
通过交换膜,则两室溶液的质量差为__________ g。
(1)已知汽车尾气排放时容易发生以下反应:
①

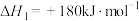
②


若在恒温恒容密闭容器中充入
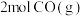 和
和 ,发生反应②,下列选项中能说明反应已达到平衡状态的是__________(填标号)。
,发生反应②,下列选项中能说明反应已达到平衡状态的是__________(填标号)。| A.CO和NO的物质的量之比不变 | B.该反应的化学平衡常数不变 |
| C.混合气体的压强保持不变 | D.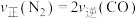 |
(2)一定条件下,利用甲烷可将
 还原为CO。在一密闭容器中充入
还原为CO。在一密闭容器中充入 、
、 气体各
气体各 ,发生反应
,发生反应
 。测得
。测得 的平衡转化率随温度、压强的变化曲线如图所示,
的平衡转化率随温度、压强的变化曲线如图所示,

 (填“>”“<”或“=”);Q点的压强平衡常数
(填“>”“<”或“=”);Q点的压强平衡常数
 (用平衡分压代替平衡浓度计算,气体的分压=气体总压强×该气体的物质的量分数)。
(用平衡分压代替平衡浓度计算,气体的分压=气体总压强×该气体的物质的量分数)。
(3)以熔融碳酸钠燃料电池(图1)为电源,
 可通过图2装置电解制备:
可通过图2装置电解制备:

图1 图2
①燃料电池(图1)中电极A上
 参与的电极反应式为
参与的电极反应式为②图2左边的电极名称为
 个
个 通过交换膜,则两室溶液的质量差为
通过交换膜,则两室溶液的质量差为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氢能源是最具应用前景的能源之一,氢气的制备和应用是目前的研究热点。
(1)已知部分共价键的键能与热化学方程式信息如下表:
则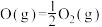 的
的 为
为___________ 。
(2)氢气可通过水煤气法获得,反应为
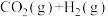 。一定温度下,控制进气比
。一定温度下,控制进气比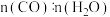 不同,测得平衡时某反应物的转化率如图所示。
不同,测得平衡时某反应物的转化率如图所示。
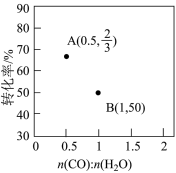
①图中表示的是___________ (填“CO”或“H2O”)的平衡转化率。A点对应进气比时,另一原料(“CO”或“H2O”)对应的转化率为___________ (用分数表示)。
②计算该温度下,反应
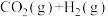 的平衡常数K=
的平衡常数K=___________ 。
③计算该温度下,当 时,图中对应物质的转化率为
时,图中对应物质的转化率为___________ (用分数表示)。
(3)利用H2和CO2催化合成CH4的反应:
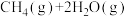
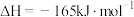
①下列能说明该反应已达到化学平衡状态的是___________ (填字母)。
A.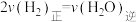
B.恒温恒容条件下,混合气体的密度不再变化
C.恒温恒压条件下,气体的体积不再变化
D.混合气体平均分子量保持不变
②一定温度和压强下,将一定比例H2和CO2分别通过装有甲、乙两种催化剂的反应器发生上述反应,反应相同时间,测得CO2转化率随温度变化情况如图所示。
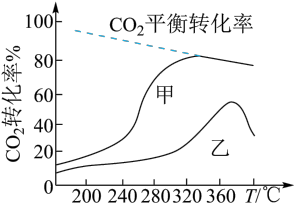
Ⅰ.CO2的平衡转化率随温度的升高而降低的原因是___________ 。
Ⅱ.温度高于380℃,用乙作催化剂,CO2转化率迅速下降,可能原因是___________ 。
(1)已知部分共价键的键能与热化学方程式信息如下表:
| 共价键 | H-H | H-O |
| 键能/(kJ·mol-1) | 436 | 463 |
| 热化学方程式 |  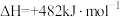 | |
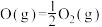 的
的 为
为(2)氢气可通过水煤气法获得,反应为

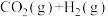 。一定温度下,控制进气比
。一定温度下,控制进气比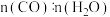 不同,测得平衡时某反应物的转化率如图所示。
不同,测得平衡时某反应物的转化率如图所示。
①图中表示的是
②计算该温度下,反应

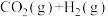 的平衡常数K=
的平衡常数K=③计算该温度下,当
 时,图中对应物质的转化率为
时,图中对应物质的转化率为(3)利用H2和CO2催化合成CH4的反应:

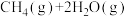
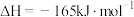
①下列能说明该反应已达到化学平衡状态的是
A.
B.恒温恒容条件下,混合气体的密度不再变化
C.恒温恒压条件下,气体的体积不再变化
D.混合气体平均分子量保持不变
②一定温度和压强下,将一定比例H2和CO2分别通过装有甲、乙两种催化剂的反应器发生上述反应,反应相同时间,测得CO2转化率随温度变化情况如图所示。

Ⅰ.CO2的平衡转化率随温度的升高而降低的原因是
Ⅱ.温度高于380℃,用乙作催化剂,CO2转化率迅速下降,可能原因是
您最近一年使用:0次
【推荐1】工业废气、汽车尾气中含有的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)NO加速臭氧层被破坏,其反应过程如图所示:

已知:O3(g)+O(g)═2O2(g)△H=-143kJ/mol
反应1:O3(g)+NO(g)═NO2(g)+O2(g)△H1 =-200.2kJ/mol
反应2:热化学方程式为________
(2)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________ 。
(3)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度十倍),装置示意图如图所示,固体电解质可传导O2-。

①阴极的反应为________ ;
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________ ;
(4)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3•H2O)=1.8×10-5;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-⇌CaSO4↓+2NH3•H2O K。
①写出用足量氨水吸收SO2的化学方程式______________ ;
②25℃时,2.0mol•L-1的氨水中,NH3•H2O的电离度
_______  ;
;
③计算第2步中反应的K=________ (列出计算式即可)。
(1)NO加速臭氧层被破坏,其反应过程如图所示:

已知:O3(g)+O(g)═2O2(g)△H=-143kJ/mol
反应1:O3(g)+NO(g)═NO2(g)+O2(g)△H1 =-200.2kJ/mol
反应2:热化学方程式为
(2)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度十倍),装置示意图如图所示,固体电解质可传导O2-。

①阴极的反应为
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)
(4)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3•H2O)=1.8×10-5;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-⇌CaSO4↓+2NH3•H2O K。
①写出用足量氨水吸收SO2的化学方程式
②25℃时,2.0mol•L-1的氨水中,NH3•H2O的电离度

 ;
;③计算第2步中反应的K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】降低能耗是氯碱工业发展的重要方向。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如下。
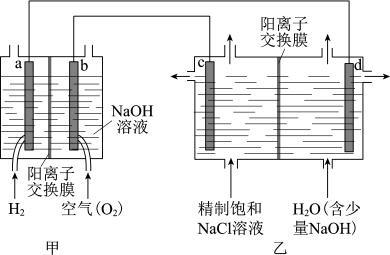
①a极为_________ (填“正”或“负”)极,写出b电极的电极反应式_________ 。
②乙装置中c电极为_________ (填“阴”或“阳”)极,写出电解饱和NaCl溶液的化学方程式_________ 。
③下列说法正确的是_________ 。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④结合化学用语解释d极区产生NaOH的原因:_________ 。
⑤实际生产中,阳离子交换膜的损伤会造成OH−迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为_________ 。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是_________ 。
A.定期检查并更换阳离子交换膜 B.向阳极区加入适量盐酸
(2)甲烷燃料电池也是一种符合绿色化学理念的新型电池,电池示意图如图所示,请回答下列问题。
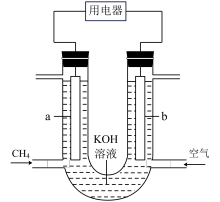
①b电极是_________ (填“正”或“负”)极。
②a电极上发生的反应为_________ 。
③若放电一段时间后,消耗甲烷2.24 L(标准状况),理论上外电路转移电子的物质的量为_________ mol。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如下。

①a极为
②乙装置中c电极为
③下列说法正确的是
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④结合化学用语解释d极区产生NaOH的原因:
⑤实际生产中,阳离子交换膜的损伤会造成OH−迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
A.定期检查并更换阳离子交换膜 B.向阳极区加入适量盐酸
(2)甲烷燃料电池也是一种符合绿色化学理念的新型电池,电池示意图如图所示,请回答下列问题。

①b电极是
②a电极上发生的反应为
③若放电一段时间后,消耗甲烷2.24 L(标准状况),理论上外电路转移电子的物质的量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)A B2的结构式_______________ ;C元素在周期表中的位置第_______ 周期________ 族
(2)B、C组成的一种化合物与水发生化合反应的化学方程式为:____________________
(3)如图所示,电解质a溶液为含有CD的饱和溶液。X为石墨电极,Y为铁电极,接通直流电源。
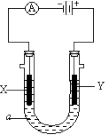
X电极的电极反应式为________________________ 。
Y电极的电极反应式为________________________ 。
(4)常温下,相同体积的0.2mol·L—1CD溶液与0.1mol·L—1 C2AB3溶液中,总离子数目较多的是______________ 溶液(填化学式)。
(1)A B2的结构式
(2)B、C组成的一种化合物与水发生化合反应的化学方程式为:
(3)如图所示,电解质a溶液为含有CD的饱和溶液。X为石墨电极,Y为铁电极,接通直流电源。

X电极的电极反应式为
Y电极的电极反应式为
(4)常温下,相同体积的0.2mol·L—1CD溶液与0.1mol·L—1 C2AB3溶液中,总离子数目较多的是
您最近一年使用:0次



