工业上常以锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,其中一种工艺流程如图:
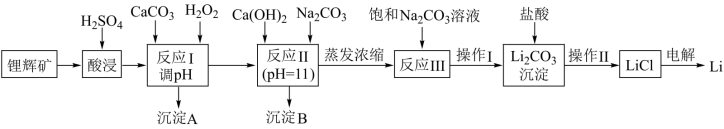
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
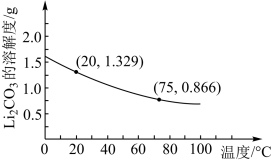
②Li2CO3的溶解度随温度变化如图所示,试回答下列问题:
(1)酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过___ 来提高浸取率。
(2)反应I中应调节pH范围为___ ,沉淀A的成分除H2SiO3、CaCO3、Al(OH)3外,还有___ (填化学式)。
(3)反应Ⅱ沉淀B的主要成分为___ (填化学式)。
(4)“操作I”的名称为___ ,洗涤Li2CO3沉淀要使用___ (选填“热水”或“冷水”)。
(5)进行“操作Ⅱ”前应加入过量的盐酸,目的是___ 。

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | 开始沉淀pH | 完全沉淀pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Mg(OH)2 | 9.6 | 11.0 |
②Li2CO3的溶解度随温度变化如图所示,试回答下列问题:

(1)酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过
(2)反应I中应调节pH范围为
(3)反应Ⅱ沉淀B的主要成分为
(4)“操作I”的名称为
(5)进行“操作Ⅱ”前应加入过量的盐酸,目的是
更新时间:2021-12-15 15:26:06
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】化学耗氧量COD是判断水体受污染程度的一个重要指标。测定某湖泊水样的COD并对测定后的废液进行处理的方法如下。
I.COD的测定
COD是以氧化1L水样中还原性物质所消耗的n(K2Cr2O7)为标准,并将其换算成O2的质量表示(换算关系:1molK2Cr2O7~4.8×104mgO2)。
【测定原理】
先用过量K2Cr2O7溶液氧化水体中还原性物质,再用硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定剩余的K2CrO7,(滴定反应为: +6Fe2++14H+=2Cr3++6Fe3++7H2O)
+6Fe2++14H+=2Cr3++6Fe3++7H2O)
【测定步骤】
i.将20.00mL水样和V1mL0.2500mol•L-1K2Cr2O7标准溶液混合,在Ag+催化和强酸性条件下充分反应。
ii.用0.1200mol•L-1(NH4)2Fe(SO4)2溶液滴定剩余的K2Cr2O7至终点,消耗V2mL(NH4)2Fe(SO4)2溶液。
(1)i中反应结束时,溶液颜色应为橙黄色,目的是___________ 。
(2)i中保持溶液强酸性可使平衡 +H2O⇌2
+H2O⇌2 +2H+向左移动,从而:
+2H+向左移动,从而:
①使___________ (填微粒符号)的浓度增大,其氧化性增强。
②避免生成Ag2CrO4沉淀,防止___________ 。
(3)由i、ii中数据计算:COD=___________ mg•L-1(化成最简式)。若滴定到终点后仰视读数,则使测定结果___________ (偏高、偏低或无影响)。
(4)常温下,用Na2CO3溶液浸泡BaSO4固体,也能将BaSO4转化为BaCO3,不考虑 的水解,向340mL3.0mol•L-1Na2CO3溶液中加入4.66gBaSO4,恰好完全转化为BaCO3,则Ksp(BaCO3)=
的水解,向340mL3.0mol•L-1Na2CO3溶液中加入4.66gBaSO4,恰好完全转化为BaCO3,则Ksp(BaCO3)=_______ 。[已知:Ksp(BaSO4)=1.0×10-10;溶液体积变化忽略不计]
I.COD的测定
COD是以氧化1L水样中还原性物质所消耗的n(K2Cr2O7)为标准,并将其换算成O2的质量表示(换算关系:1molK2Cr2O7~4.8×104mgO2)。
【测定原理】
先用过量K2Cr2O7溶液氧化水体中还原性物质,再用硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定剩余的K2CrO7,(滴定反应为:
 +6Fe2++14H+=2Cr3++6Fe3++7H2O)
+6Fe2++14H+=2Cr3++6Fe3++7H2O)【测定步骤】
i.将20.00mL水样和V1mL0.2500mol•L-1K2Cr2O7标准溶液混合,在Ag+催化和强酸性条件下充分反应。
ii.用0.1200mol•L-1(NH4)2Fe(SO4)2溶液滴定剩余的K2Cr2O7至终点,消耗V2mL(NH4)2Fe(SO4)2溶液。
(1)i中反应结束时,溶液颜色应为橙黄色,目的是
(2)i中保持溶液强酸性可使平衡
 +H2O⇌2
+H2O⇌2 +2H+向左移动,从而:
+2H+向左移动,从而:①使
②避免生成Ag2CrO4沉淀,防止
(3)由i、ii中数据计算:COD=
(4)常温下,用Na2CO3溶液浸泡BaSO4固体,也能将BaSO4转化为BaCO3,不考虑
 的水解,向340mL3.0mol•L-1Na2CO3溶液中加入4.66gBaSO4,恰好完全转化为BaCO3,则Ksp(BaCO3)=
的水解,向340mL3.0mol•L-1Na2CO3溶液中加入4.66gBaSO4,恰好完全转化为BaCO3,则Ksp(BaCO3)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】K4[Fe(CN)6](亚铁氯化钾)俗称黄血盐,是国内外广泛使用的食盐抗结剂,可以防止食盐受潮结块,其在化学实验、电镀、食品添加剂及医学上有广泛用途。用含NaCN废水合成黄血盐的主要工艺流程如图:
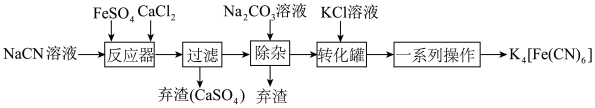
回答下列问题:
(1)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至400℃时能分解产生氰化钾(KCN)。据此判断,烹饪食品时,使用含黄血盐的食盐应注意的问题为____ 。
(2)HCN是一种极弱的酸。实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液再用蒸馏水稀释,用平衡移动原理(离子方程式及文字)解释其原因____ 。
(3)流程中加入碳酸钠溶液的主要目的是____ ,用碳酸钾代替纯碱进行脱钙反应,可以直接得到亚铁氰化钾,沉淀和产物容易彻底分离,但是成本高。有人认为也可以用硫酸钾,实际上不妥,其原因是____ 。
(4)流程中的一系列操作包括结晶、过滤、洗涤、干燥等步骤。为了得到较大颗粒的亚铁氰化钾,结晶速率应该是____ (填“快速”或“慢速”)。
(5)在25℃下,将amol·L-1的KCN溶液与0.01mol·L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a____ 0.01mol·L-1(填“>”、“<”或“=”),用含a的代数式表示HCN的电离常数K=____ 。
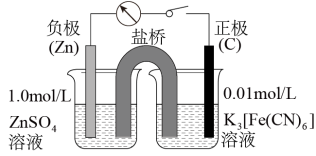
(6)亚铁氰化钾易被氧化为铁氰化钾,检验是否变质的方法是____ ,借助下列装置可以将铁氰化钾转化为亚铁氰化钾,其正极的电极反应式为____ 。

回答下列问题:
(1)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至400℃时能分解产生氰化钾(KCN)。据此判断,烹饪食品时,使用含黄血盐的食盐应注意的问题为
(2)HCN是一种极弱的酸。实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液再用蒸馏水稀释,用平衡移动原理(离子方程式及文字)解释其原因
(3)流程中加入碳酸钠溶液的主要目的是
(4)流程中的一系列操作包括结晶、过滤、洗涤、干燥等步骤。为了得到较大颗粒的亚铁氰化钾,结晶速率应该是
(5)在25℃下,将amol·L-1的KCN溶液与0.01mol·L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
(6)亚铁氰化钾易被氧化为铁氰化钾,检验是否变质的方法是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】废旧电池的回收利用既节约了资源,又可以减少污染.某型号锂电池的电池芯中含有LiCoO2及金属Al、Fe、Cu等,它的一种金属的回收工艺如图。

已知:高价钻离子在过程2被还原。
回答下列问题:
(1)LiCoO2中Co元素的化合价是___ ,电池芯先要经过粉碎处理,目的是___ 。
(2)过程3发生反应的离子方程式是___ ,试从水解平衡的角度解释,调节pH能产生Fe(OH)3沉淀的原因___ 。
(3)过程5所用的分离方法是___ 、___ ,实验室进行该操作时,需要不时打开分液漏斗活塞放气,放气的正确图示是___ 。
a. b.
b. c.
c. d.
d.
(4)已知Co的活泼性在Fe、Sn之间,由CoC2O4到Co所发生的两步反应依次是CoC2O4 CoO+CO↑+CO2↑和
CoO+CO↑+CO2↑和___ 。

已知:高价钻离子在过程2被还原。
回答下列问题:
(1)LiCoO2中Co元素的化合价是
(2)过程3发生反应的离子方程式是
(3)过程5所用的分离方法是
a.
 b.
b. c.
c. d.
d.
(4)已知Co的活泼性在Fe、Sn之间,由CoC2O4到Co所发生的两步反应依次是CoC2O4
 CoO+CO↑+CO2↑和
CoO+CO↑+CO2↑和
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】钼是一种过渡金属元素,其单质通常用作合金及不锈钢的添加剂,这种金属可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的主要流程:
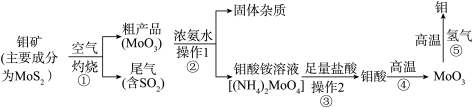
(1)用简单氧化物形式表示 的组成:
的组成:____________________________ 。
(2)写出反应①的化学方程式:______________________ 。
(3)反应①的尾气可以再利用,写出两种利用该尾气制得的化学药品:______________________ 。
(4)工业上制备还原性气体的反应原理有: ,
, 。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体(
。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体( 和
和 )依据反应⑤冶炼钼,理论上生成钼的质量为
)依据反应⑤冶炼钼,理论上生成钼的质量为___________ (已知 的相对原子质量为96)
的相对原子质量为96)

(1)用简单氧化物形式表示
 的组成:
的组成:(2)写出反应①的化学方程式:
(3)反应①的尾气可以再利用,写出两种利用该尾气制得的化学药品:
(4)工业上制备还原性气体的反应原理有:
 ,
, 。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体(
。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体( 和
和 )依据反应⑤冶炼钼,理论上生成钼的质量为
)依据反应⑤冶炼钼,理论上生成钼的质量为 的相对原子质量为96)
的相对原子质量为96)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛.现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下:
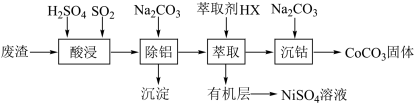
(1)酸浸时SO2的作用是___________________________________ 。
(2)除铝时加入碳酸钠产生沉淀的离子反应_________________________________ 。
(3)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价).如图是用两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x 变化曲线.

①H2O2的电子式_________________________________ 。
②由图中信息可知:_________________________________ 法制取的催化剂活性更高。
③Co2+ 、Ni2+ 两种离子中催化效果更好的是_________________________________ 。
(4)已知煅烧CoCO3时,温度不同,产物不同.在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为____________ 。

(1)酸浸时SO2的作用是
(2)除铝时加入碳酸钠产生沉淀的离子反应
(3)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价).如图是用两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x 变化曲线.

①H2O2的电子式
②由图中信息可知:
③Co2+ 、Ni2+ 两种离子中催化效果更好的是
(4)已知煅烧CoCO3时,温度不同,产物不同.在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】软锰矿的主要成分为 ,还含有
,还含有 、MgO、
、MgO、 、CaO、
、CaO、 等杂质,工业上用软锰矿制取
等杂质,工业上用软锰矿制取 的流程如下:
的流程如下:
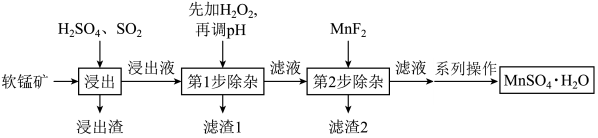
已知:①部分金属阳离子完全沉淀时的pH如下表。
②温度高于27℃时, 的溶解度随温度的升高而逐渐降低.
的溶解度随温度的升高而逐渐降低.
(1)“浸出”过程中通入 的作用是
的作用是__________________ 。
(2)第1步除杂中加入 的目的是
的目的是__________________ (用离子方程式表示)。.
(3)第1步除杂中需要调整溶液pH的范围是______ 到______ ,调pH时可选择的试剂为______ (填字母)。
a.氨水 b. c.CaO d.MgO
c.CaO d.MgO
(4)第2步除杂,主要是将 、
、 转化为相应氟化物沉淀除去,写出
转化为相应氟化物沉淀除去,写出 除去
除去 的离子方程式:
的离子方程式:________________________ ,该反应的平衡常数为__________________ 。
(已知: 的
的 ;
; 的
的 ;
; 的
的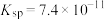 )
)
(5)“系列操作”中的具体操作有__________________ ,经干燥得到 。
。
 ,还含有
,还含有 、MgO、
、MgO、 、CaO、
、CaO、 等杂质,工业上用软锰矿制取
等杂质,工业上用软锰矿制取 的流程如下:
的流程如下:
已知:①部分金属阳离子完全沉淀时的pH如下表。
| 金属阳离子 |  |  |  |  |
| 完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
 的溶解度随温度的升高而逐渐降低.
的溶解度随温度的升高而逐渐降低.(1)“浸出”过程中通入
 的作用是
的作用是(2)第1步除杂中加入
 的目的是
的目的是(3)第1步除杂中需要调整溶液pH的范围是
a.氨水 b.
 c.CaO d.MgO
c.CaO d.MgO(4)第2步除杂,主要是将
 、
、 转化为相应氟化物沉淀除去,写出
转化为相应氟化物沉淀除去,写出 除去
除去 的离子方程式:
的离子方程式:(已知:
 的
的 ;
; 的
的 ;
; 的
的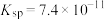 )
)(5)“系列操作”中的具体操作有
 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】一种利用富锂卤水(含Li+、Na+、Mg2+、Cl-、硼酸根等)制备碳酸锂的工艺如下:

已知:室温下相关物质的 如下表。
如下表。
(1)i中,操作的名称是___________ 。
(2)ii可除去80%的Mg2+,该过程中生成Mg2(OH)2CO3反应的离子方程式为___________ 。
(3)iii中,得到的沉淀3的成分有___________ 。
(4)有人提出:可省略向溶液3中加入草酸钠这一步,该建议_______ (填“可行”或“不可行”),理由是_______ 。
(5)一种测定碳酸锂产品纯度的方法如下:
步骤I.取agLi2CO3产品,加入 标准溶液,固体完全溶解;
标准溶液,固体完全溶解;
步骤Ⅱ.加热溶液,缓缓煮沸一段时间后自然冷却至室温;
步骤Ⅲ.以酚酞为指示剂,用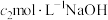 标准溶液滴定至终点,消耗溶液体积为
标准溶液滴定至终点,消耗溶液体积为 。
。
①已知:杂质不与H2SO4、NaOH溶液反应。该Li2CO3产品纯度为___________ (写出计算式,用质量分数表示)。
②步骤Ⅱ的目的是___________ ;若省略步骤Ⅱ,直接进行步骤Ⅲ,将导致测得的Li2CO3产品纯度___________ (填“偏高”“偏低”或“无影响”)。

已知:室温下相关物质的
 如下表。
如下表。| 化合物 |  |  |  |  |  |  |
 | 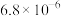 |  | 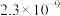 | 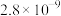 | 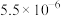 | 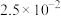 |
(1)i中,操作的名称是
(2)ii可除去80%的Mg2+,该过程中生成Mg2(OH)2CO3反应的离子方程式为
(3)iii中,得到的沉淀3的成分有
(4)有人提出:可省略向溶液3中加入草酸钠这一步,该建议
(5)一种测定碳酸锂产品纯度的方法如下:
步骤I.取agLi2CO3产品,加入
 标准溶液,固体完全溶解;
标准溶液,固体完全溶解;步骤Ⅱ.加热溶液,缓缓煮沸一段时间后自然冷却至室温;
步骤Ⅲ.以酚酞为指示剂,用
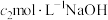 标准溶液滴定至终点,消耗溶液体积为
标准溶液滴定至终点,消耗溶液体积为 。
。①已知:杂质不与H2SO4、NaOH溶液反应。该Li2CO3产品纯度为
②步骤Ⅱ的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】对废催化剂进行回收可有效利用金属资源。某废催化剂主要含有TiO2、V2O5、WO3、SiO2、Al2O3,一种回收利用工艺的流程如图:

已知:25℃时,Ksp(CaWO4)=8.7×10-9,Ksp[Ca(OH)2]=5.5×10-6。
回答下列问题:
(1)“焙烧”产物中含有NaVO3和NaAlO2。NaVO3中V元素的化合价为___ ,Al2O3转化为NaAlO2的化学方程式为___ 。“焙烧”时不能使用陶瓷容器,原因是___ 。
(2)“水浸”所得滤液中含有的阴离子除OH-、CO 、AlO
、AlO 、VO
、VO 外,还有
外,还有___ 。
(3)“调pH=8”的目的是___ 。
(4)焙烧NH4VO3可生成V2O5,并产生一种碱性气体,该气体用___ (填试剂名称)吸收后,可循环利用。
(5)“沉钨”过程中,当溶液中c(OH-)=___ (写出计算式)mol•L-1时,溶液中WO 恰好完全沉淀(离子浓度等于1×10-5mol•L-1),应停止加入石灰乳。
恰好完全沉淀(离子浓度等于1×10-5mol•L-1),应停止加入石灰乳。
(6)用热盐酸淋洗CaWO4获得H2WO4。设计实验证明CaWO4已经转化完全的实验方案:取少量最后一次的淋洗液于试管中,___ 。

已知:25℃时,Ksp(CaWO4)=8.7×10-9,Ksp[Ca(OH)2]=5.5×10-6。
回答下列问题:
(1)“焙烧”产物中含有NaVO3和NaAlO2。NaVO3中V元素的化合价为
(2)“水浸”所得滤液中含有的阴离子除OH-、CO
 、AlO
、AlO 、VO
、VO 外,还有
外,还有(3)“调pH=8”的目的是
(4)焙烧NH4VO3可生成V2O5,并产生一种碱性气体,该气体用
(5)“沉钨”过程中,当溶液中c(OH-)=
 恰好完全沉淀(离子浓度等于1×10-5mol•L-1),应停止加入石灰乳。
恰好完全沉淀(离子浓度等于1×10-5mol•L-1),应停止加入石灰乳。(6)用热盐酸淋洗CaWO4获得H2WO4。设计实验证明CaWO4已经转化完全的实验方案:取少量最后一次的淋洗液于试管中,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
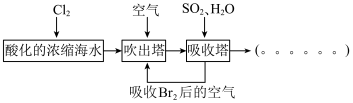
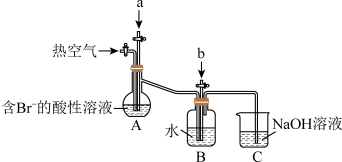
【推荐3】工业生产中以浓缩海水为原料提取溴的部分过程如图:_______ 。
(2)C装置的作用是_______ 。
(3)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。一位同学根据溴的沸点是59℃,提出采用_______ 方法从该混合液中分离出溴单质;另一位同学用萃取法提取溴单质,使用CCl4作为萃取剂的原因是_______ 。
(4)(CN)2与Cl2性质相似,则(CN)2分子中含有的化学键有_______ (填“离子键”、“极性键”或“非极性键”);(CN)2的制备原理同实验室制取Cl2类似,在酸性条件下用MnO2氧化对应的阴离子得到。写出制取(CN)2的离子方程式:_______ 。
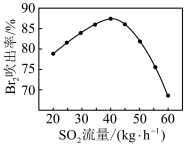
(5)工业生产过程的吹出塔中,Br2吹出率与吸收塔中SO2流量的关系如图所示。_______ 。
(2)C装置的作用是
(3)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。一位同学根据溴的沸点是59℃,提出采用
(4)(CN)2与Cl2性质相似,则(CN)2分子中含有的化学键有
(5)工业生产过程的吹出塔中,Br2吹出率与吸收塔中SO2流量的关系如图所示。
您最近一年使用:0次



