汽车尾气中含有氮氧化合物和CO,减少它们在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH2=−393kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH3=−221kJ·mol−1
若某反应的平衡常数表达式为 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ 。
(2)一定条件下,反应2CO(g)+2NO(g) N2(g)+2CO2(g)的反应历程如图所示,该历程分步进行,其中第
N2(g)+2CO2(g)的反应历程如图所示,该历程分步进行,其中第_______ 步是决速步骤。 N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是_______ ,A、B两点对应温度下该反应的活化能Ea(A)_______ Ea(B)(填“>”或“<”)。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
_______ 。
(5)用NH3可以消除NO污染:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH
5N2(g)+6H2O(l) ΔH
①某条件下,该反应速率v正=k正·c4(NH3)·c6(NO),v逆=k逆·ca(N2)·cb(H2O),该反应的平衡常数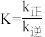 ,则b=
,则b=_______ 。
②若将9mol NH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)−9·s−1,当平衡时NH3转化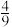 ,v逆=
,v逆=_______ mol·L−1·s−1。
(6)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图所示装置制备Na2FeO4。_______ 。
②若b>a,图中右侧的离子交换膜为_______ (填“阴”或“阳”)离子交换膜。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH2=−393kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH3=−221kJ·mol−1
若某反应的平衡常数表达式为
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(2)一定条件下,反应2CO(g)+2NO(g)
 N2(g)+2CO2(g)的反应历程如图所示,该历程分步进行,其中第
N2(g)+2CO2(g)的反应历程如图所示,该历程分步进行,其中第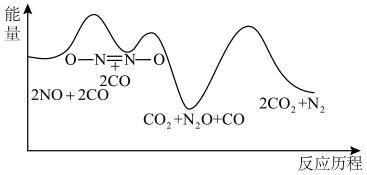
 N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
(5)用NH3可以消除NO污染:4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) ΔH
5N2(g)+6H2O(l) ΔH①某条件下,该反应速率v正=k正·c4(NH3)·c6(NO),v逆=k逆·ca(N2)·cb(H2O),该反应的平衡常数
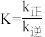 ,则b=
,则b=②若将9mol NH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)−9·s−1,当平衡时NH3转化
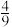 ,v逆=
,v逆=(6)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图所示装置制备Na2FeO4。

②若b>a,图中右侧的离子交换膜为
21-22高三下·重庆渝中·阶段练习 查看更多[3]
重庆市巴蜀中学2021-2022学年高三下学期适应性月考卷(七)化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)湖南省岳阳市岳汨联考2023-2024学年高三下学期5月月考化学试题
更新时间:2022-02-21 10:57:09
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】国内外目前生产苯乙烯的方法主要是乙苯脱氢法,反应原理如下:
 (g)
(g)
 (g)+H2(g) ∆H1。
(g)+H2(g) ∆H1。
(1)已知:部分化学键的键能数据如下表所示:
则∆H1=_______
(2)实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压(101kPa)的条件下进行反应。乙苯的平衡转化率与温度、投料比m[m= ]的关系如图1所示。
]的关系如图1所示。

①掺入水蒸气的目的是_______ ;
②投料比(m1、m2、m3)由大到小的顺序为________ ;
③若投料比m=1:9,反应温度为600℃,并保持体系总压为常压的条件下进行反应,下列事实不能作为该反应达到平衡的依据的是_______ (填选项字母)。
a.V正(乙苯)=v逆(乙苯)
b.容器内气体密度不再变化
c.容器内气体的平均相对分子质量不再变化
d.苯乙烯的体积分数不再变化。
e.容器内苯乙烯与H2的物质的量之比不再变化
④若m2=1:9,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数Kp=____ kPa(列出计算式即可,Kp为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数);若其他条件不变,将A点对应起始反应物置于某恒容密闭容器中,则乙苯的平衡转化率____ (填“>”“<”或“=”)60%。
(3)实验测得,乙苯脱氢反应的速率方程为v正=k正∙P乙苯,v逆=k逆∙P苯乙醚∙P氢气(k正、k逆为速率常数)。如图2(lgk表示速率常数的对数; 表示表示温度的倒数)所示,①②③④四条斜线中,lgk逆随
表示表示温度的倒数)所示,①②③④四条斜线中,lgk逆随 变化关系的是斜线③,则lgk正随
变化关系的是斜线③,则lgk正随 变化关系的是斜线
变化关系的是斜线_______ 。

(4)近年来,用CO2作为温和氧化剂,选择性氧化乙苯制苯乙烯的绿色反应体系不断取得新进展。在CO2气氛下,乙苯脱氢反应可能存在一步法和二步法两种途径,如图3所示。

则CO2(g)+ (g)
(g)
 (g)+CO(g)+H2O(g)反应的平衡常数K=
(g)+CO(g)+H2O(g)反应的平衡常数K=_____ (用含K1、K2的代数式表示)。
 (g)
(g)
 (g)+H2(g) ∆H1。
(g)+H2(g) ∆H1。(1)已知:部分化学键的键能数据如下表所示:
| 共价键 | C-C | C-H | C=C | H-H |
| 键能/(kJ∙mol-1) | 347.7 | 413.4 | 615 | 436 |
(2)实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压(101kPa)的条件下进行反应。乙苯的平衡转化率与温度、投料比m[m=
 ]的关系如图1所示。
]的关系如图1所示。
①掺入水蒸气的目的是
②投料比(m1、m2、m3)由大到小的顺序为
③若投料比m=1:9,反应温度为600℃,并保持体系总压为常压的条件下进行反应,下列事实不能作为该反应达到平衡的依据的是
a.V正(乙苯)=v逆(乙苯)
b.容器内气体密度不再变化
c.容器内气体的平均相对分子质量不再变化
d.苯乙烯的体积分数不再变化。
e.容器内苯乙烯与H2的物质的量之比不再变化
④若m2=1:9,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数Kp=
(3)实验测得,乙苯脱氢反应的速率方程为v正=k正∙P乙苯,v逆=k逆∙P苯乙醚∙P氢气(k正、k逆为速率常数)。如图2(lgk表示速率常数的对数;
 表示表示温度的倒数)所示,①②③④四条斜线中,lgk逆随
表示表示温度的倒数)所示,①②③④四条斜线中,lgk逆随 变化关系的是斜线③,则lgk正随
变化关系的是斜线③,则lgk正随 变化关系的是斜线
变化关系的是斜线
(4)近年来,用CO2作为温和氧化剂,选择性氧化乙苯制苯乙烯的绿色反应体系不断取得新进展。在CO2气氛下,乙苯脱氢反应可能存在一步法和二步法两种途径,如图3所示。

则CO2(g)+
 (g)
(g)
 (g)+CO(g)+H2O(g)反应的平衡常数K=
(g)+CO(g)+H2O(g)反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】工业上用接触法制硫酸的原理之一是 的催化氧化反应:
的催化氧化反应: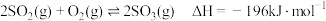 。
。
(1)几种物质的相对能量如下表所示。
科学研究发现, 对反应
对反应 有促进作用,其反应历程分两步,能量变化如图甲所示。
有促进作用,其反应历程分两步,能量变化如图甲所示。
① ;
;
②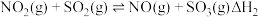 ;
;

从能量角度分析,在该反应中 的作用是
的作用是_____ 。根据图甲可知,反应_____ (填“①”或“②")控制总反应速率;
_____  。
。
(2)在体积相同的甲、乙两个密闭容器中,起始投入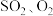 的量完全相同,在不同条件下发生上述反应。
的量完全相同,在不同条件下发生上述反应。
下列推断正确的是_____(填字母)。
(3)在恒容密闭容器中起始按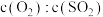 为
为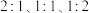 投料,测得
投料,测得 的平衡转化率与投料比
的平衡转化率与投料比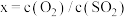 、温度
、温度 的关系如图乙所示。
的关系如图乙所示。

① 代表的投料比为
代表的投料比为_____ 。
②随着温度不断升高,不同投料比对应的平衡转化率趋向相同,其主要原因是_____ 。
③M点对应的总压强为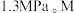 点对应的温度下,该反应的标准平衡常数
点对应的温度下,该反应的标准平衡常数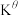 为
为_____ (填数值)[已知:用各组分的标准分压计算的平衡常数叫标准平衡常数,分压=总压 该组分物质的量分数,标准分压
该组分物质的量分数,标准分压 为参照标准);
为参照标准); 。
。
④在 时,向恒容密闭容器中充入
时,向恒容密闭容器中充入 三种气体,它们的分压依次为
三种气体,它们的分压依次为 、0.3MPa、0.5MPa,此时反应正
、0.3MPa、0.5MPa,此时反应正_____ (填“向右进行”“向左进行”或“处于平衡状态”)。
 的催化氧化反应:
的催化氧化反应: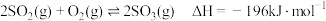 。
。(1)几种物质的相对能量如下表所示。
| 物质 |  | 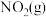 |  |  |
相对能量( ) ) | 100 | 429 | 0 | 486 |
 对反应
对反应 有促进作用,其反应历程分两步,能量变化如图甲所示。
有促进作用,其反应历程分两步,能量变化如图甲所示。①
 ;
;②
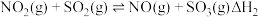 ;
;
从能量角度分析,在该反应中
 的作用是
的作用是
 。
。(2)在体积相同的甲、乙两个密闭容器中,起始投入
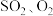 的量完全相同,在不同条件下发生上述反应。
的量完全相同,在不同条件下发生上述反应。| 甲 | 乙 | |
| 发生条件 | 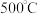 、恒容 、恒容 | 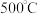 、恒压 、恒压 |
| 平衡常数 |  |  |
 的平均转化率 的平均转化率 | 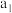 | 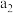 |
 | 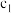 | 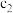 |
| 混合气体平均摩尔质量 |  |  |
A. | B. | C. | D. |
(3)在恒容密闭容器中起始按
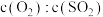 为
为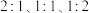 投料,测得
投料,测得 的平衡转化率与投料比
的平衡转化率与投料比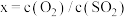 、温度
、温度 的关系如图乙所示。
的关系如图乙所示。
①
 代表的投料比为
代表的投料比为②随着温度不断升高,不同投料比对应的平衡转化率趋向相同,其主要原因是
③M点对应的总压强为
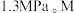 点对应的温度下,该反应的标准平衡常数
点对应的温度下,该反应的标准平衡常数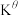 为
为 该组分物质的量分数,标准分压
该组分物质的量分数,标准分压 为参照标准);
为参照标准);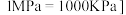 。
。④在
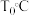 时,向恒容密闭容器中充入
时,向恒容密闭容器中充入 三种气体,它们的分压依次为
三种气体,它们的分压依次为 、0.3MPa、0.5MPa,此时反应正
、0.3MPa、0.5MPa,此时反应正
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝、脱硫.
(1)利用氧水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:SO2(g)+NH3•H2O(aq)═NH4HSO3(aq)△H1=a kJ•mol﹣1
NH3•H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol﹣1
2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJ•mol﹣1
①反应2SO2(g)+4NH3•H2O(aq)+O2(g)═2(NH4)2SO4(aq)+2H2O(l)的△H=________ kJ•mol﹣1.
②空气氧化(NH4)2SO3的速率随温度的变化如图1所示,则空气氧化(NH4)2SO3的适宜温度为_____ .


③合成氨用的氢气是以甲烷为原料制得:CH4(g)+H2O(g)⇌CO(g)+3H2(g).而混有的CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌ [Cu(NH3)3]CH3COO•CO(l);△H<0.吸收CO后的乙酸二氨合铜(I)溶液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是_____ .(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(2)NH3催化氧化可制备硝酸.4NH3(g)+5O2(g)═4NO(g)+6H2O(g)生成的NO被O2氧化为NO2.其他条件不变时,NO的氧化率与温度、压强的关系如图2所示.则p1_____ p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是_________ .
(1)利用氧水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:SO2(g)+NH3•H2O(aq)═NH4HSO3(aq)△H1=a kJ•mol﹣1
NH3•H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol﹣1
2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJ•mol﹣1
①反应2SO2(g)+4NH3•H2O(aq)+O2(g)═2(NH4)2SO4(aq)+2H2O(l)的△H=
②空气氧化(NH4)2SO3的速率随温度的变化如图1所示,则空气氧化(NH4)2SO3的适宜温度为


③合成氨用的氢气是以甲烷为原料制得:CH4(g)+H2O(g)⇌CO(g)+3H2(g).而混有的CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌ [Cu(NH3)3]CH3COO•CO(l);△H<0.吸收CO后的乙酸二氨合铜(I)溶液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(2)NH3催化氧化可制备硝酸.4NH3(g)+5O2(g)═4NO(g)+6H2O(g)生成的NO被O2氧化为NO2.其他条件不变时,NO的氧化率与温度、压强的关系如图2所示.则p1
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】化学反应原理对化学反应的研究具有指导意义。
(1)目前城市机动车废气的排放已成为城市大气污染的重要来源。气缸中生成NO 的反应为: N2(g)+O2(g) 2NO(g)。
2NO(g)。
①汽车启动后,气缸内温度越高,单位时间内NO 排放量越大,可能的原因是___________ 。
②可用 NH3催化还原NO 消除污染,写出该反应的化学方程式______________________ 。
③CO还原NO的反应机理及相对能量如图(TS 表示过渡态):
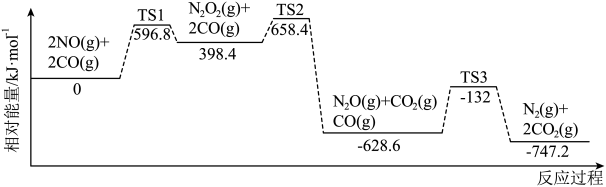
反应过程中速率最慢步骤的热化学方程式为_____________________ 。
(2)已知热化学方程式:
I.SO2(g)+I2(g)+2H2O(g)= 2HI(g)+H2SO4(1) △H1= xkJ·mol-1
Ⅱ.2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) △H2= ykJ·mol-1
Ⅲ.H2(g)+I2(g)=2HI(g) △H3= zkJ·mol-1
则:2H2O(g)= 2H2(g)+O2(g) △H=_________ kJ·mol-1。
(3)已知部分共价键的键能与热化学方程式信息如表:
则2O(g)=O2(g) 的△H 为___________ 。
(4)氢气可通过水煤气法获得,反应为CO(g)+H2O(g) CO2(g)+H2(g)。一定温度下,控制进气比n(CO):n(H2O)不同,测得平衡时某反应物的转化率如图所示:
CO2(g)+H2(g)。一定温度下,控制进气比n(CO):n(H2O)不同,测得平衡时某反应物的转化率如图所示:
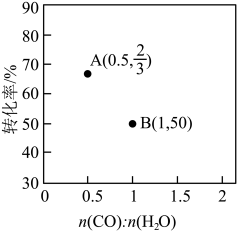
①图中表示的是_________ (填“CO”或“H2O”)的转化率。
②n(CO):n(H2O)=0.2 时,图中对应物质的转化率为__________ 。
(1)目前城市机动车废气的排放已成为城市大气污染的重要来源。气缸中生成NO 的反应为: N2(g)+O2(g)
 2NO(g)。
2NO(g)。①汽车启动后,气缸内温度越高,单位时间内NO 排放量越大,可能的原因是
②可用 NH3催化还原NO 消除污染,写出该反应的化学方程式
③CO还原NO的反应机理及相对能量如图(TS 表示过渡态):

反应过程中速率最慢步骤的热化学方程式为
(2)已知热化学方程式:
I.SO2(g)+I2(g)+2H2O(g)= 2HI(g)+H2SO4(1) △H1= xkJ·mol-1
Ⅱ.2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) △H2= ykJ·mol-1
Ⅲ.H2(g)+I2(g)=2HI(g) △H3= zkJ·mol-1
则:2H2O(g)= 2H2(g)+O2(g) △H=
(3)已知部分共价键的键能与热化学方程式信息如表:
| 共价键 | H-H | H-O |
| 键能/( kJ·mol-1) | 436 | 463 |
| 热化学方程式 | 2H2(g)+O2(g) =2H2O(g) △H=-482kJ·mol-1 | |
(4)氢气可通过水煤气法获得,反应为CO(g)+H2O(g)
 CO2(g)+H2(g)。一定温度下,控制进气比n(CO):n(H2O)不同,测得平衡时某反应物的转化率如图所示:
CO2(g)+H2(g)。一定温度下,控制进气比n(CO):n(H2O)不同,测得平衡时某反应物的转化率如图所示:
①图中表示的是
②n(CO):n(H2O)=0.2 时,图中对应物质的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】丙烯是工业上合成精细化学的原料,随着天然气和页岩气的可用性不断提高,丙烷脱氢和丙烷氧化脱氢受到了人们越来越多的关注。已知,
主反应:
副反应:

(1)相关键能的数据如下表所示:
则丙烷脱氢反应的热化学方程式为

___________  ,根据化学原理,可以同时提高化学反应速率并提高
,根据化学原理,可以同时提高化学反应速率并提高 转化率的措施是
转化率的措施是___________ 。
(2)用丙烷制备丙烯的机理如图所示,该反应的快慢取决于步骤___________ (填写Ⅰ、Ⅱ、Ⅲ),该反应的催化剂为___________ 。
(3)在恒温条件下,向起始压强为 的恒压容器中通入
的恒压容器中通入 和
和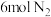 发生反应(
发生反应( 不参与反应)。
不参与反应)。
①下列情况能表明达到平衡状态的是___________ 。
A. 与
与 的浓度相等 B.
的浓度相等 B. 的体积分数不再改变
的体积分数不再改变
C.反应容器中压强保持不变 D.气体密度不再改变
②经过 反应达到平衡,测得
反应达到平衡,测得 的平衡转化率为50%,该条件下
的平衡转化率为50%,该条件下 的选择性为80%,则主反应的平衡常数
的选择性为80%,则主反应的平衡常数
___________ kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。
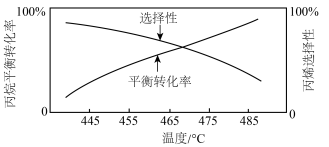
(4)已知:在纤维状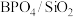 催化剂作用下,平衡时丙烷的转化率和丙烯的选择性(丙烯的选择性=
催化剂作用下,平衡时丙烷的转化率和丙烯的选择性(丙烯的选择性=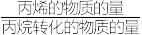 ×100%)随温度的变化如图所示,丙烷的平衡转化率增大的原因是
×100%)随温度的变化如图所示,丙烷的平衡转化率增大的原因是___________ 。
主反应:

副反应:


(1)相关键能的数据如下表所示:
| 化学键 | C—C | C=C | C—H | H—H |
键能 | 348 | 615 | 413 | 436 |


 ,根据化学原理,可以同时提高化学反应速率并提高
,根据化学原理,可以同时提高化学反应速率并提高 转化率的措施是
转化率的措施是(2)用丙烷制备丙烯的机理如图所示,该反应的快慢取决于步骤

(3)在恒温条件下,向起始压强为
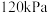 的恒压容器中通入
的恒压容器中通入 和
和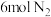 发生反应(
发生反应( 不参与反应)。
不参与反应)。①下列情况能表明达到平衡状态的是
A.
 与
与 的浓度相等 B.
的浓度相等 B. 的体积分数不再改变
的体积分数不再改变C.反应容器中压强保持不变 D.气体密度不再改变
②经过
 反应达到平衡,测得
反应达到平衡,测得 的平衡转化率为50%,该条件下
的平衡转化率为50%,该条件下 的选择性为80%,则主反应的平衡常数
的选择性为80%,则主反应的平衡常数
(4)已知:在纤维状
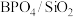 催化剂作用下,平衡时丙烷的转化率和丙烯的选择性(丙烯的选择性=
催化剂作用下,平衡时丙烷的转化率和丙烯的选择性(丙烯的选择性=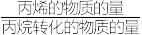 ×100%)随温度的变化如图所示,丙烷的平衡转化率增大的原因是
×100%)随温度的变化如图所示,丙烷的平衡转化率增大的原因是
您最近一年使用:0次
【推荐3】甲醇是一种重要的化工原料,在生产生活中应用广泛,可用多种原料合成,回答下列问题:
(1)已知甲烷、甲醇、氢气的标准燃烧热分别为-890.3 、-726.5
、-726.5 、-285.8
、-285.8 ,则反应
,则反应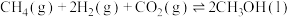 的△H=
的△H=_______  。
。
(2) 在NiO支撑的
在NiO支撑的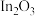 (110)D催化剂表面合成甲醇的反应历程如图,TS表示过渡态。
(110)D催化剂表面合成甲醇的反应历程如图,TS表示过渡态。

①基态Ni原子中占据最高能层的电子所在轨道的电子云轮廓图为_______ 形。
②该过程中决速步骤的活化能为_______ eV。
(3)一定条件下,CO与 经催化也可以合成甲醇,反应原理为
经催化也可以合成甲醇,反应原理为 。
。
①该反应分为两步,通过对反应历程进行研究发现催化剂表面出现HCHO,其物质的量先增大后减小,请推测出现该现象的原因:_______ 。
②T℃下,向一体积为2L的恒温恒容密闭容器中充入1mol CO、3mol 发生该反应,达到平衡时,CO与
发生该反应,达到平衡时,CO与 的物质的量之比为2:3,气体总压为1.4MPa,则
的物质的量之比为2:3,气体总压为1.4MPa,则 的平衡转化率为
的平衡转化率为_______ ,该反应的压强平衡常数 为
为_______  (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
(4)以酸性甲醇燃料电池作为外接电源电解As制备 的装置如图所示,酸性甲醇燃料电池的负极应连接
的装置如图所示,酸性甲醇燃料电池的负极应连接_______ (填“X”或“Y”)极,写出X电极生成 的电极反应式:
的电极反应式:_______ 。

(1)已知甲烷、甲醇、氢气的标准燃烧热分别为-890.3
 、-726.5
、-726.5 、-285.8
、-285.8 ,则反应
,则反应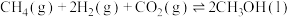 的△H=
的△H= 。
。(2)
 在NiO支撑的
在NiO支撑的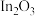 (110)D催化剂表面合成甲醇的反应历程如图,TS表示过渡态。
(110)D催化剂表面合成甲醇的反应历程如图,TS表示过渡态。
①基态Ni原子中占据最高能层的电子所在轨道的电子云轮廓图为
②该过程中决速步骤的活化能为
(3)一定条件下,CO与
 经催化也可以合成甲醇,反应原理为
经催化也可以合成甲醇,反应原理为 。
。①该反应分为两步,通过对反应历程进行研究发现催化剂表面出现HCHO,其物质的量先增大后减小,请推测出现该现象的原因:
②T℃下,向一体积为2L的恒温恒容密闭容器中充入1mol CO、3mol
 发生该反应,达到平衡时,CO与
发生该反应,达到平衡时,CO与 的物质的量之比为2:3,气体总压为1.4MPa,则
的物质的量之比为2:3,气体总压为1.4MPa,则 的平衡转化率为
的平衡转化率为 为
为 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。(4)以酸性甲醇燃料电池作为外接电源电解As制备
 的装置如图所示,酸性甲醇燃料电池的负极应连接
的装置如图所示,酸性甲醇燃料电池的负极应连接 的电极反应式:
的电极反应式:
您最近一年使用:0次
【推荐1】重要非金属元素C、N,在工农业生产和绿色环保中有广泛的应用。
(1)为了达到“碳中和”的目标,降低空气中二氧化碳含量的一项技术是 耦合乙苯(
耦合乙苯(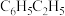 ,简称EB)脱氢制备苯乙烯(
,简称EB)脱氢制备苯乙烯(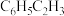 ,简称ST)。主要反应如下:
,简称ST)。主要反应如下:
I.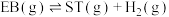

II.

0.1MPa下分别通入三种不同配比的原料气:纯净的EB;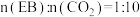 ;
; ,测得EB的平衡转化率与温度的变化关系如图1所示。
,测得EB的平衡转化率与温度的变化关系如图1所示。

①图1中,表示原料气配比 的曲线是曲线
的曲线是曲线_______ (填“a”或“b”)。
② 能显著提高EB的平衡转化率,从化学平衡移动的角度解释
能显著提高EB的平衡转化率,从化学平衡移动的角度解释 的作用:
的作用:_______ 。
③研究表明,EB脱氢反应主要在催化剂表面的晶格O上发生,机理如图2所示:

该历程中,EB脱氢反应的速率由步骤_______ (填“I”或“II”)决定。
(2)肼( )具有高含氢量,被视为一种极具应用潜力的液相化学储氢材料。在常规催化剂催化作用下,
)具有高含氢量,被视为一种极具应用潜力的液相化学储氢材料。在常规催化剂催化作用下,
25℃时,在一硬质玻璃烧瓶中,足量 分解发生如下两个反应:
分解发生如下两个反应:
反应i: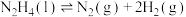
反应ii:
已知:用 表示物质的量分数平衡常数,其表达式写法:在浓度平衡常数表达式中,用物质的量分数代替浓度。平衡时,测得烧瓶中压强为33kPa,
表示物质的量分数平衡常数,其表达式写法:在浓度平衡常数表达式中,用物质的量分数代替浓度。平衡时,测得烧瓶中压强为33kPa,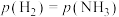 ,则体积分数
,则体积分数 为
为_______ ,反应i的 为
为_______ (保留两位有效数字)。
(3)工业上合成氨反应为 ,为了提高反应中反应物的转化率,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氨比[
,为了提高反应中反应物的转化率,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氨比[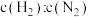 ]为3时,平衡时氨气的含量关系式为:
]为3时,平衡时氨气的含量关系式为: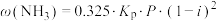 ,(
,( 表示平衡常数;P表示平衡体系压强;i表示惰性气体体积分数)。当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为ω。若温度不变,体系中有13%的惰性气体,此时增大压强,
表示平衡常数;P表示平衡体系压强;i表示惰性气体体积分数)。当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为ω。若温度不变,体系中有13%的惰性气体,此时增大压强, 将
将_______ (填“变大”、“变小”或“不变”);欲使平衡时氨气的含量仍为ω,应将压强调整至_______ MPa(保留两位有效数字)。
(4)工业含NaCN的废水常用电化学法处理,装置如图3所示。
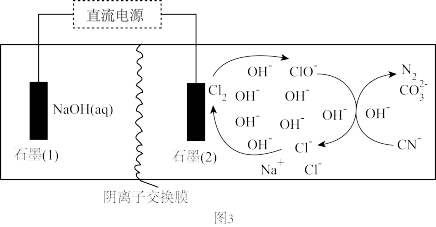
处理 的离子方程式为
的离子方程式为_______ 。石墨(1)上产生4.48L气体(标准状况),理论上右室中阴离子物质的量的变化量为_______ 。
(1)为了达到“碳中和”的目标,降低空气中二氧化碳含量的一项技术是
 耦合乙苯(
耦合乙苯(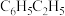 ,简称EB)脱氢制备苯乙烯(
,简称EB)脱氢制备苯乙烯(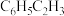 ,简称ST)。主要反应如下:
,简称ST)。主要反应如下:I.
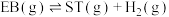

II.


0.1MPa下分别通入三种不同配比的原料气:纯净的EB;
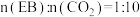 ;
; ,测得EB的平衡转化率与温度的变化关系如图1所示。
,测得EB的平衡转化率与温度的变化关系如图1所示。
①图1中,表示原料气配比
 的曲线是曲线
的曲线是曲线②
 能显著提高EB的平衡转化率,从化学平衡移动的角度解释
能显著提高EB的平衡转化率,从化学平衡移动的角度解释 的作用:
的作用:③研究表明,EB脱氢反应主要在催化剂表面的晶格O上发生,机理如图2所示:

该历程中,EB脱氢反应的速率由步骤
(2)肼(
 )具有高含氢量,被视为一种极具应用潜力的液相化学储氢材料。在常规催化剂催化作用下,
)具有高含氢量,被视为一种极具应用潜力的液相化学储氢材料。在常规催化剂催化作用下,25℃时,在一硬质玻璃烧瓶中,足量
 分解发生如下两个反应:
分解发生如下两个反应:反应i:
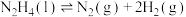
反应ii:

已知:用
 表示物质的量分数平衡常数,其表达式写法:在浓度平衡常数表达式中,用物质的量分数代替浓度。平衡时,测得烧瓶中压强为33kPa,
表示物质的量分数平衡常数,其表达式写法:在浓度平衡常数表达式中,用物质的量分数代替浓度。平衡时,测得烧瓶中压强为33kPa,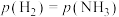 ,则体积分数
,则体积分数 为
为 为
为(3)工业上合成氨反应为
 ,为了提高反应中反应物的转化率,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氨比[
,为了提高反应中反应物的转化率,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氨比[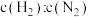 ]为3时,平衡时氨气的含量关系式为:
]为3时,平衡时氨气的含量关系式为: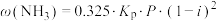 ,(
,( 表示平衡常数;P表示平衡体系压强;i表示惰性气体体积分数)。当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为ω。若温度不变,体系中有13%的惰性气体,此时增大压强,
表示平衡常数;P表示平衡体系压强;i表示惰性气体体积分数)。当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为ω。若温度不变,体系中有13%的惰性气体,此时增大压强, 将
将(4)工业含NaCN的废水常用电化学法处理,装置如图3所示。

处理
 的离子方程式为
的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】二氧化碳合成有机物的综合利用有利于碳中和。涉及的反应有:
反应I:
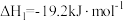 ;
;
反应II: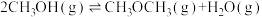
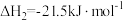 ;
;
反应III:
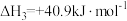 ;
;
反应IV: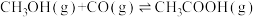
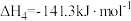 。
。
(1)工业上常用乙酸的热裂解反应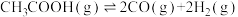 制氢,则该反应
制氢,则该反应
___________ kJ·mol-1。在恒容密闭容器中,加入一定量的乙酸蒸气,在催化剂作用下发生热裂解反应和脱羧基反应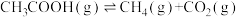 ,在相同时间测得温度与气体产率的关系如图。
,在相同时间测得温度与气体产率的关系如图。___________ 。
②若保持其他条件不变,向密闭容器中加入一定量的水,氢气产率显著提高,而CO产率下降,原因为___________ (用化学方程式解释)。
(2)若在TK条件下,向VL密闭容器中充入1molCO2和3molH2,压强为pkPa,发生上述反应I、II、III、IV。CO2的平衡转化率和生成物的选择性随温度的变化如图。已知:DMF表示CH3OCH3,生成物A的选择性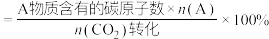 。
。___________ (填标号)。
②则平衡时n(CH3OH)=___________ mol。
③反应III的Kp=___________ 。
④平衡时,保持其他条件不变,若缩小容器体积,则n(CO)________ (填“增大”、“等于”或“减小”)。
反应I:

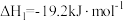 ;
;反应II:
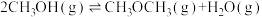
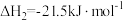 ;
;反应III:

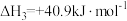 ;
;反应IV:
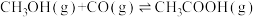
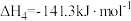 。
。(1)工业上常用乙酸的热裂解反应
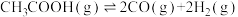 制氢,则该反应
制氢,则该反应
 ,在相同时间测得温度与气体产率的关系如图。
,在相同时间测得温度与气体产率的关系如图。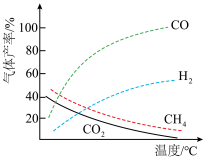
②若保持其他条件不变,向密闭容器中加入一定量的水,氢气产率显著提高,而CO产率下降,原因为
(2)若在TK条件下,向VL密闭容器中充入1molCO2和3molH2,压强为pkPa,发生上述反应I、II、III、IV。CO2的平衡转化率和生成物的选择性随温度的变化如图。已知:DMF表示CH3OCH3,生成物A的选择性
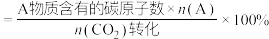 。
。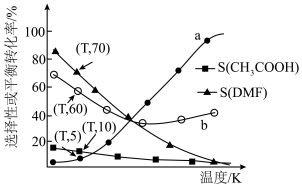
②则平衡时n(CH3OH)=
③反应III的Kp=
④平衡时,保持其他条件不变,若缩小容器体积,则n(CO)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】I.钾是一种活泼金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应: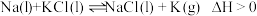 。
。
该反应的平衡常数可表示: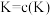 ,各物质的沸点与压强的关系见下表:
,各物质的沸点与压强的关系见下表:
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为________ ,而反应的最高温度应低于________ 。
(2)制取钾的过程中,为了提高原料的转化率可以采取的措施是________________ 。
(3)常压下,当反应温度升高到 时,该反应的平衡常数可表示为
时,该反应的平衡常数可表示为________ 。
II.
(4) 可用于合成甲醇,反应的化学方程式为
可用于合成甲醇,反应的化学方程式为 。
。 在不同温度下的平衡转化率与压强的关系如下图所示。该反应
在不同温度下的平衡转化率与压强的关系如下图所示。该反应
________ (填“>”或“<”)0。实际生产条件控制在 、
、 左右,选择此压强的理由是
左右,选择此压强的理由是________________________ 。

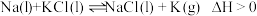 。
。该反应的平衡常数可表示:
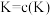 ,各物质的沸点与压强的关系见下表:
,各物质的沸点与压强的关系见下表:压强/ | 13.33 | 53.32 | 101.3 |
K的沸点/ | 590 | 710 | 770 |
| 700 | 830 | 890 |
| 1437 | ||
| 1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为
(2)制取钾的过程中,为了提高原料的转化率可以采取的措施是
(3)常压下,当反应温度升高到
 时,该反应的平衡常数可表示为
时,该反应的平衡常数可表示为II.
(4)
 可用于合成甲醇,反应的化学方程式为
可用于合成甲醇,反应的化学方程式为 。
。 在不同温度下的平衡转化率与压强的关系如下图所示。该反应
在不同温度下的平衡转化率与压强的关系如下图所示。该反应
 、
、 左右,选择此压强的理由是
左右,选择此压强的理由是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g)∆H1=-53.7kJ/mol
CH3OH(g)+H2O(g)∆H1=-53.7kJ/mol
II.CO2(g)+H2(g) CO(g)+H2O(g)∆H2
CO(g)+H2O(g)∆H2
某实验控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知:①CO和H2的标准燃烧热分别为-283.0kJ/mol和285.8kJ/mol
②H2O(1) H2O(g)∆H3=+440kJ/mol
H2O(g)∆H3=+440kJ/mol
请回答(不考虑温度对∆H的影响):
(1)a.反应II的∆H2=____ kJ/mol。
b.800℃时,反应I和II对应的平衡常数分别为1.0和2.5,则该温度下反应:CO(g)+2H2(g) CH3OH(g)的平衡常数K的数值为
CH3OH(g)的平衡常数K的数值为_____ 。
(2)在图中分别画出I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的催化剂)____ 。

(3)工业生产甲醇还有如下方法:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
副反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
若生产过理中在恒压条件下通入水蒸气,从化学平衡的角度分析该操作对生产甲醇带来的利和弊____ 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(1、I、III)作用下,CH4产量随光照时间的变化如下图所示。下列说法正确的是____
A.催化剂能加快化学反应速率,在反应开始时对正反应的催化效果更好
B.从图中可知催化剂I的催化效果更好
C.若光照时间足够长,三条由线将相交于一点
D.光照15h前,无论用所给的哪种催化剂,该反应均未达到平衡
(5)人们正在研究某种锂一空气电池,它是一种环境友好的蓄电池。放电时的总反应为:4Li+O2=2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可是按两步反应进行,请补充完整。
电极反应式:______ 和Li2O2-2e-=2Li++O2
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)∆H1=-53.7kJ/mol
CH3OH(g)+H2O(g)∆H1=-53.7kJ/molII.CO2(g)+H2(g)
 CO(g)+H2O(g)∆H2
CO(g)+H2O(g)∆H2某实验控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知:①CO和H2的标准燃烧热分别为-283.0kJ/mol和285.8kJ/mol
②H2O(1)
 H2O(g)∆H3=+440kJ/mol
H2O(g)∆H3=+440kJ/mol请回答(不考虑温度对∆H的影响):
(1)a.反应II的∆H2=
b.800℃时,反应I和II对应的平衡常数分别为1.0和2.5,则该温度下反应:CO(g)+2H2(g)
 CH3OH(g)的平衡常数K的数值为
CH3OH(g)的平衡常数K的数值为(2)在图中分别画出I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的催化剂)

(3)工业生产甲醇还有如下方法:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)副反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)若生产过理中在恒压条件下通入水蒸气,从化学平衡的角度分析该操作对生产甲醇带来的利和弊
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(1、I、III)作用下,CH4产量随光照时间的变化如下图所示。下列说法正确的是
A.催化剂能加快化学反应速率,在反应开始时对正反应的催化效果更好
B.从图中可知催化剂I的催化效果更好
C.若光照时间足够长,三条由线将相交于一点
D.光照15h前,无论用所给的哪种催化剂,该反应均未达到平衡

(5)人们正在研究某种锂一空气电池,它是一种环境友好的蓄电池。放电时的总反应为:4Li+O2=2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可是按两步反应进行,请补充完整。
电极反应式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:
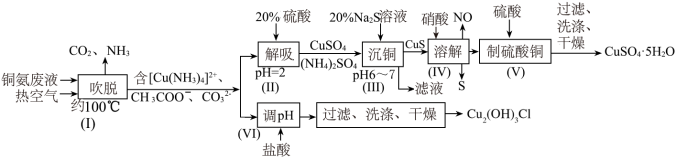
(1)步骤(Ⅰ)“吹脱”的目的是___ (写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___ (填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___ 。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___ 。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___ ,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___ 。
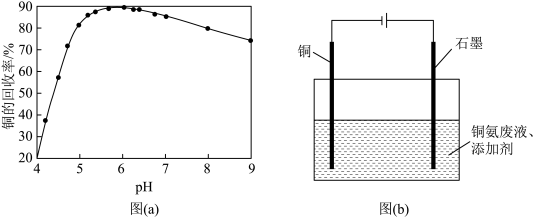
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___ ;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___ (填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO4·5H2O375g,则1L废液中含有铜元素的质量为___ g。(保留整数)

(1)步骤(Ⅰ)“吹脱”的目的是
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为

(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO4·5H2O375g,则1L废液中含有铜元素的质量为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐3】A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂。
(1)写出B的电子式_________________
(2)写出反应⑤的化学方程式:_________________________________ 。
(3)写出反应⑦的离子方程式:_________________________________ 。
(4) 向AlCl3溶液中加入少量 固体B,写出反应的化学方程式:______________________ 。
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则________ 极(填“阴”或“阳”)附近溶液先由无色变为红色,请说明理由:_____________________________________ 。

(1)写出B的电子式
(2)写出反应⑤的化学方程式:
(3)写出反应⑦的离子方程式:
(4) 向AlCl3溶液中加入
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则
您最近一年使用:0次



 的沸点/
的沸点/ 的沸点/
的沸点/ 的沸点/
的沸点/

