无水氯化镨(PrCl3)是制取稀土金属镨及镨合金的主要原料,采用以下工艺流程可由孪生矿(主要含ZnS、FeS、Pr2S3、SiO2等)制备氯化镨晶体(PrCl3·6H2O)。
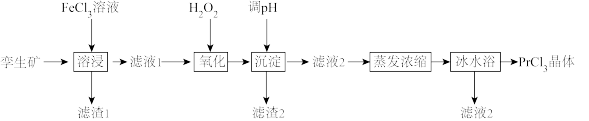
已知:①2FeCl3+ZnS=ZnCl2+2FeCl2+S;2FeCl3+FeS=3FeCl2+S
②该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
回答下列问题:
(1)①若其他条件不变,采取下列措施能提高镨元素浸出率的有_________ (填字母)。
A.适当升高溶浸温度B.适当加快搅拌速率C.适当缩短溶浸时间
②写出“溶浸”时Pr2S3发生反应的离子方程式:_________ 。
(2)“滤渣1”的主要成分是_________ 。
(3)在“沉淀”时加入氨水逐步调节溶液的pH至6.5,依次析出的金属离子是_________ ;已知Fe(OH)3在隔绝空气的条件下与FeS2混合焙烧时生成Fe3O4和S,写出该反应的化学方程式:_________ 。
(4)①利用电解法可以生产金属镨。先将氯化镨与工业纯KCl配成二元电解质体系(PrCl3-KCl);然后置于石墨电解槽内熔化,通入直流电进行电解。电解过程中得到金属镨的电极反应式为_________ 。
②科学家以氯化镨气溶胶为前驱体,研究了PrCl3·6H2O的高温热解机制。利用X射线衍射技术分析,其结果如下表所示:
以上热解产物中,热稳定性最差的是_________ (填化学式)。氯化镨的高温热解过程主要是发生PrCl3的水解反应、Pr(OH)2Cl的脱水反应和PrOCl的氧化反应,从表中数据分析1100℃时热解产物主要为PrO2而无PrOCl的原因是_________ 。

已知:①2FeCl3+ZnS=ZnCl2+2FeCl2+S;2FeCl3+FeS=3FeCl2+S
②该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
| 金属离子 | Zn2+ | Fe3+ | Fe2+ |
| 开始沉淀时的pH | 5.4 | 2.2 | 7.5 |
| 沉淀完全时的pH | 6.4 | 3.2 | 9.0 |
回答下列问题:
(1)①若其他条件不变,采取下列措施能提高镨元素浸出率的有
A.适当升高溶浸温度B.适当加快搅拌速率C.适当缩短溶浸时间
②写出“溶浸”时Pr2S3发生反应的离子方程式:
(2)“滤渣1”的主要成分是
(3)在“沉淀”时加入氨水逐步调节溶液的pH至6.5,依次析出的金属离子是
(4)①利用电解法可以生产金属镨。先将氯化镨与工业纯KCl配成二元电解质体系(PrCl3-KCl);然后置于石墨电解槽内熔化,通入直流电进行电解。电解过程中得到金属镨的电极反应式为
②科学家以氯化镨气溶胶为前驱体,研究了PrCl3·6H2O的高温热解机制。利用X射线衍射技术分析,其结果如下表所示:
| 热解温度/℃ | 氯化镨气溶胶的热解产物 |
| 600 | Pr(OH)2Cl和PrOCl |
| 700~1000 | Pr(OH)2Cl、PrOCl和PrO2 |
| 1100 | PrO2和Pr(OH)2Cl |
以上热解产物中,热稳定性最差的是
更新时间:2022-03-29 10:15:58
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某化学兴趣小组设计如下实验探究硫代硫酸钠( )的化学性质。
)的化学性质。
资料:① 溶液在酸性条件下分解:
溶液在酸性条件下分解:
②
回答下列问题:
I.实验一 溶液的酸碱性
溶液的酸碱性
(1)可用_______ 试纸测定 该溶液的酸碱性。
该溶液的酸碱性。
II.实验二 溶液的还原性
溶液的还原性
取溴水于试管中,滴加 溶液至溴水褪色。
溶液至溴水褪色。
(2)该反应的离子方程式为_______ 。
III.实验三 探究 的热分解产物
的热分解产物
设计如图所示装置进行实验,实验过程中观察到试管内固体熔化、沸腾。反应后,试管中观察到白色物质夹杂着较多淡黄色固体。
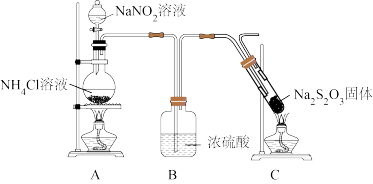
(3)实验开始时,应先点燃_______ 处的酒精灯,目的是_______ 。
(4)兴趣小组对分解产物的组成提出四种观点:
甲观点: 、S乙观点:
、S乙观点: 、
、 、S
、S
丙观点: 、S丁观点:
、S丁观点: 、
、 、S
、S
①为了证明丙观点是错误的,需检验产物中有 ,实验方案是
,实验方案是_______ 。
②取少量固体加入稀硫酸,将生成的气体通入品红溶液,观察到品红溶液褪色。该实验不能证明产物中一定有 ,理由是
,理由是_______ 。
③甲和乙观点是错误的,说明理由_______ (任选一种观点回答)。
④经实验证实,丁观点是正确的。写出分解反应的化学方程式:_______ 。
 )的化学性质。
)的化学性质。资料:①
 溶液在酸性条件下分解:
溶液在酸性条件下分解:
②

回答下列问题:
I.实验一
 溶液的酸碱性
溶液的酸碱性(1)可用
 该溶液的酸碱性。
该溶液的酸碱性。II.实验二
 溶液的还原性
溶液的还原性取溴水于试管中,滴加
 溶液至溴水褪色。
溶液至溴水褪色。(2)该反应的离子方程式为
III.实验三 探究
 的热分解产物
的热分解产物设计如图所示装置进行实验,实验过程中观察到试管内固体熔化、沸腾。反应后,试管中观察到白色物质夹杂着较多淡黄色固体。

(3)实验开始时,应先点燃
(4)兴趣小组对分解产物的组成提出四种观点:
甲观点:
 、S乙观点:
、S乙观点: 、
、 、S
、S丙观点:
 、S丁观点:
、S丁观点: 、
、 、S
、S①为了证明丙观点是错误的,需检验产物中有
 ,实验方案是
,实验方案是②取少量固体加入稀硫酸,将生成的气体通入品红溶液,观察到品红溶液褪色。该实验不能证明产物中一定有
 ,理由是
,理由是③甲和乙观点是错误的,说明理由
④经实验证实,丁观点是正确的。写出分解反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】 易溶于水、乙醇和乙醚,常用作漂白剂和还原剂,
易溶于水、乙醇和乙醚,常用作漂白剂和还原剂, 在酸性条件下还原性较差,碱性条件下较强。某实验小组用如下装置制备
在酸性条件下还原性较差,碱性条件下较强。某实验小组用如下装置制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
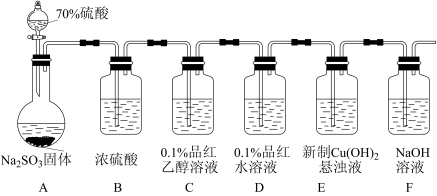
(1)装置B中浓硫酸的作用是_______ ;实验中观察到:装置C中溶液红色没有褪去,装置D中溶液红色褪去。由此可得出的结论是_______ 。
(2)为了进一步探究使品红褪色的主要微粒,进行如下系列实验:
综合上述实验推知, 水溶液使品红褪色时起主要作用的微粒是
水溶液使品红褪色时起主要作用的微粒是_______ (填微粒符号)。
(3)用 溶液和
溶液和 溶液制备
溶液制备 悬浊液,实验中观察到:装置E中生成大量白色沉淀,溶液呈绿色,与
悬浊液,实验中观察到:装置E中生成大量白色沉淀,溶液呈绿色,与 溶液、
溶液、 溶液的颜色明显不同。
溶液的颜色明显不同。
①为探究白色沉淀的成分,查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸,与氨水反应生成 ,在空气中立即被氧化成含有蓝色
,在空气中立即被氧化成含有蓝色 的溶液。
的溶液。
甲同学向洗涤后的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为 、
、_______ 。
乙同学设计一个简单实验方案证明白色沉淀为CuCl:_______ ;装置E中生成白色沉淀的离子方程式为_______ 。
②为探究E中溶液呈绿色而不是蓝色的原因,向 溶液中通入过量
溶液中通入过量 ,未见溶液颜色发生变化,目的是
,未见溶液颜色发生变化,目的是_______ ;取少量E中滤液,加入少量稀盐酸,产生无色刺激性气味气体,得到澄清蓝色溶液,故推断溶液显绿色的原因可能是溶液中含有较多 。为进一步实验确认这种可能性,向少量
。为进一步实验确认这种可能性,向少量 溶液中加入
溶液中加入_______ (填化学式),得到绿色溶液。
 易溶于水、乙醇和乙醚,常用作漂白剂和还原剂,
易溶于水、乙醇和乙醚,常用作漂白剂和还原剂, 在酸性条件下还原性较差,碱性条件下较强。某实验小组用如下装置制备
在酸性条件下还原性较差,碱性条件下较强。某实验小组用如下装置制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
(1)装置B中浓硫酸的作用是
(2)为了进一步探究使品红褪色的主要微粒,进行如下系列实验:
| 实验 | 试管中的溶液 | 滴入溶液 | 实验现象 |
| a | 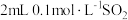 溶液( 溶液( ) ) | 各滴入1滴0.1%品红溶液 | 溶液变红逐渐变浅,约90s后完全褪色 |
| b |  溶液( 溶液( ) ) | 溶液变红后立即变浅,约15s后完全褪色 | |
| c |  溶液( 溶液(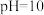 ) ) | 溶液变红后立即褪色 |
 水溶液使品红褪色时起主要作用的微粒是
水溶液使品红褪色时起主要作用的微粒是(3)用
 溶液和
溶液和 溶液制备
溶液制备 悬浊液,实验中观察到:装置E中生成大量白色沉淀,溶液呈绿色,与
悬浊液,实验中观察到:装置E中生成大量白色沉淀,溶液呈绿色,与 溶液、
溶液、 溶液的颜色明显不同。
溶液的颜色明显不同。①为探究白色沉淀的成分,查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸,与氨水反应生成
 ,在空气中立即被氧化成含有蓝色
,在空气中立即被氧化成含有蓝色 的溶液。
的溶液。甲同学向洗涤后的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为
 、
、乙同学设计一个简单实验方案证明白色沉淀为CuCl:
②为探究E中溶液呈绿色而不是蓝色的原因,向
 溶液中通入过量
溶液中通入过量 ,未见溶液颜色发生变化,目的是
,未见溶液颜色发生变化,目的是 。为进一步实验确认这种可能性,向少量
。为进一步实验确认这种可能性,向少量 溶液中加入
溶液中加入
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,工业大规模生产前,实验室先按如下流程进行模拟制备少量Mg(ClO3)2·6H2O:
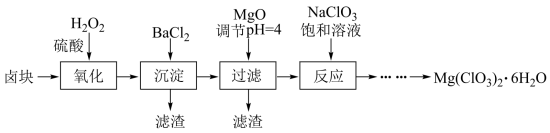
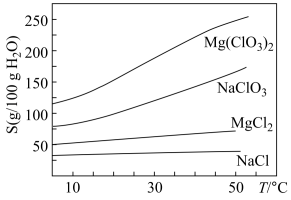
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②几种化合物的溶解度(S)随温度(T)变化曲线如右图。
(1)卤块中加H2O2的目的是________________ ,写出该反应的离子方程式__________________ 。
(2)加入BaCl2的目的是除去SO ,如何检验SO
,如何检验SO 已沉淀完全?
已沉淀完全?_________________ 。
(3)常温下,加MgO调节pH=4后溶液中c(Fe3+)=___________ (已知Ksp[Fe(OH)3=4×10-38],过滤所得滤渣的主要成分有______________ 。
(4)加入NaClO3饱和溶液公有NaCl晶体析出,写出该反应的化学方程式:___________ ,请利用该反应,结合上图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发结晶;③___________ ;④冷却结晶;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②几种化合物的溶解度(S)随温度(T)变化曲线如右图。

(1)卤块中加H2O2的目的是
(2)加入BaCl2的目的是除去SO
 ,如何检验SO
,如何检验SO 已沉淀完全?
已沉淀完全?(3)常温下,加MgO调节pH=4后溶液中c(Fe3+)=
(4)加入NaClO3饱和溶液公有NaCl晶体析出,写出该反应的化学方程式:
①取样,加入NaClO3饱和溶液充分反应;②蒸发结晶;③
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以硫铁矿(主要成分为 ,还有少量
,还有少量 、
、 )为原料,制备硫酸亚铁晶体
)为原料,制备硫酸亚铁晶体 和软磁性材料
和软磁性材料 的工艺流程如下:
的工艺流程如下:
(1)焙烧后得到的固体主要成分为 ,写出焙烧过程主要反应的化学方程式
,写出焙烧过程主要反应的化学方程式__________ ,为提高焙烧的速率,可采取的措施是__________ (写一条即可)。
(2)试剂X是__________ (填化学式)。
(3)焙烧产生的 会污染环境,用足量氨水吸收
会污染环境,用足量氨水吸收 ,写出该反应的离子方程式
,写出该反应的离子方程式__________ 。
(4)从“还原”得到的溶液中获得硫酸亚铁晶体 的操作:
的操作:__________ 、__________ 、过滤、洗涤、干燥。
(5)“沉铁”操作是将提纯后的 溶液与氨水
溶液与氨水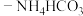 混合溶液反应,生成
混合溶液反应,生成 沉淀。写出该反应的离子方程式
沉淀。写出该反应的离子方程式__________ 。
(6)还可以用燃料细菌脱硫法对硫铁矿进行处理进而制备硫酸亚铁晶体,该法是用氧化亚铁硫杆菌(T-f)对硫铁矿进行催化脱硫,同时得到 溶液。研究发现,如下图用氧化亚铁硫杆菌(T-f)脱硫,温度过高脱硫效率降低,可能的原因是
溶液。研究发现,如下图用氧化亚铁硫杆菌(T-f)脱硫,温度过高脱硫效率降低,可能的原因是__________ 。
 ,还有少量
,还有少量 、
、 )为原料,制备硫酸亚铁晶体
)为原料,制备硫酸亚铁晶体 和软磁性材料
和软磁性材料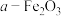 的工艺流程如下:
的工艺流程如下: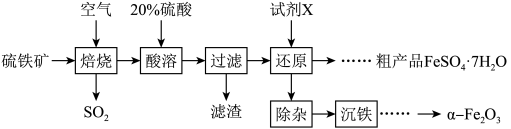
(1)焙烧后得到的固体主要成分为
 ,写出焙烧过程主要反应的化学方程式
,写出焙烧过程主要反应的化学方程式(2)试剂X是
(3)焙烧产生的
 会污染环境,用足量氨水吸收
会污染环境,用足量氨水吸收 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)从“还原”得到的溶液中获得硫酸亚铁晶体
 的操作:
的操作:(5)“沉铁”操作是将提纯后的
 溶液与氨水
溶液与氨水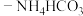 混合溶液反应,生成
混合溶液反应,生成 沉淀。写出该反应的离子方程式
沉淀。写出该反应的离子方程式(6)还可以用燃料细菌脱硫法对硫铁矿进行处理进而制备硫酸亚铁晶体,该法是用氧化亚铁硫杆菌(T-f)对硫铁矿进行催化脱硫,同时得到
 溶液。研究发现,如下图用氧化亚铁硫杆菌(T-f)脱硫,温度过高脱硫效率降低,可能的原因是
溶液。研究发现,如下图用氧化亚铁硫杆菌(T-f)脱硫,温度过高脱硫效率降低,可能的原因是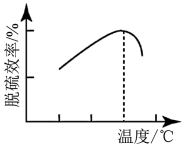
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:


(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。①此方法需要控制的变量有(至少写出两项):___ 。②为了衡量反应的快慢,还可以采用新的测定方法是_____ 。
(2)实验(Ⅱ)已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。D试管中实验现象为
2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________ ,用平衡移动原理解释原因:_______________________
(3)实验(Ⅲ)①实验目的是探究____________________ 。
(4)在室温下进行实验(Ⅳ)①实验目的是_____ 。②溶液褪色的时间:t(A)________ t(B)(填>、<或= )


(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。①此方法需要控制的变量有(至少写出两项):
(2)实验(Ⅱ)已知:Cr2O72-(橙色)+ H2O
 2CrO42-(黄色)+ 2H+。D试管中实验现象为
2CrO42-(黄色)+ 2H+。D试管中实验现象为(3)实验(Ⅲ)①实验目的是探究
(4)在室温下进行实验(Ⅳ)①实验目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】金属钨具有高熔点、低蒸气压、导热性好等特点,是等离子体材料的最佳候选材料。一种以黑钨矿(也叫钨锰铁矿,主要成分是FeWO4和MnWO4)为原料生产金属钨及含钨产品的工业流程如下图所示:

已知:“水浸”后滤液中的阴离子主要是 、
、 、
、 、
、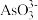 和
和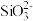 。
。
(1)“焙烧”前需要将黑钨矿进行粉碎,其目的是___________ ;已知“滤渣1”主要是Mn3O4和Fe2O3,写出MnWO4发生反应的化学方程式:___________ 。
(2)写出“氧化”时发生反应的离子方程式:_______ 。
(3)“滤渣2”主要是___________ (填化学式)。
(4)“操作X”是___________ ,产品 1是___________ 。
(5)已知钨酸钙(CaWO4)微溶于水,钨酸难溶于水,请结合平衡移动原理解释利用盐酸进行“酸解”的原因:___________ 。
(6)在实验室利用碘量法测定产品2中WCl6 [(易溶于CS2)的纯度,实验如下:
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为___________ g(不考虑空气中水蒸气的干扰)。
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过 离子交换柱发生反应:
离子交换柱发生反应: +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 ;交换结束后,向所得含
;交换结束后,向所得含 的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为___________ ,(列出计算式,无需化简)

已知:“水浸”后滤液中的阴离子主要是
 、
、 、
、 、
、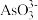 和
和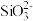 。
。(1)“焙烧”前需要将黑钨矿进行粉碎,其目的是
(2)写出“氧化”时发生反应的离子方程式:
(3)“滤渣2”主要是
(4)“操作X”是
(5)已知钨酸钙(CaWO4)微溶于水,钨酸难溶于水,请结合平衡移动原理解释利用盐酸进行“酸解”的原因:
(6)在实验室利用碘量法测定产品2中WCl6 [(易溶于CS2)的纯度,实验如下:
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过
 离子交换柱发生反应:
离子交换柱发生反应: +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 ;交换结束后,向所得含
;交换结束后,向所得含 的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以 和
和 由为原料合成尿素:
由为原料合成尿素: 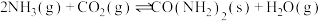
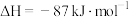 。
。
(1)研究发现,合成尿素反应分两步完成,其能量变化如图所示:
第一步: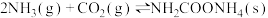

第二步: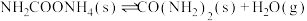

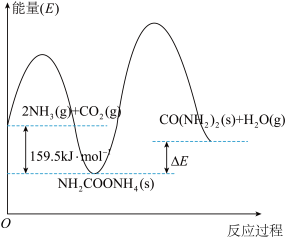
①图中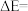
_______  。
。
②反应速率较快的是_______ (填“第一步”或“第二步”)反应,理由是_______ 。
II.用 制备甲醇可实现微循环
制备甲醇可实现微循环
(2)已知反应 的
的 ,
, ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压
分别为正、逆反应速率常数,p为气体分压(分压 总压
总压 物质的量分数)。在540K下,按初始投料比
物质的量分数)。在540K下,按初始投料比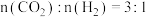 、
、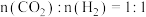 、
、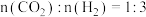 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:

①a、b、c各曲线所表示的投料比由大到小的顺序为_______ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数
_______ 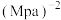 (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻 ,
,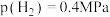 ,
,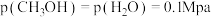 ,此时
,此时
_______ (保留两位小数)。
(3)利用多晶铜高效催化电解 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。
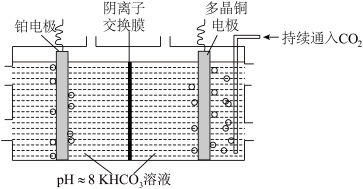
①某温度下,当电解质溶液的 时,此时该溶液中
时,此时该溶液中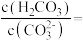
_______ [已知:该温度下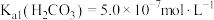 ,
,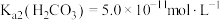 ]。
]。
②多晶铜电极的电极反应式为_______ 。
③理论上当生产0.05mol乙烯时,铂电极产生的气体在标况下体积为_______ (不考虑气体的溶解)。
I.以
 和
和 由为原料合成尿素:
由为原料合成尿素: 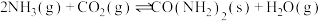
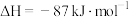 。
。(1)研究发现,合成尿素反应分两步完成,其能量变化如图所示:
第一步:
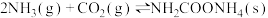

第二步:
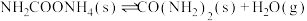


①图中
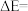
 。
。②反应速率较快的是
II.用
 制备甲醇可实现微循环
制备甲醇可实现微循环(2)已知反应
 的
的 ,
, ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压
分别为正、逆反应速率常数,p为气体分压(分压 总压
总压 物质的量分数)。在540K下,按初始投料比
物质的量分数)。在540K下,按初始投料比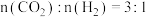 、
、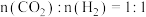 、
、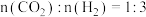 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
①a、b、c各曲线所表示的投料比由大到小的顺序为
②N点在b曲线上,540K时的压强平衡常数

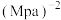 (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。③540K条件下,某容器测得某时刻
 ,
,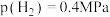 ,
,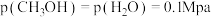 ,此时
,此时
(3)利用多晶铜高效催化电解
 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。
①某温度下,当电解质溶液的
 时,此时该溶液中
时,此时该溶液中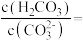
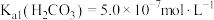 ,
,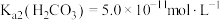 ]。
]。②多晶铜电极的电极反应式为
③理论上当生产0.05mol乙烯时,铂电极产生的气体在标况下体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】2019年诺贝尔化学奖授予锂离子电池的发明者,锂离子电池是目前应用广泛的一类电池。以钛铁矿(主要成分为FeTiO3,含有少量MgO、Fe2O3、SiO2等杂质)为原料,制备锂离子电池电极材料的工艺流程如图所示:
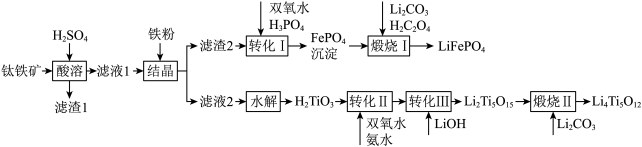
已知:①滤液1中含Ti微粒的主要存在形式为TiO2+;
②)Ksp(FePO4)=1.3×10-22、Ksp[Mg3(PO4)2]=1.0×10-24;溶液中某离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)滤渣1中主要成分的化学式为__ 。
(2)“结晶”温度需控制在70℃左右,若温度过高会导致的后果为__ 。
(3)“转化I”后所得溶液中c(Mg2+)=0.01mol·L-1,若其中Fe3+沉淀完全,则溶液中c(PO43-)的范围为__ 。
(4)“煅烧I”反应中氧化剂和还原剂的物质的量之比为__ 。
(5)“转化II”中H2TiO3的转化率(α)与温度(T)的关系如图所示。T0℃时,一定时间内H2TiO3的转化率最高的原因为__ 。

(6)Li2Ti5O15中-1价与-2价O原子的数目之比为___ 。“煅烧II”反应中同时生成两种参与大气循环的气体,该反应的化学方程式为__ 。
(7)某锂离子电池放电时的电池反应为Li1-xFePO4+LixC6=LiFePO4+6C,则充电时阳极的电极反应式为__ 。

已知:①滤液1中含Ti微粒的主要存在形式为TiO2+;
②)Ksp(FePO4)=1.3×10-22、Ksp[Mg3(PO4)2]=1.0×10-24;溶液中某离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)滤渣1中主要成分的化学式为
(2)“结晶”温度需控制在70℃左右,若温度过高会导致的后果为
(3)“转化I”后所得溶液中c(Mg2+)=0.01mol·L-1,若其中Fe3+沉淀完全,则溶液中c(PO43-)的范围为
(4)“煅烧I”反应中氧化剂和还原剂的物质的量之比为
(5)“转化II”中H2TiO3的转化率(α)与温度(T)的关系如图所示。T0℃时,一定时间内H2TiO3的转化率最高的原因为

(6)Li2Ti5O15中-1价与-2价O原子的数目之比为
(7)某锂离子电池放电时的电池反应为Li1-xFePO4+LixC6=LiFePO4+6C,则充电时阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】硫的化合物丰富多样,应用广泛,请回答以下问题:
(1)单质硫存在多样的分子结构。
Ⅰ.一种硫单质 的摩尔质量与其在空气中燃烧生成的产物的摩尔质量相同,则这种硫单质的电子式为
的摩尔质量与其在空气中燃烧生成的产物的摩尔质量相同,则这种硫单质的电子式为___________ 。(满足8电子稳结构)
Ⅱ.硫单质最稳定的存在形式 是环状结构分子。将
是环状结构分子。将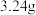 硫溶于
硫溶于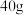 苯中,所得溶液的沸点升高了
苯中,所得溶液的沸点升高了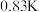 。已知:①对于稀溶液沸点升高的数值,可通过沸点升高公式
。已知:①对于稀溶液沸点升高的数值,可通过沸点升高公式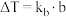 求得。式中
求得。式中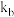 为稀溶液沸点升高常数,苯的沸点升高常数
为稀溶液沸点升高常数,苯的沸点升高常数 ;②在沸点升高公式中,
;②在沸点升高公式中, 为溶质的质量摩尔浓度,计算公式为:
为溶质的质量摩尔浓度,计算公式为: ,单位为:
,单位为: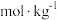 ;③苯中硫的存在形式即为最稳定的形式。
;③苯中硫的存在形式即为最稳定的形式。
请通过以上信息,计算该形式下硫的分子式为:___________ (参考数据: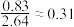 )。
)。
Ⅲ.A在一定条件下可以转化为B,该反应为放热反应,则在该反应条件下相同物质的量的A的能量___________  的能量(填:大于、等于、小于或无法确定)。
的能量(填:大于、等于、小于或无法确定)。
(2)连硫酸是一类 原子直接相连成键的酸。通式为
原子直接相连成键的酸。通式为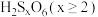 ,对应的命名为连
,对应的命名为连 硫酸。几种常见连硫酸可通过氧化低价硫化合物的方式制得。写出下列反应的化学方程式:用细粉状的
硫酸。几种常见连硫酸可通过氧化低价硫化合物的方式制得。写出下列反应的化学方程式:用细粉状的 氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱:
氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱:___________ ;
(3)汞的毒性人类很早就知道。实验室内通常使用覆盖硫磺的方法使得 转化为无毒的
转化为无毒的 。该反应几乎在瞬间就可以反应完全。相比之下比汞活泼的铁与硫磺发生类似反应则十分困难:只有在加热的条件下才可以发生化合生成
。该反应几乎在瞬间就可以反应完全。相比之下比汞活泼的铁与硫磺发生类似反应则十分困难:只有在加热的条件下才可以发生化合生成 。请合理推测以上反常现象出现的原因:
。请合理推测以上反常现象出现的原因:___________ ;
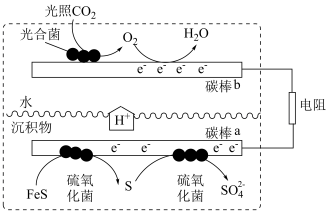
(4)沉积物微生物燃料电池可处理含硫废水,其工作原理示意图如图。___________ 。(反应过程中铁元素的 价不变)
价不变)
(1)单质硫存在多样的分子结构。
Ⅰ.一种硫单质
 的摩尔质量与其在空气中燃烧生成的产物的摩尔质量相同,则这种硫单质的电子式为
的摩尔质量与其在空气中燃烧生成的产物的摩尔质量相同,则这种硫单质的电子式为Ⅱ.硫单质最稳定的存在形式
 是环状结构分子。将
是环状结构分子。将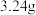 硫溶于
硫溶于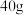 苯中,所得溶液的沸点升高了
苯中,所得溶液的沸点升高了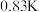 。已知:①对于稀溶液沸点升高的数值,可通过沸点升高公式
。已知:①对于稀溶液沸点升高的数值,可通过沸点升高公式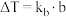 求得。式中
求得。式中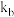 为稀溶液沸点升高常数,苯的沸点升高常数
为稀溶液沸点升高常数,苯的沸点升高常数 ;②在沸点升高公式中,
;②在沸点升高公式中, 为溶质的质量摩尔浓度,计算公式为:
为溶质的质量摩尔浓度,计算公式为: ,单位为:
,单位为: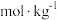 ;③苯中硫的存在形式即为最稳定的形式。
;③苯中硫的存在形式即为最稳定的形式。请通过以上信息,计算该形式下硫的分子式为:
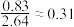 )。
)。Ⅲ.A在一定条件下可以转化为B,该反应为放热反应,则在该反应条件下相同物质的量的A的能量
 的能量(填:大于、等于、小于或无法确定)。
的能量(填:大于、等于、小于或无法确定)。(2)连硫酸是一类
 原子直接相连成键的酸。通式为
原子直接相连成键的酸。通式为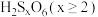 ,对应的命名为连
,对应的命名为连 硫酸。几种常见连硫酸可通过氧化低价硫化合物的方式制得。写出下列反应的化学方程式:用细粉状的
硫酸。几种常见连硫酸可通过氧化低价硫化合物的方式制得。写出下列反应的化学方程式:用细粉状的 氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱:
氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱:(3)汞的毒性人类很早就知道。实验室内通常使用覆盖硫磺的方法使得
 转化为无毒的
转化为无毒的 。该反应几乎在瞬间就可以反应完全。相比之下比汞活泼的铁与硫磺发生类似反应则十分困难:只有在加热的条件下才可以发生化合生成
。该反应几乎在瞬间就可以反应完全。相比之下比汞活泼的铁与硫磺发生类似反应则十分困难:只有在加热的条件下才可以发生化合生成 。请合理推测以上反常现象出现的原因:
。请合理推测以上反常现象出现的原因:(4)沉积物微生物燃料电池可处理含硫废水,其工作原理示意图如图。
 价不变)
价不变)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
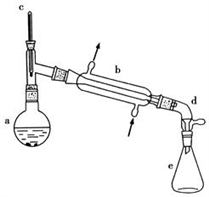

可能用到的有关数据如下:
(1)合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_________ (填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________
(4)在本实验的分离过程中,产物应从分液漏斗的_________________ (填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是________________________
(6)在蒸馏收集产品时, 控制的温度应在____________ 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______________ (填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出


可能用到的有关数据如下:
| 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
(4)在本实验的分离过程中,产物应从分液漏斗的
(5)分离提纯过程中加入无水氯化钙的目的是
(6)在蒸馏收集产品时, 控制的温度应在
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】工业生产过程中产生的含硫化合物( ,
, 等)会造成环境问题,可用多种方法脱除。
等)会造成环境问题,可用多种方法脱除。
Ⅰ.由次氯酸钠碱性废水(含有杂质 )处理硫酸工业尾气的流程如下:
)处理硫酸工业尾气的流程如下:
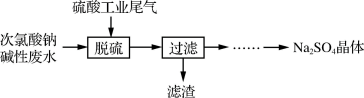
(1)控制合适的条件有利于提高 的吸收率(脱硫率)。
的吸收率(脱硫率)。
①脱硫时需保持溶液呈碱性,此过程的主要反应之一为: ;另一个为氧化还原反应,请写出该反应的离子方程式:
;另一个为氧化还原反应,请写出该反应的离子方程式:___________ 。
②提高脱硫率的可行措施有______ (填序号)。
a.加快通入尾气的速率 b.吸收塔中喷淋的碱液与气体逆向接触 c.提高碱液pH
③温度控制在40-60℃之间,脱硫率较高,原因是___________ 。
(2)滤渣的主要成分为______ (填化学式)。
Ⅱ.一种铁基脱硫剂脱除硫化氢( )的方法包括吸收和再生两个阶段,其工艺流程原理如下:
)的方法包括吸收和再生两个阶段,其工艺流程原理如下:
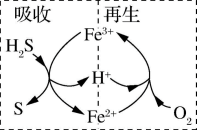
(3)写出“吸收”反应的离子方程式:___________ 。
(4)当吸收224mL(标准状况) 时,若要保持脱硫液中
时,若要保持脱硫液中 的物质的量不变,则所通入的氧气的物质的量为
的物质的量不变,则所通入的氧气的物质的量为______ mol。
 ,
, 等)会造成环境问题,可用多种方法脱除。
等)会造成环境问题,可用多种方法脱除。Ⅰ.由次氯酸钠碱性废水(含有杂质
 )处理硫酸工业尾气的流程如下:
)处理硫酸工业尾气的流程如下:
(1)控制合适的条件有利于提高
 的吸收率(脱硫率)。
的吸收率(脱硫率)。①脱硫时需保持溶液呈碱性,此过程的主要反应之一为:
 ;另一个为氧化还原反应,请写出该反应的离子方程式:
;另一个为氧化还原反应,请写出该反应的离子方程式:②提高脱硫率的可行措施有
a.加快通入尾气的速率 b.吸收塔中喷淋的碱液与气体逆向接触 c.提高碱液pH
③温度控制在40-60℃之间,脱硫率较高,原因是
(2)滤渣的主要成分为
Ⅱ.一种铁基脱硫剂脱除硫化氢(
 )的方法包括吸收和再生两个阶段,其工艺流程原理如下:
)的方法包括吸收和再生两个阶段,其工艺流程原理如下:
(3)写出“吸收”反应的离子方程式:
(4)当吸收224mL(标准状况)
 时,若要保持脱硫液中
时,若要保持脱硫液中 的物质的量不变,则所通入的氧气的物质的量为
的物质的量不变,则所通入的氧气的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硼氢化钠(NaBH4)是一种常见的还原剂,常温下易与水反应,可溶于异丙胺(沸点33℃),广泛应用于制药、造纸、废水处理等。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其实验流程如图∶
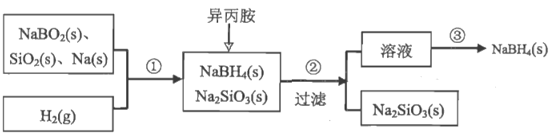
(1)第①步为高温合成,写出该合成的化学方程式∶___ 。
(2)第③步为分离NaBH4并回收溶剂,采用的实验操作是___ 。
(3)实验测定NaBH4的产率原理及步骤如下∶
①测定原理∶3NaBH4+4KIO3=3NaBO2+4KI+6H2O
KIO3 +KI+H2SO4—I2+K2SO4+H2O(未配平)
I2+2Na2S2O3=2NaI+Na2S4O6。
②测定步骤
步骤1∶探究小组以23.76gNaBO2为主要原料制得NaBH4产品,将产品溶于NaOH溶液后配成250mL溶液,用移液管量取2.50mL置于碘量瓶中,加入30.00mL0.1000mol·L-1KIO3溶液振荡60s,使充分反应。
步骤2∶向充分反应的溶液加入过量的KI溶液,用4mol·L-1的H2SO4调节pH至5.0以下,冷却后暗处放置数分钟。
步骤3∶用0.2000mol·L-1Na2S2O3标准溶液滴定至微黄色,加入几滴淀粉指示剂,继续滴定至终点,消耗Na2S2O3标准溶液的体积为24.00mL。
通过计算确定上述实验流程中NaBH4的产率___ 。(写出计算过程)
(4)已知∶NaBH4+2H2O=NaBO2+4H2↑。实验测得25℃时,NaBH4每消耗一半所用的时间与溶液pH的关系如表∶
实验中发现NaBH4与水反应开始释放H2很快,经过一段时间后就缓慢下来,可能原因一是反应物浓度降低;二是___ 。

(1)第①步为高温合成,写出该合成的化学方程式∶
(2)第③步为分离NaBH4并回收溶剂,采用的实验操作是
(3)实验测定NaBH4的产率原理及步骤如下∶
①测定原理∶3NaBH4+4KIO3=3NaBO2+4KI+6H2O
KIO3 +KI+H2SO4—I2+K2SO4+H2O(未配平)
I2+2Na2S2O3=2NaI+Na2S4O6。
②测定步骤
步骤1∶探究小组以23.76gNaBO2为主要原料制得NaBH4产品,将产品溶于NaOH溶液后配成250mL溶液,用移液管量取2.50mL置于碘量瓶中,加入30.00mL0.1000mol·L-1KIO3溶液振荡60s,使充分反应。
步骤2∶向充分反应的溶液加入过量的KI溶液,用4mol·L-1的H2SO4调节pH至5.0以下,冷却后暗处放置数分钟。
步骤3∶用0.2000mol·L-1Na2S2O3标准溶液滴定至微黄色,加入几滴淀粉指示剂,继续滴定至终点,消耗Na2S2O3标准溶液的体积为24.00mL。
通过计算确定上述实验流程中NaBH4的产率
(4)已知∶NaBH4+2H2O=NaBO2+4H2↑。实验测得25℃时,NaBH4每消耗一半所用的时间与溶液pH的关系如表∶
| pH | 8 | 10 | 12 | 14 | |
| 时间/ | min | 6.2×10-1 | 6.2×10 | 6.2×103 | 6.2×105 |
您最近一年使用:0次



