燃煤的烟气中含有SO2,为治理雾霾天气,工厂采用多种方法实现烟气脱硫。
(1)“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是___________(填字母序号)。
(2)某工厂利用烟气处理含Cr2O 的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下:
的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下:

①吸收塔中反应后的铬元素以Cr3+形式存在,则其中发生反应的离子方程式为___________ 。
②中和池中的反应除生成Cr(OH)3沉淀外,还会产生某种气体,该气体的化学式为___________ 。
(3)石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:
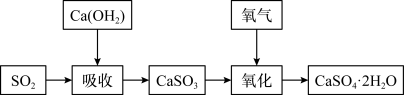
烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:
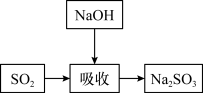
已知:
①石灰-石膏法和烧碱法相比,石灰-石膏法的优缺点是___________ 。
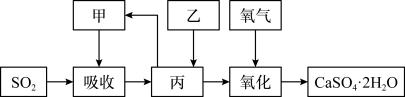
②某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是___________ 、___________ 、___________ (填化学式)
(1)“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是___________(填字母序号)。
| A.石灰乳 | B.Na2SO3溶液 | C.Na2CO3溶液 | D.CaCl2溶液 |
 的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下:
的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下:
①吸收塔中反应后的铬元素以Cr3+形式存在,则其中发生反应的离子方程式为
②中和池中的反应除生成Cr(OH)3沉淀外,还会产生某种气体,该气体的化学式为
(3)石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收 SO2的成本(元/mol) | 0.027 | 0.232 |
①石灰-石膏法和烧碱法相比,石灰-石膏法的优缺点是
②某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是

更新时间:2022-03-31 20:23:37
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】硒( )是动物和人体所必需的微量元素之一,某科学小组以含硒物料(主要含S、
)是动物和人体所必需的微量元素之一,某科学小组以含硒物料(主要含S、 、
、 、
、 、
、 、
、 和铜、银的化合物等)为原料提取硒,设计的流程如图:
和铜、银的化合物等)为原料提取硒,设计的流程如图:

回答下列问题:
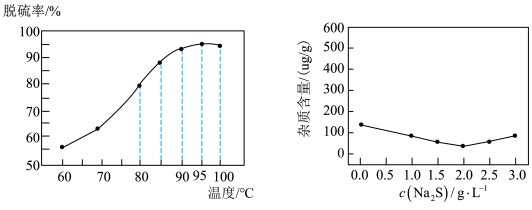
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是___________ 。“脱硫”时最佳温度是___________ 。
(2)“氧化浸取”中 单质被氧化为
单质被氧化为 并收集到
并收集到 气体,该过程的化学反应方程式为
气体,该过程的化学反应方程式为___________ 。“滤渣”可以被磁铁吸引,其主要成分有___________ 。
(3)“除杂”中 浓度对粗硒除杂的影响如图所示,
浓度对粗硒除杂的影响如图所示,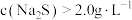 后精硒中杂质含量又上升的原因可能是
后精硒中杂质含量又上升的原因可能是___________ 。
(4)“酸化”中制取精硒的离子方程式为___________ 。
(5)实验室中可以用 还原
还原 溶液制取硒单质,请补充完整实验方案:取一定量
溶液制取硒单质,请补充完整实验方案:取一定量 溶液,在不断搅拌下向
溶液,在不断搅拌下向 溶液中缓缓通入
溶液中缓缓通入 气体,同时用
气体,同时用 溶液吸收多余的尾气,直至
溶液吸收多余的尾气,直至___________ ,干燥,得硒单质。
 )是动物和人体所必需的微量元素之一,某科学小组以含硒物料(主要含S、
)是动物和人体所必需的微量元素之一,某科学小组以含硒物料(主要含S、 、
、 、
、 、
、 、
、 和铜、银的化合物等)为原料提取硒,设计的流程如图:
和铜、银的化合物等)为原料提取硒,设计的流程如图:
回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是

(2)“氧化浸取”中
 单质被氧化为
单质被氧化为 并收集到
并收集到 气体,该过程的化学反应方程式为
气体,该过程的化学反应方程式为(3)“除杂”中
 浓度对粗硒除杂的影响如图所示,
浓度对粗硒除杂的影响如图所示,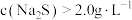 后精硒中杂质含量又上升的原因可能是
后精硒中杂质含量又上升的原因可能是(4)“酸化”中制取精硒的离子方程式为
(5)实验室中可以用
 还原
还原 溶液制取硒单质,请补充完整实验方案:取一定量
溶液制取硒单质,请补充完整实验方案:取一定量 溶液,在不断搅拌下向
溶液,在不断搅拌下向 溶液中缓缓通入
溶液中缓缓通入 气体,同时用
气体,同时用 溶液吸收多余的尾气,直至
溶液吸收多余的尾气,直至
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 molL H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
回答下列问题:
(1)KMnO4溶液用______________ 酸化(填名称);上述反应中氧化剂是_________ (填名称);写出上述反应的离子方程式:____________ 。
(2)上述实验①②是探究___________ 对化学反应速率的影响;上述实验②④是探究_______ 对化学反应速率的影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为___________ ;表格中的“乙“填写t/s,其测量的是________________ 。
(3)小组同学发现前面三组实验的反应速率总是先慢后快,速率变快的主要原因可能是:①该反应放热、②___________ 。
(4)已知实验①50℃时c( )~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出实验②25℃ 时c(
)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出实验②25℃ 时c( )~t的变化曲线示意图。
)~t的变化曲线示意图。_______

限选试剂和仪器:0.20 molL H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
| 物理量 编号 | V(0.20mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol/L 酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
(1)KMnO4溶液用
(2)上述实验①②是探究
(3)小组同学发现前面三组实验的反应速率总是先慢后快,速率变快的主要原因可能是:①该反应放热、②
(4)已知实验①50℃时c(
 )~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出实验②25℃ 时c(
)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出实验②25℃ 时c( )~t的变化曲线示意图。
)~t的变化曲线示意图。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】黄血盐[亚铁氰化钾,K4Fe(CN)6] 目前广泛用作食品添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg/kg。一种制备黄血盐的工艺如下:

回答下列问题:
(1)步骤I反应的化学方程式为______ 。
(2)步骤IV过滤所得的废液中含量较多的溶质为______ (填化学式)。
(3)步骤V是将难溶的K2CaFe(CN)6与X反应脱钙生成K4Fe(CN)6,所用的试剂X是_____ 。(填名称)
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
①25℃时Ka(HCN)=6.25×10-10;计算25℃时0.01mol•L-1的HCN溶液的pH=____ (lg2.5=0.4)。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN;第二步控制pH为7.5〜8.5,用NaClO溶液完全氧化OCN生成N2和两种盐(其中一种为酸式盐)。
第一步控制强碱性的主要目的是_______ ,第二步反应的离子方程式为______ 。

回答下列问题:
(1)步骤I反应的化学方程式为
(2)步骤IV过滤所得的废液中含量较多的溶质为
(3)步骤V是将难溶的K2CaFe(CN)6与X反应脱钙生成K4Fe(CN)6,所用的试剂X是
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
①25℃时Ka(HCN)=6.25×10-10;计算25℃时0.01mol•L-1的HCN溶液的pH=
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN;第二步控制pH为7.5〜8.5,用NaClO溶液完全氧化OCN生成N2和两种盐(其中一种为酸式盐)。
第一步控制强碱性的主要目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
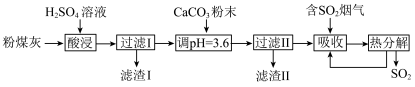
(1)酸浸时反应的化学方程式为_______ 。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为:Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为______ (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是_______ (用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是______ ;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将_______ (填“增大”“减小”或“不变”)。

(1)酸浸时反应的化学方程式为
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为:Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】硫酸是当今世界上最重要的化工产品之一、《新修本草》中关于“青矾( )”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂。栽木不茂”。完成下列填空:
)”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂。栽木不茂”。完成下列填空:
(1)①赤色固体可能是___ (填化学式)。
②为确认“青矾厂气”含有 和
和 ,将其依次通入以下装置。
,将其依次通入以下装置。

A、B中供选择的试剂有a.品红 b. c.
c. d.
d. e.浓硫酸
e.浓硫酸
A中可观察到的白色沉淀现象,A溶液中溶质为___ (填标号,下同),B溶液中溶质为___ ,吸收尾气的溶质为___ 。
(2)工业制硫酸主要采用接触法,以黄铁矿( )为原料制备硫酸的主要设备和流程如图。
)为原料制备硫酸的主要设备和流程如图。

①“沸腾炉”中主要发生的反应为: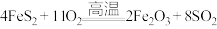 。每反应消耗
。每反应消耗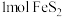 ,转移的电子数为
,转移的电子数为___ 。
②“接触室”中生成 的化学方程式为
的化学方程式为_______ 。
③“吸收塔”中用于吸收 的试剂为
的试剂为_______ (填“水”或“浓硫酸”)。
④环保部门为了测定某硫酸厂周围空气中的 含量进行了如下实验。取标准状况下
含量进行了如下实验。取标准状况下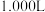 空气(含
空气(含 、
、 、
、 、
、 ),缓慢通过足量碘水。在所得溶液中加入稍过量的
),缓慢通过足量碘水。在所得溶液中加入稍过量的 溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为
溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为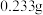 。则空气样品中
。则空气样品中 的体积分数为
的体积分数为_______ 。
 )”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂。栽木不茂”。完成下列填空:
)”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂。栽木不茂”。完成下列填空:(1)①赤色固体可能是
②为确认“青矾厂气”含有
 和
和 ,将其依次通入以下装置。
,将其依次通入以下装置。
A、B中供选择的试剂有a.品红 b.
 c.
c. d.
d. e.浓硫酸
e.浓硫酸A中可观察到的白色沉淀现象,A溶液中溶质为
(2)工业制硫酸主要采用接触法,以黄铁矿(
 )为原料制备硫酸的主要设备和流程如图。
)为原料制备硫酸的主要设备和流程如图。
①“沸腾炉”中主要发生的反应为:
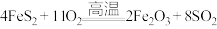 。每反应消耗
。每反应消耗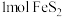 ,转移的电子数为
,转移的电子数为②“接触室”中生成
 的化学方程式为
的化学方程式为③“吸收塔”中用于吸收
 的试剂为
的试剂为④环保部门为了测定某硫酸厂周围空气中的
 含量进行了如下实验。取标准状况下
含量进行了如下实验。取标准状况下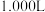 空气(含
空气(含 、
、 、
、 、
、 ),缓慢通过足量碘水。在所得溶液中加入稍过量的
),缓慢通过足量碘水。在所得溶液中加入稍过量的 溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为
溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为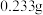 。则空气样品中
。则空气样品中 的体积分数为
的体积分数为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、E、G均为气体,E是一种单质,G能导致硫酸型酸雨的形成;B是最常见的液体;C、F均为两性化合物;A由两种元素组成,其摩尔质量为150g·mol-1。
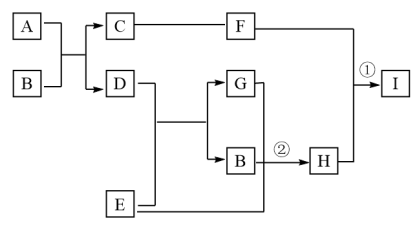
(1)A的化学式为________ 。
(2)酸雨是指pH小于________ 的雨水。
(3)写出C的一种用途________ 。
(4)写出反应①的离子方程式________ 。
(5)写出反应②的化学方程式________ 。

(1)A的化学式为
(2)酸雨是指pH小于
(3)写出C的一种用途
(4)写出反应①的离子方程式
(5)写出反应②的化学方程式
您最近一年使用:0次
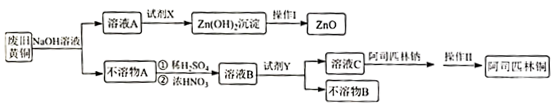
【推荐1】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备阿司匹林铜[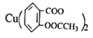 ]及副产物ZnO。制备流程图如下:
]及副产物ZnO。制备流程图如下:
已知:①Zn及化合物的性质与Al及化合物的性质相似。
②阿司匹林铜的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂,受热不稳定,遇强酸解离为阿司匹林(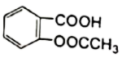 )和Cu2+。
)和Cu2+。
③阿司匹林铜的测定,用Na2S2O3滴定阿司匹林铜与KI生成的I2,涉及反应有:
 ;
; ;
;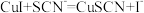 。
。
回答下列问题:
(1)废旧黄铜与NaOH溶液反应的终点现象为___________ 。
(2)下列有关说法正确的是___________。
(3)不溶物A制溶液B在如图装置中进行,浓硝酸分多次加入圆底烧瓶中。铜溶解的化学方程式___________ ,该装置的缺点有___________ 。
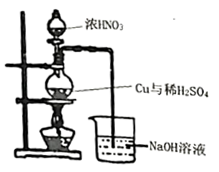
(4)操作Ⅱ,选出获取阿司匹林铜过程中合理的操作并排序___________ 。
①依次用蒸馏水、乙醇各洗涤2-3次②依次用乙醇、蒸馏水各洗涤2~3次
③小火烘干④自然晾干⑤蒸发浓缩、冷却结晶⑥蒸发结晶⑦过滤
(5)阿司匹林钠的制备是用阿司匹林与NaOH溶液反应,为防止阿司匹林水解,通常采用滴定法,请给出指示剂并说明反应完成时的现象___________ 。
(6)碘化亚铜会强力吸附碘单质,实验中如果不加入KSCN试剂会使实验结果___________ 。(填“偏高”、“偏低”或“无影响”)
 ]及副产物ZnO。制备流程图如下:
]及副产物ZnO。制备流程图如下:
已知:①Zn及化合物的性质与Al及化合物的性质相似。
②阿司匹林铜的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂,受热不稳定,遇强酸解离为阿司匹林(
 )和Cu2+。
)和Cu2+。③阿司匹林铜的测定,用Na2S2O3滴定阿司匹林铜与KI生成的I2,涉及反应有:
 ;
; ;
;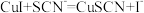 。
。回答下列问题:
(1)废旧黄铜与NaOH溶液反应的终点现象为
(2)下列有关说法正确的是___________。
| A.试剂X为二氧化碳气体、试剂Y为氨水 |
| B.操作Ⅰ包括过滤、洗涤、干燥、煅烧 |
| C.上述流程中涉及4次过滤操作 |
| D.浓HNO3可用O2或H2O2代替 |

(4)操作Ⅱ,选出获取阿司匹林铜过程中合理的操作并排序
①依次用蒸馏水、乙醇各洗涤2-3次②依次用乙醇、蒸馏水各洗涤2~3次
③小火烘干④自然晾干⑤蒸发浓缩、冷却结晶⑥蒸发结晶⑦过滤
(5)阿司匹林钠的制备是用阿司匹林与NaOH溶液反应,为防止阿司匹林水解,通常采用滴定法,请给出指示剂并说明反应完成时的现象
(6)碘化亚铜会强力吸附碘单质,实验中如果不加入KSCN试剂会使实验结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
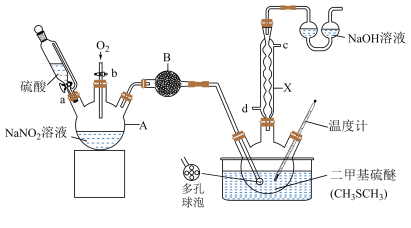
【推荐2】常温下,二甲基亚砜(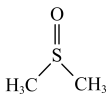 )为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“NO2氧化法”制备二甲基亚砜的装置如图所示(部分夹持装置省略)。
)为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“NO2氧化法”制备二甲基亚砜的装置如图所示(部分夹持装置省略)。
已知:①制备二甲基亚砜的反应原理为: 。
。
②二甲基硫醚(CH3SCH3)和二甲基亚砜的密度分别为0.85g/cm3和1.10g/cm3。
③HNO2遇微热易分解为NO、NO2和水。
实验过程:将A仪器中制得的气体通入20.00mL二甲基硫醚中,控制温度为60~80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到14.80mL二甲基亚砜纯品。回答下列问题:
(1)A的名称为___________ ;仪器x的进水口为___________ (填“d”或“c”)口;B中盛放的试剂的目的是干燥NO2,则B中盛放的试剂可能是___________ (填名称)。
(2)通常采用水浴加热来控制温度为60~80℃,该方法的优点是___________ 。
(3)实验中O2需过量的原因是___________ 。
(4)二甲基亚砜易溶于水的原因可能为___________ 。
(5)NaOH溶液吸收尾气中NO和NO2的化学方程式为___________ 。
(6)本实验的产率是___________ %(保留2位小数)。
 )为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“NO2氧化法”制备二甲基亚砜的装置如图所示(部分夹持装置省略)。
)为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“NO2氧化法”制备二甲基亚砜的装置如图所示(部分夹持装置省略)。
已知:①制备二甲基亚砜的反应原理为:
 。
。②二甲基硫醚(CH3SCH3)和二甲基亚砜的密度分别为0.85g/cm3和1.10g/cm3。
③HNO2遇微热易分解为NO、NO2和水。
实验过程:将A仪器中制得的气体通入20.00mL二甲基硫醚中,控制温度为60~80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到14.80mL二甲基亚砜纯品。回答下列问题:
(1)A的名称为
(2)通常采用水浴加热来控制温度为60~80℃,该方法的优点是
(3)实验中O2需过量的原因是
(4)二甲基亚砜易溶于水的原因可能为
(5)NaOH溶液吸收尾气中NO和NO2的化学方程式为
(6)本实验的产率是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】甲醛在石油化工、医药、轻纺、生物化工以及能源、交通运输等行业均有广泛用途。实验小组设计实验制备甲醛,并进行相关性质的探究。回答下列问题:
Ⅰ.制备甲醛
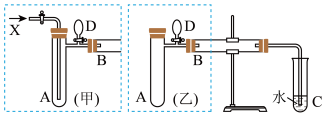
实验室利用甲醇、空气(或氧气)和铜(或利用甲醇和氧化铜)制备甲醛。如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示。
(1)从原子轨道重叠方式分类,甲醛分子中的H-C键是_______ σ键。
(2)若按(甲)装置进行实验,则通入A管的X是_______ (填名称)。若按(乙)装置进行实验,B管中发生反应的化学方程式为_______ 。
Ⅱ.探究甲醛与新制 反应的产物
反应的产物
取 溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
(3)实验小组猜想气体产物Y可能是CO、 、
、 中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。
中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。__________ (按气流方向填写装置标号,有些装置可重复使用)。
②实验证明气体产物Y为 ,没有
,没有 和CO,则实验观察到装置A、C、D、E中的现象为
和CO,则实验观察到装置A、C、D、E中的现象为_______ 。
(4)在探究溶液Z中甲醛的氧化产物时,发现未生成 。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知:
。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知: )。
)。_______ (填标号)。
A.氧化性 B.强酸性 C.还原性 D.脱水性
②c中银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为_______ 。
(5)通过定量测定发现,甲醛与新制 反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制
反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制 、NaOH溶液反应生成Cu和气体Y的化学方程式为
、NaOH溶液反应生成Cu和气体Y的化学方程式为_______ 。
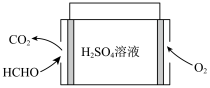
(6)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示。国家标准是室内甲醛不能超过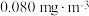 ,传感器在
,传感器在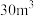 室内空间测定,电路中有
室内空间测定,电路中有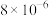 mol电子通过,该室内甲醛含量为
mol电子通过,该室内甲醛含量为_______ 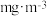 。
。
Ⅰ.制备甲醛
实验室利用甲醇、空气(或氧气)和铜(或利用甲醇和氧化铜)制备甲醛。如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示。
| 物质 | 沸点/℃ | 水溶性 |
| 甲醇 | 65 | 混溶 |
| 甲醛 | -21 | 混溶 |
(1)从原子轨道重叠方式分类,甲醛分子中的H-C键是
(2)若按(甲)装置进行实验,则通入A管的X是
Ⅱ.探究甲醛与新制
 反应的产物
反应的产物取
 溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。(3)实验小组猜想气体产物Y可能是CO、
 、
、 中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。
中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。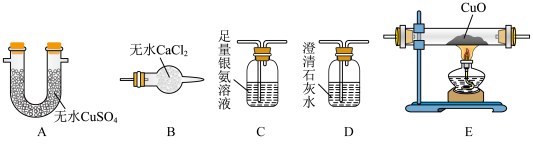
②实验证明气体产物Y为
 ,没有
,没有 和CO,则实验观察到装置A、C、D、E中的现象为
和CO,则实验观察到装置A、C、D、E中的现象为(4)在探究溶液Z中甲醛的氧化产物时,发现未生成
 。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知:
。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知: )。
)。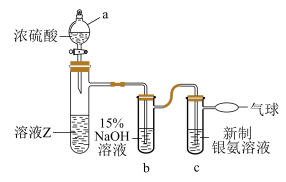
A.氧化性 B.强酸性 C.还原性 D.脱水性
②c中银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
(5)通过定量测定发现,甲醛与新制
 反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制
反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制 、NaOH溶液反应生成Cu和气体Y的化学方程式为
、NaOH溶液反应生成Cu和气体Y的化学方程式为(6)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示。国家标准是室内甲醛不能超过
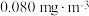 ,传感器在
,传感器在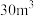 室内空间测定,电路中有
室内空间测定,电路中有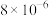 mol电子通过,该室内甲醛含量为
mol电子通过,该室内甲醛含量为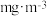 。
。
您最近一年使用:0次



