下列叙述正确的是
A.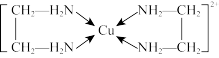 该配合物中配体是 该配合物中配体是 ,配位数是2 ,配位数是2 |
B. 离子的空间构型为V形,中心原子的杂化形式为 离子的空间构型为V形,中心原子的杂化形式为 |
C.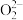 、 、 等与 等与 互为等电子体,则 互为等电子体,则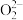 和 和 的结构式分别为 的结构式分别为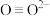 、 、 |
D. 分子的中心原子的价层电子对数为4,该分子的 分子的中心原子的价层电子对数为4,该分子的 模型是正四面体形 模型是正四面体形 |
20-21高二下·陕西西安·期中 查看更多[2]
更新时间:2022-04-24 09:48:43
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】软包电池的关键组件结构如图所示。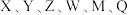 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素, 元素最外层电子数是次外层电子数的一半,
元素最外层电子数是次外层电子数的一半, 和
和 同主族。下列说法错误的是
同主族。下列说法错误的是

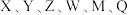 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素, 元素最外层电子数是次外层电子数的一半,
元素最外层电子数是次外层电子数的一半, 和
和 同主族。下列说法错误的是
同主族。下列说法错误的是
A.简单离子半径: |
B.简单氢化物的热稳定性: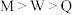 |
C.常温下 单质可以在水溶液中置换出 单质可以在水溶液中置换出 单质 单质 |
D. 为 为 形分子 形分子 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列有关氮族元素单质及其化合物说法正确的是
| A.N2与CO互为等电子体,化学性质相同 |
| B.AsCl3分子的空间构型为平面三角形 |
| C.氮的最高价氧化物晶体中含两种离子,阴离子的主体构型为平面三角形,则阴、阳离子、氮原子的杂化方式分别为sp2、sp |
D.肼(N2H4)的球棍模型透视图为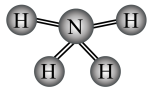 ,则肼分子中只含极性键 ,则肼分子中只含极性键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列化学用语正确的是
A. 的VSEPR模型: 的VSEPR模型: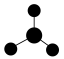 |
B.乙烯的球棍模型为: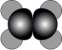 |
C.乙醚的键线式为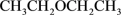 |
D.镁原子最外层电子的电子云轮廊图: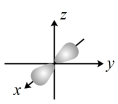 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】电解熔融氟化氢铵(NH4HF2)可制得NF3,NF3是一种优良的等离子蚀刻气体。下列有关说法正确的是
| A.NF3的空间构型为正四面体 |
| B.NH4HF2中N原子的杂化方式为sp2 |
| C.NH4HF2晶体中存在氢键 |
| D.NF3中N-F键的键角大于NH4HF2中N-H键角 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列说法正确的是
| A.有机物CH2=CH—CH3中C原子的杂化类型有sp3和sp2,分子中含有2个π键和7个σ键 |
| B.CO和N2的原子总数、价电子总数均相等,故二者的性质完全相同 |
| C.COCl2分子中所有原子的最外层都不满足8电子稳定结构 |
| D.已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,则[ZnCl4]2-的空间结构为正四面体形 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某补铁剂的主要成分为琥珀酸亚铁,邻二氮菲(phen)可与Fe2+反应生成稳定的螯合物,用于测定Fe2+的含量,反应原理为 。邻二氮菲与琥珀酸亚铁结构简式如图所示,下列说法正确的是
。邻二氮菲与琥珀酸亚铁结构简式如图所示,下列说法正确的是

 。邻二氮菲与琥珀酸亚铁结构简式如图所示,下列说法正确的是
。邻二氮菲与琥珀酸亚铁结构简式如图所示,下列说法正确的是
| A.琥珀酸亚铁中碳原子均为sp3杂化 |
B. 中,Fe2+的配位数为3 中,Fe2+的配位数为3 |
C. 中,存在离子键、配位键和共价键 中,存在离子键、配位键和共价键 |
| D.phen与Fe2+形成配合物的反应受到溶液pH的影响 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】向盛有少量蒸馏水的试管里滴加2滴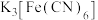 溶液,然后再滴加2滴硫氰化钾溶液。
溶液,然后再滴加2滴硫氰化钾溶液。
下列说法正确的是
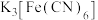 溶液,然后再滴加2滴硫氰化钾溶液。
溶液,然后再滴加2滴硫氰化钾溶液。下列说法正确的是
| A.溶液颜色由黄色变为红色 |
B. 中由 中由 提供孤电子对, 提供孤电子对, 提供空轨道 提供空轨道 |
C. 和 和 与 与 的配位能力: 的配位能力: |
D. 中含 中含 键的物质的量为 键的物质的量为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】短周期非金属元素W、X、Y、Z原子序数依次增大,其中基态Y原子的电子具有4种不同的空间运动状态,X、Z均与Y原子相邻。W、X、Z可形成化合物Q,其结构如图: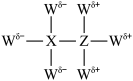 ,下列相关说法错误的是
,下列相关说法错误的是
| A.X、Y、Z元素的第一电离能和电负性均依次增大 |
| B.Q分子中X、Z间存在配位键,且由X提供孤电子对 |
C. 分子的 分子的 模型名称和空间结构名称均为正四面体形 模型名称和空间结构名称均为正四面体形 |
D.Q比 熔点高很多的主要原因是 熔点高很多的主要原因是 和 和 之间存在一种弱电性的相互作用 之间存在一种弱电性的相互作用 |
您最近一年使用:0次


 杂化
杂化 键,有轴对称性,可以旋转
键,有轴对称性,可以旋转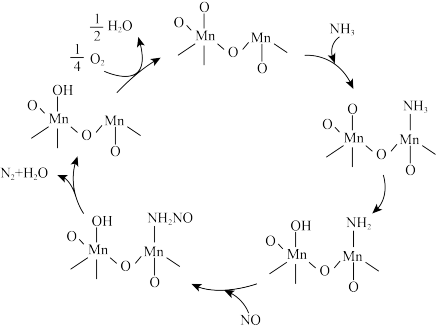
 (即MnO2)是反应的催化剂
(即MnO2)是反应的催化剂 5N2+6H2O
5N2+6H2O

