甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为2CH3OH+O2 2
2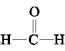 +2H2O
+2H2O
(1)C、H、O 三种元素的电负性由大到小的顺序为_______ 。
(2)H2O的中心原子上的孤电子对数为_______ 。
(3)HCHO分子内σ键与π键个数之比为_______ ,HCHO的空间结构为_______ 。
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为_______ 和_______ 。
(5)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:_______ 。
 2
2 +2H2O
+2H2O(1)C、H、O 三种元素的电负性由大到小的顺序为
(2)H2O的中心原子上的孤电子对数为
(3)HCHO分子内σ键与π键个数之比为
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为
(5)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:
更新时间:2022-04-28 23:57:45
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】常见晶体的结构分析
(1)金刚石晶体

①在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部,由“均摊法”可求出该晶胞中实际含有的碳原子数为_______ ,晶体中碳原子个数与C-C键数之比为_______ 。
②晶体中C-C-C夹角为_______ ,碳原子采取了_______ 杂化。
(2)二氧化硅晶体(如图):
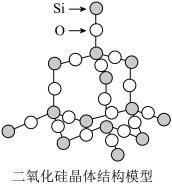
晶体中Si原子与O原子个数比为_______ ,1molSiO2晶体中含Si-O键数目为_______ (用NA表示阿伏加德罗常数)。
(3)Si原子与H原子结合时,Si呈正化合价,则电负性:Si_______ H(选填“<”或“>”)。锗(Ge)与Si是同一主族的元素。Ge元素可能的性质或应用有_______ 。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其气态氢化物的稳定性低于硅的气态氢化物
(4)A、B、C、D为四种晶体,依据下列晶体性质推断属于离子晶体的是_______。
(1)金刚石晶体

①在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部,由“均摊法”可求出该晶胞中实际含有的碳原子数为
②晶体中C-C-C夹角为
(2)二氧化硅晶体(如图):

晶体中Si原子与O原子个数比为
(3)Si原子与H原子结合时,Si呈正化合价,则电负性:Si
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其气态氢化物的稳定性低于硅的气态氢化物
(4)A、B、C、D为四种晶体,依据下列晶体性质推断属于离子晶体的是_______。
| A.固态时能导电,能溶于盐酸 |
| B.固态时不导电,液态时能导电,可溶于水 |
| C.能溶于苯,不溶于水 |
| D.固态、液态时均不导电,熔点为3500℃ |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】物质的结构影响物质的性质。请回答下列问题。
(1)P4S3可用于制造火柴,其分子结构如图所示。电负性:硫___________ 磷(填“>”“<”或“=”),P4S3分子中硫原子的杂化轨道类型为___________ 。1molP4S3分子中孤电子对的数目为___________ ,∠S—P—S___________ 109°28'(填“>”“<”或“=”)。

(2)化合物Cl2O的空间结构为___________ ,中心原子的价层电子对数为___________ 。
(3) 、
、 分子的空间结构和相应的键角如图甲所示。
分子的空间结构和相应的键角如图甲所示。___________ ,原因是___________ 。H2O的键角小于NH3的,分析原因:___________ 。
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为___________ 。(填序号)
(1)P4S3可用于制造火柴,其分子结构如图所示。电负性:硫

(2)化合物Cl2O的空间结构为
(3)
 、
、 分子的空间结构和相应的键角如图甲所示。
分子的空间结构和相应的键角如图甲所示。
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。某离子液体[bmim]Cl可与 混合形成离子液体;[bmim]Cl也可以转化成其他离子液体。如图是[bmim]Cl与
混合形成离子液体;[bmim]Cl也可以转化成其他离子液体。如图是[bmim]Cl与 离子交换反应合成离子液体[bmim]
离子交换反应合成离子液体[bmim]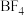 的流程。
的流程。

(1)[bmim]}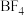 中C原子的杂化方式为
中C原子的杂化方式为___________ , 的空间构型为
的空间构型为___________ 。
(2)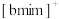 阳离子中的几种元素电负性由大到小顺序为
阳离子中的几种元素电负性由大到小顺序为___________ 。
(3)已知分子中的大π键可以用 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则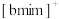 中五元环大π键可以表示为
中五元环大π键可以表示为___________ 。
(4) 熔点为77.8℃,
熔点为77.8℃, 熔点高于1000℃,其原因是
熔点高于1000℃,其原因是___________ 。
(5) 和[bmim]Cl混合形成离子液体的过程中会存在以下转化:
和[bmim]Cl混合形成离子液体的过程中会存在以下转化: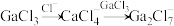 ,已知一个
,已知一个 中含有两个配位键,试画出
中含有两个配位键,试画出 的结构式:
的结构式:___________ 。
(6)氟及其化合物的用途非常广泛。
①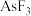 、
、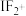 、
、 、
、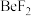 中价层电子对数不同于其他微粒的为
中价层电子对数不同于其他微粒的为___________ 。
②基于 设计的Borm-Haber循环如图所示。
设计的Borm-Haber循环如图所示。
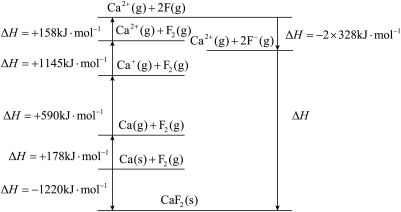
由图可知,F-F键的键能为___________  ;钙的第一电离能为
;钙的第一电离能为___________  。
。
 混合形成离子液体;[bmim]Cl也可以转化成其他离子液体。如图是[bmim]Cl与
混合形成离子液体;[bmim]Cl也可以转化成其他离子液体。如图是[bmim]Cl与 离子交换反应合成离子液体[bmim]
离子交换反应合成离子液体[bmim]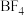 的流程。
的流程。
(1)[bmim]}
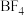 中C原子的杂化方式为
中C原子的杂化方式为 的空间构型为
的空间构型为(2)
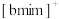 阳离子中的几种元素电负性由大到小顺序为
阳离子中的几种元素电负性由大到小顺序为(3)已知分子中的大π键可以用
 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则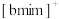 中五元环大π键可以表示为
中五元环大π键可以表示为(4)
 熔点为77.8℃,
熔点为77.8℃, 熔点高于1000℃,其原因是
熔点高于1000℃,其原因是(5)
 和[bmim]Cl混合形成离子液体的过程中会存在以下转化:
和[bmim]Cl混合形成离子液体的过程中会存在以下转化: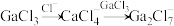 ,已知一个
,已知一个 中含有两个配位键,试画出
中含有两个配位键,试画出 的结构式:
的结构式:(6)氟及其化合物的用途非常广泛。
①
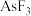 、
、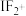 、
、 、
、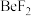 中价层电子对数不同于其他微粒的为
中价层电子对数不同于其他微粒的为②基于
 设计的Borm-Haber循环如图所示。
设计的Borm-Haber循环如图所示。
由图可知,F-F键的键能为
 ;钙的第一电离能为
;钙的第一电离能为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__ 。
(2)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为__ 形,其中共价键的类型有___ 种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为___ 。

| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(2)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)根据价层电子对互斥理论, 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是__________ 。
(2)气态三氧化硫以单分子形式存在,其分子的立体构型为__________ 形,其中共价键的类型有__________ 种;固体三氧化硫中存在如图所示的三聚分子,该分子中 原子的杂化轨道类型为
原子的杂化轨道类型为__________ 。

 |  |  |  |  |  | |
| 熔点/℃ | -85.5 | 115.2 | >600 | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | (分解) | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)根据价层电子对互斥理论,
 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是(2)气态三氧化硫以单分子形式存在,其分子的立体构型为
 原子的杂化轨道类型为
原子的杂化轨道类型为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________ 。
(2)已知2H2O H3O+ +OH-,H3O+的立体构型是
H3O+ +OH-,H3O+的立体构型是____________ ,中心原子的杂化类型是___________ 。
(3)下列关于水的说法正确的是__________ (选填序号)。
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH均为7;
⑥水分子中的氧原子的杂化类型是sp3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定性:___________________ 沸点:___________________
(1)氧原子基态时价层电子的电子排布图为
(2)已知2H2O
 H3O+ +OH-,H3O+的立体构型是
H3O+ +OH-,H3O+的立体构型是(3)下列关于水的说法正确的是
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH均为7;
⑥水分子中的氧原子的杂化类型是sp3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定性:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】比较下列分子或离子中的键角大小(填“>”“<”或“=”):
①H2O___________ CS2,原因是___________ 。
②SO3___________  。③BF3
。③BF3___________ NCl3。
①H2O
②SO3
 。③BF3
。③BF3
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】Na2SiF6 作杀虫剂和木材防腐剂,其制备反应为: 3SiF4 + 2Na2CO3 + 2H2O → 2Na2SiF6↓ + H4SiO4 + 2CO2↑,完成下列填空:
(1)上述所有物质中,某分子的空间构型为直线型,其电子式为_______ ,SiF4 是______ 分子(选填“极性”或“非极性”)。
(2)上述所有元素中,有两种元素位于周期表同一主族,该族元素原子的最外层电子排布通式为____ (用 n 表示电子层数),O、F、Na 三种元素形成的简单离子,半径由大到小顺序是______ 。
(3)H4SiO4 称为原硅酸,推测其是__ 酸(选填“强”或“弱”),从元素周期律角度解释上述推测_____ 。
(1)上述所有物质中,某分子的空间构型为直线型,其电子式为
(2)上述所有元素中,有两种元素位于周期表同一主族,该族元素原子的最外层电子排布通式为
(3)H4SiO4 称为原硅酸,推测其是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】I.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+中未成对的电子数之比为_____ 。
(2)I1(Li)>I1(Na),原因是_____ 。
(3)磷酸根离子的空间构型为____ ,其中P的价层电子对数为____ ,杂化轨道类型为____ 。
II.近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(4)元素As与N同族。预测As的氢化物分子的立体结构为____ ,其沸点比NH3的____ (填“高”或“低”),其判断理由是____ 。
(5)Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为_____ 。
III.以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵。
(6)27gNH 中含电子的物质的量为
中含电子的物质的量为____ mol。
(7)柠檬酸的结构简式为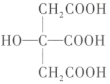 。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为
。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为____ NA。
(1)基态Fe2+与Fe3+中未成对的电子数之比为
(2)I1(Li)>I1(Na),原因是
(3)磷酸根离子的空间构型为
II.近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(4)元素As与N同族。预测As的氢化物分子的立体结构为
(5)Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为
III.以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵。
(6)27gNH
 中含电子的物质的量为
中含电子的物质的量为(7)柠檬酸的结构简式为
 。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为
。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

①“可燃冰”中分子间存在的两种作用力是_____________________________ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_____ 。
(2) H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为____________ 。

| 参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
(2) H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)羟基自由基(·OH电中性,O为-1价)是一种活性基团,能高效处理含酚有机废水,·OH的电子式为_______ ;在除酚过程中它主要起_______ 作用。
(2)通常状况下,乙醇易溶于永而溴乙烷难溶于水中,其主要原因是_______ 。
(2)通常状况下,乙醇易溶于永而溴乙烷难溶于水中,其主要原因是
您最近一年使用:0次

 和
和 结合H+的能力强弱:
结合H+的能力强弱:

