水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________ 。
(2)已知2H2O H3O+ +OH-,H3O+的立体构型是
H3O+ +OH-,H3O+的立体构型是____________ ,中心原子的杂化类型是___________ 。
(3)下列关于水的说法正确的是__________ (选填序号)。
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH均为7;
⑥水分子中的氧原子的杂化类型是sp3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定性:___________________ 沸点:___________________
(1)氧原子基态时价层电子的电子排布图为
(2)已知2H2O
 H3O+ +OH-,H3O+的立体构型是
H3O+ +OH-,H3O+的立体构型是(3)下列关于水的说法正确的是
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH均为7;
⑥水分子中的氧原子的杂化类型是sp3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定性:
10-11高二下·湖北襄阳·期中 查看更多[1]
(已下线)2010-2011学年湖北省襄阳四校高二下学期期中联考化学试卷
更新时间:2011-05-05 08:55:24
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图_____________ ,电子排布式_____________________ 。该元素的原子序数为______ ,该元素是______ 元素(填“金属”或“非金属”),形成的单质为______ 晶体。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________ 、__________ 、________ 。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。_____
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________ 。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________ H2SO3; HClO3________ HClO4; H3PO4________ H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为______ 杂化,VSEPR构型为__________ ,分子的立体构型为__________________ 。
②BF3分子中,中心原子的杂化方式为________ 杂化,分子的立体构型为____________ 。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于_________________ .
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。
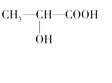
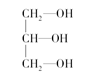
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为
②BF3分子中,中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
您最近一年使用:0次
【推荐2】含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为_______ 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是_______ ,原因是_______ 。
(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________ 。
A.元素的电负性:P<O<F
B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种
C.离子半径:S2->Ca2+>O2->Na+
D.原子的未成对电子数:Cr>Mn>Si>Cl
E.基态铝原子的核外电子有13种运动状态,占据的最高能级的电子云轮廓图的形状为球形。
(2)违反能量最低原理的是___________ (填序号,下同),违反洪特规则的是___________ ,违反泡利原理的是___________ 。
①Ge:1s22s22p63s23p63d104s24p2 ②F-:1s22s23p6③P: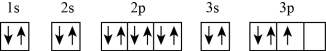
④Fe:1s22s22p63s23p63d64s2 ⑤Mg2+:1s22s22p6⑥C: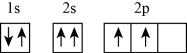
(3)下列硼原子电子排布图表示的状态中,能量最高的为___________(填选项字母)。
(4)①Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。

可知,Li原子的第一电离能为___________ kJ·mol-1,O=O键键能为___________ kJ·mol-1,Li2O晶格能为___________ kJ·mol-1。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,分解温度较低的是___________ ,原因是___________ 。
(1)下列有关说法错误的是
A.元素的电负性:P<O<F
B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种
C.离子半径:S2->Ca2+>O2->Na+
D.原子的未成对电子数:Cr>Mn>Si>Cl
E.基态铝原子的核外电子有13种运动状态,占据的最高能级的电子云轮廓图的形状为球形。
(2)违反能量最低原理的是
①Ge:1s22s22p63s23p63d104s24p2 ②F-:1s22s23p6③P:

④Fe:1s22s22p63s23p63d64s2 ⑤Mg2+:1s22s22p6⑥C:

(3)下列硼原子电子排布图表示的状态中,能量最高的为___________(填选项字母)。
A.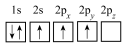 | B.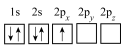 | C.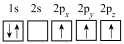 | D.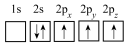 |

可知,Li原子的第一电离能为
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,分解温度较低的是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】(1) X射线衍射测定等发现, 中存在
中存在 。
。 的空间结构为
的空间结构为_______ ,中心原子的杂化形式为_______ 。
(2)我国科学家最近成功合成了世界上首个五氮阴离子盐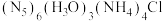 (用R代表),经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
(用R代表),经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
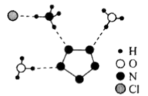
回答下列问题:
①从结构角度分析,R中两种阳离子的相同之处为_______ ,不同之处为_______ 。
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.空间结构
D.共价键类型
②R中阴离子 中的
中的 键总数为
键总数为_______ 。分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为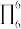 ),则
),则 中的大
中的大 键应表示为
键应表示为_______ 。
 中存在
中存在 。
。 的空间结构为
的空间结构为(2)我国科学家最近成功合成了世界上首个五氮阴离子盐
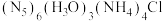 (用R代表),经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
(用R代表),经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
回答下列问题:
①从结构角度分析,R中两种阳离子的相同之处为
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.空间结构
D.共价键类型
②R中阴离子
 中的
中的 键总数为
键总数为 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为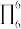 ),则
),则 中的大
中的大 键应表示为
键应表示为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试依据信息回答下列问题:
(1)上表所示元素中能形成氢化物且氢化物分子间存在氢键最强的是(填氢化物的分子式)____ 。
(2)Fe元素位于周期表的___ 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____ 价;与CO分子互为等电子体的分子和离子分别为____ 和___ (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有________ 。CH3OH的熔、沸点比CH4的熔、沸点高,其主要原因是________________ 。
(4)根据VSEPR理论预测NG4- 离子的空间构型为__________ 型。E、F、G、N原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为:__________ (任意一种)。
| A | |||||||||||||||||
| B | C | D | E | F | G | H | I | ||||||||||
| J | K | M | N | ||||||||||||||
| Fe | |||||||||||||||||
试依据信息回答下列问题:
(1)上表所示元素中能形成氢化物且氢化物分子间存在氢键最强的是(填氢化物的分子式)
(2)Fe元素位于周期表的
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有
(4)根据VSEPR理论预测NG4- 离子的空间构型为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)根据对角线规则,Li的化学性质最相似的邻族元素是________ ,该元素基态原子核外M层电子的自旋状态_________ (填“相同”或“相反”)。
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为_________
(3)Co基态原子核外电子排布式为_____________
(4)磷酸根离子的空间构型为_______ ,其中P的价层电子对数为_______ 、杂化轨道类型为_______ 。
(1)根据对角线规则,Li的化学性质最相似的邻族元素是
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为
(3)Co基态原子核外电子排布式为
(4)磷酸根离子的空间构型为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被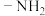 (氨基取代形成的另一种氮的氢化物。
(氨基取代形成的另一种氮的氢化物。
① 分子中中心原子的价层电子对数为
分子中中心原子的价层电子对数为___________ ; 分子中氮原子轨道的杂化类型是
分子中氮原子轨道的杂化类型是___________ 。
②肼可用作火箭燃料,燃烧时发生的反应是

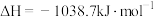
若该反应中有4mol 键断裂,则形成的
键断裂,则形成的 键有
键有___________ mol。
(2)第VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①基态Se原子的价电子轨道表示式为___________ 。
②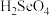 的酸性比
的酸性比
___________ (填“强”或“弱”)。气态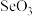 为
为___________ 分子(填“极性”或“非极性”), 的空间结构为
的空间结构为___________ 。
(1)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被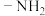 (氨基取代形成的另一种氮的氢化物。
(氨基取代形成的另一种氮的氢化物。①
 分子中中心原子的价层电子对数为
分子中中心原子的价层电子对数为 分子中氮原子轨道的杂化类型是
分子中氮原子轨道的杂化类型是②肼可用作火箭燃料,燃烧时发生的反应是

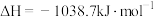
若该反应中有4mol
 键断裂,则形成的
键断裂,则形成的 键有
键有(2)第VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①基态Se原子的价电子轨道表示式为
②
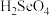 的酸性比
的酸性比
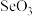 为
为 的空间结构为
的空间结构为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氮化硼(BN)是-种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
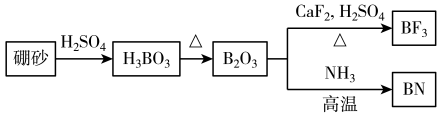
请回答下列问题:
(1) 在BF3分子中,F-B-F的键角是_____ ,B原子的杂化轨道类型为_____ ,BF3和过量NaF作用可生成NaBF4, 的立体结构为
的立体结构为______ 。
(2)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_____ (填“极性键”或“非极性键”),层间作用力为_____ 。

请回答下列问题:
(1) 在BF3分子中,F-B-F的键角是
 的立体结构为
的立体结构为(2)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)磷酸根离子的空间结构为_______________ ,其中P的价层电子对数为_______________ ,杂化轨道类型为_______________ 。
(2) 的晶胞结构示意图如(a)所示。其中O围绕
的晶胞结构示意图如(a)所示。其中O围绕 和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有_______________ 个。
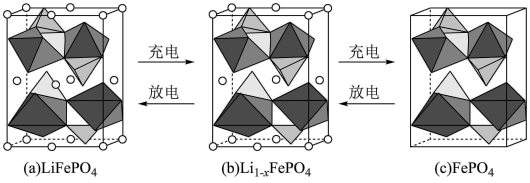
电池充电时, 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则
,结构示意图如(b)所示,则
_______________ ,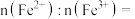
_______________ 。
(1)磷酸根离子的空间结构为
(2)
 的晶胞结构示意图如(a)所示。其中O围绕
的晶胞结构示意图如(a)所示。其中O围绕 和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有
电池充电时,
 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则
,结构示意图如(b)所示,则
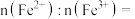
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】相似相溶规律:非极性溶质一般能溶于_______ 溶剂,极性溶质一般能溶于______ 溶剂。如蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请用C、H、O、N、S 五种元素回答下列问题
(1)除H 外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为______________ ,电负性最大的元素基态原子核外电子运动状态共有_________ 种。
(2)五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18 个电子。甲和乙的主要物理性质比较如下:
①1mol 乙分子含有_________ 个σ键;
②丁分子的中心原子采取_________ 杂化方式;甲分子的VSEPR模型为_________ ,丙分子为_________ (“极性”或“非极性”) 分子。
(1)除H 外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为
(2)五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18 个电子。甲和乙的主要物理性质比较如下:
| 熔点/K | 沸点/ K | 标准状况时在水中的溶解度 | |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272 | 423 | 以任意比互溶 |
①1mol 乙分子含有
②丁分子的中心原子采取
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】硒是动物和人体所必需的微量元素之一,在周期表中信息如图所示。完成下列填空:

(1)Se元素在周期表中的位置为___ 。表中78.96的意义为__ 。Se原子最外层电子排布的轨道表示式为___ 。
(2)从原子结构角度解释硫的非金属性大于硒___ 。
(3)硒化氢(H2Se)是一种有恶臭味的有毒气体,是一种___ (选填“极性、或非极性”)分子,其空间结构为___ 型。
(4)工业上常用浓H2SO4焙烧CuSe的方法提取硒,反应产生SO2、SeO2的混合气体,写出反应的化学方程式___ 。理论上该反应每转移1mol电子,可得到SeO2的质量为___ g,得到SO2在标准状况下的体积为___ L。

(1)Se元素在周期表中的位置为
(2)从原子结构角度解释硫的非金属性大于硒
(3)硒化氢(H2Se)是一种有恶臭味的有毒气体,是一种
(4)工业上常用浓H2SO4焙烧CuSe的方法提取硒,反应产生SO2、SeO2的混合气体,写出反应的化学方程式
您最近一年使用:0次



