甲醇是重要的化工基础原料和清洁液体燃料,在CO2加氢合成CH3OH的体系中,同时发生下列竞争反应:
(ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.3 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.3 kJ/mol
(ⅱ)CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1 kJ/mol
CO(g)+H2O(g) △H2=+41.1 kJ/mol
由CO也能直接加氢合成甲醇:(iii) 2H2(g)+CO(g) CH3OH(g) △H
CH3OH(g) △H
(1)△H =_______ kJ/mol。
(2)反应(ⅱ) CO2(g)+H2(g) CO(g)+H2O(g)的正、逆反应平衡常数随温度变化曲线如图所示。
CO(g)+H2O(g)的正、逆反应平衡常数随温度变化曲线如图所示。
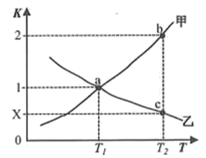
下列分析正确的是_______ 。
A.曲线甲为K(逆),曲线乙为K(正)
B.a点时,一定有v正=v逆
C.c点时,x=0.5
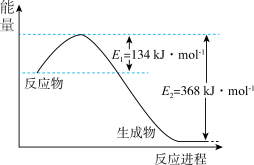
(3)催化剂M、N对CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应进程的能量影响如下图(a)所示,两种催化剂对应的1nk~
CH3OH(g)+H2O(g)反应进程的能量影响如下图(a)所示,两种催化剂对应的1nk~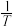 关系如下图(b)所示(已知;lnk=-
关系如下图(b)所示(已知;lnk=-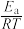 +C,其中Ea为活化能,k为速率常数,R和C为常数)。
+C,其中Ea为活化能,k为速率常数,R和C为常数)。
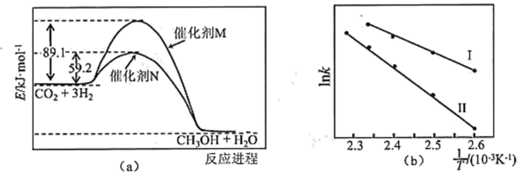
①使用催化剂M时,逆反应的活化能为_______ kJ/mol。
②催化剂N对应曲线是图(b)中的_______ (填“Ⅰ”或“Ⅱ”)
(4)为进一步研究CO2与H2反应制CH3OH的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内,测得甲醇生成速率与温度的关系如图所示。
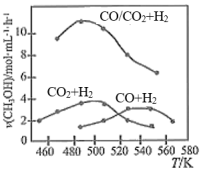
①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是_______ 。
②结合研究目的,参照图中三条曲线,你可得出的结论是_______ (写一条)。
(5)恒温下,在压强恒定为P的装置中,按n(CO2):n(H2)=1:3加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若CO2转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g)的平衡常数计算式:Kp=
CH3OH(g)+H2O(g)的平衡常数计算式:Kp=_______ (不必化简)。(已知: 的选择性x=
的选择性x=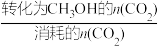 ×100%;Kp为用分压代替浓度的平衡常数。)
×100%;Kp为用分压代替浓度的平衡常数。)
(ⅰ)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.3 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.3 kJ/mol(ⅱ)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1 kJ/mol
CO(g)+H2O(g) △H2=+41.1 kJ/mol由CO也能直接加氢合成甲醇:(iii) 2H2(g)+CO(g)
 CH3OH(g) △H
CH3OH(g) △H(1)△H =
(2)反应(ⅱ) CO2(g)+H2(g)
 CO(g)+H2O(g)的正、逆反应平衡常数随温度变化曲线如图所示。
CO(g)+H2O(g)的正、逆反应平衡常数随温度变化曲线如图所示。
下列分析正确的是
A.曲线甲为K(逆),曲线乙为K(正)
B.a点时,一定有v正=v逆
C.c点时,x=0.5
(3)催化剂M、N对CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)反应进程的能量影响如下图(a)所示,两种催化剂对应的1nk~
CH3OH(g)+H2O(g)反应进程的能量影响如下图(a)所示,两种催化剂对应的1nk~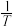 关系如下图(b)所示(已知;lnk=-
关系如下图(b)所示(已知;lnk=-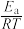 +C,其中Ea为活化能,k为速率常数,R和C为常数)。
+C,其中Ea为活化能,k为速率常数,R和C为常数)。
①使用催化剂M时,逆反应的活化能为
②催化剂N对应曲线是图(b)中的
(4)为进一步研究CO2与H2反应制CH3OH的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内,测得甲醇生成速率与温度的关系如图所示。

①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是
②结合研究目的,参照图中三条曲线,你可得出的结论是
(5)恒温下,在压强恒定为P的装置中,按n(CO2):n(H2)=1:3加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若CO2转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的平衡常数计算式:Kp=
CH3OH(g)+H2O(g)的平衡常数计算式:Kp= 的选择性x=
的选择性x=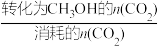 ×100%;Kp为用分压代替浓度的平衡常数。)
×100%;Kp为用分压代替浓度的平衡常数。)
更新时间:2022-05-05 18:53:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】硫化氢俗称“臭蛋气”,是一种无色具有臭鸡蛋气味的剧毒气体,由含硫物质分解而来,属于常见的酸性有害气体中的一种。研究硫化氢的利用及污染的防治很有意义。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:___ 。
(2)H2S在一定条件下发生如下形式的分解:2H2S(g) S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。

①温度升高时,混合气体的平均摩尔质量减小的原因是___ 。
②P点时容器内气体压强与起始时气体压强之比为___ 。
③1050℃时,此反应的平衡常数___ (填序号)。
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:

①电极a上发生反应的电极反应式为___ 。
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为___ L(标准状况下)。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:
(2)H2S在一定条件下发生如下形式的分解:2H2S(g)
 S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
①温度升高时,混合气体的平均摩尔质量减小的原因是
②P点时容器内气体压强与起始时气体压强之比为
③1050℃时,此反应的平衡常数
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:

①电极a上发生反应的电极反应式为
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】运用化学反应原理分析解答以下问题
(1)已知:①

②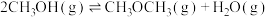
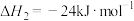
③
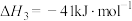
且三个反应的平衡常数依次为 、
、 、
、
则反应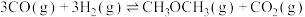

_____ 。化学平衡常数
_____ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)一定条件下,若将体积比为1∶2的CO和 气体通入体积一定的密闭容器中发生反应
气体通入体积一定的密闭容器中发生反应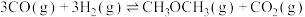 ,下列能说明反应达到平衡状态是
,下列能说明反应达到平衡状态是_____ 。
a.体系压强保持不变
b.混合气体密度保持不变
c.CO和 的物质的量保持不变
的物质的量保持不变
d.CO的消耗速度等于 的生成速率
的生成速率
(3)实验室配制的 溶液,常常出现浑浊,可采取在配制时加入少量
溶液,常常出现浑浊,可采取在配制时加入少量_____ 防止浑浊。
(4)已知某温度时,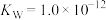 ,
, 溶液的水解常数
溶液的水解常数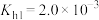 ,则当溶液中
,则当溶液中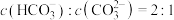 时,试求该溶液的pH=
时,试求该溶液的pH=_____ 。
(5)氨气溶于水得到氨水。在25℃下,将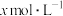 的氨水与
的氨水与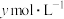 的盐酸等体积混合,反应后溶液显中性,则
的盐酸等体积混合,反应后溶液显中性,则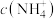
_____ 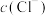 (填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数_____ 。
(1)已知:①


②
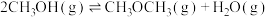
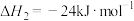
③

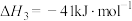
且三个反应的平衡常数依次为
 、
、 、
、
则反应
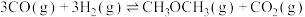


 、
、 、
、 的代数式表示)。
的代数式表示)。(2)一定条件下,若将体积比为1∶2的CO和
 气体通入体积一定的密闭容器中发生反应
气体通入体积一定的密闭容器中发生反应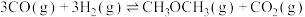 ,下列能说明反应达到平衡状态是
,下列能说明反应达到平衡状态是a.体系压强保持不变
b.混合气体密度保持不变
c.CO和
 的物质的量保持不变
的物质的量保持不变d.CO的消耗速度等于
 的生成速率
的生成速率(3)实验室配制的
 溶液,常常出现浑浊,可采取在配制时加入少量
溶液,常常出现浑浊,可采取在配制时加入少量(4)已知某温度时,
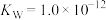 ,
, 溶液的水解常数
溶液的水解常数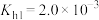 ,则当溶液中
,则当溶液中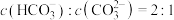 时,试求该溶液的pH=
时,试求该溶液的pH=(5)氨气溶于水得到氨水。在25℃下,将
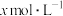 的氨水与
的氨水与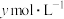 的盐酸等体积混合,反应后溶液显中性,则
的盐酸等体积混合,反应后溶液显中性,则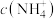
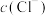 (填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
您最近一年使用:0次
【推荐3】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2⇌H2O(g)+CO(g) △H2=+41kJ·mol-1
⑴ 写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式:__________________ 。
⑵ 反应A可自发进行的温度条件是________ (填“低温”或“高温”) 。
⑶ 写出两个有利于提高反应A中甲醇平衡产率的条件___________ 。
⑷ 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。______ 。
A. 温度 B. 压强 C. 催化剂
② 如图中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为________________ (用分数表示)。
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。__________________________________ 。
⑹ 除去NH4+的离子反应方程式为________________________________________ 。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1反应B:CO2(g)+H2⇌H2O(g)+CO(g) △H2=+41kJ·mol-1
⑴ 写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式:
⑵ 反应A可自发进行的温度条件是
⑶ 写出两个有利于提高反应A中甲醇平衡产率的条件
⑷ 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

A. 温度 B. 压强 C. 催化剂
② 如图中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

⑹ 除去NH4+的离子反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】
【实验内容及记录】
请回答:
(1)实验目的是_______ 。
(2)利用实验1中数据计算,若用 的浓度变化表示的反应速率为:
的浓度变化表示的反应速率为: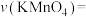
_______ 。
(3)该小组同学根据经验绘制了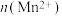 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中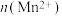 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
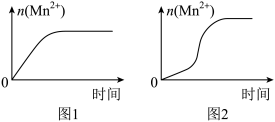
①该小组同学提出的假设是_______ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_______ 。
【实验原理】

【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L 溶液 溶液 |  | 3 mol/L稀硫酸 | 0.05 mol/L 溶液 溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
(1)实验目的是
(2)利用实验1中数据计算,若用
 的浓度变化表示的反应速率为:
的浓度变化表示的反应速率为: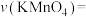
(3)该小组同学根据经验绘制了
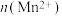 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中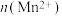 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L 溶液 溶液 |  | 3 mol/L稀硫酸 | 0.05 mol/L 溶液 溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:

该方法中主要反应的热化学方程式为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。

回答下列问题:
(1)SNCR技术脱硝的最佳温度选择925℃的理由是_______________________ 。
(2)SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________ ;
但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是___________ 。

该方法中主要反应的热化学方程式为:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
回答下列问题:
(1)SNCR技术脱硝的最佳温度选择925℃的理由是
(2)SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是
但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是
您最近一年使用:0次
【推荐3】为实现碳达峰、碳中和的目标,我国科研人员做了很多尝试。
I.提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如图。
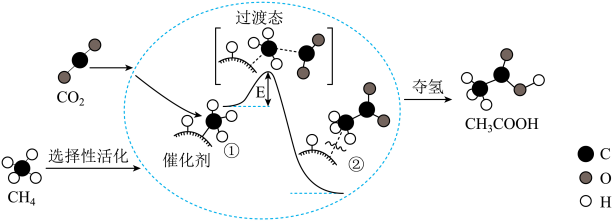
(1)下列说法正确的是_____ 。
A.CH4→CH3COOH过程中,有C-H键发生断裂
B.该催化剂可有效提高反应物的平衡转化率
C.生成CH3COOH总反应的原子利用率为100%
II.CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
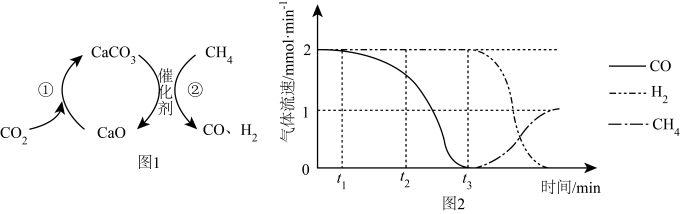
(2)写出反应②的化学方程式:_____ 。
(3)t1~t3n(H2)比n(CO)多,且生成H2速率不变,可能有副反应发生,写出该反应方程式:_____ 。
III.某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:
(4)选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。反应结束后,关闭弹簧夹,可观察到的现象是_____ 。下列装置中能与该装置起相同效果的装置有____ (填数字序号,下同)。
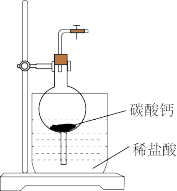
(5)实验室制备下列气体时,能用上述所选装置制备的有:_____ 。
①Cl2②SO2③H2④H2S ⑤NO2⑥C2H2⑦NH3
(6)金属钠与二氧化碳反应的实验步骤及现象如表:
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红;向第二支试管中滴加澄清石灰水,溶液变浑浊。
据此推断,白色物质的主要成分是____ (填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓H2SO4反应,生成的气体具有刺激性气味。本实验中金属钠与二氧化碳反应的化学方程式为_____ 。
I.提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如图。

(1)下列说法正确的是
A.CH4→CH3COOH过程中,有C-H键发生断裂
B.该催化剂可有效提高反应物的平衡转化率
C.生成CH3COOH总反应的原子利用率为100%
II.CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。

(2)写出反应②的化学方程式:
(3)t1~t3n(H2)比n(CO)多,且生成H2速率不变,可能有副反应发生,写出该反应方程式:
III.某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:
(4)选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。反应结束后,关闭弹簧夹,可观察到的现象是


(5)实验室制备下列气体时,能用上述所选装置制备的有:
①Cl2②SO2③H2④H2S ⑤NO2⑥C2H2⑦NH3
(6)金属钠与二氧化碳反应的实验步骤及现象如表:
| 步骤 | 现象 |
| 将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 | 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 |
| 在集气瓶中加入适量蒸馏水,振荡、过滤 | 滤纸上留下黑色固体,滤液为无色溶液 |
据此推断,白色物质的主要成分是
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓H2SO4反应,生成的气体具有刺激性气味。本实验中金属钠与二氧化碳反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
(1)如图是1mol 气体和1mol CO反应生成
气体和1mol CO反应生成 和NO过程中能量变化示意图。则反应过程中放出的总热量应为
和NO过程中能量变化示意图。则反应过程中放出的总热量应为______ 。
(2)在固定体积的密闭容器中,进行如下化学反应:
 ;
; ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:
①写出该反应的平衡常数表达式K=______ 。
②试判断K1______ K2 (填写“ ”“
”“ ”或“
”或“ ”
” 。
。
③下列各项能说明该反应已达到平衡状态的是______  填字母
填字母 .
.
 容器内
容器内 、
、 、
、 的浓度之比为1:3:2
的浓度之比为1:3:2 
 容器内压强保持不变
容器内压强保持不变 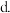 混合气体的密度保持不变
混合气体的密度保持不变
(3)化合物N2H4做火箭发动机的燃料时,与氧化剂 反应生成
反应生成 和水蒸气。某同学设计了一个N2H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与
和水蒸气。某同学设计了一个N2H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与 混合溶液,其装置如图所示:
混合溶液,其装置如图所示:
①该燃料电池的负极反应式为______ ;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示 气体体积已换算成标准状况下的体积
气体体积已换算成标准状况下的体积 ,写出在
,写出在 时间段铁电极上的电极反应式
时间段铁电极上的电极反应式______ ;原混合溶液中NaCl的物质的量浓度为______ 。
③在 时所得溶液的pH为
时所得溶液的pH为______ (假设溶液体积不变
(1)如图是1mol
 气体和1mol CO反应生成
气体和1mol CO反应生成 和NO过程中能量变化示意图。则反应过程中放出的总热量应为
和NO过程中能量变化示意图。则反应过程中放出的总热量应为
(2)在固定体积的密闭容器中,进行如下化学反应:
 ;
; ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表: | 298 | 398 | 498 |
| 平衡常数K | 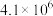 |  |  |
②试判断K1
 ”“
”“ ”或“
”或“ ”
” 。
。③下列各项能说明该反应已达到平衡状态的是
 填字母
填字母 .
. 容器内
容器内 、
、 、
、 的浓度之比为1:3:2
的浓度之比为1:3:2 
 容器内压强保持不变
容器内压强保持不变  混合气体的密度保持不变
混合气体的密度保持不变(3)化合物N2H4做火箭发动机的燃料时,与氧化剂
 反应生成
反应生成 和水蒸气。某同学设计了一个N2H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与
和水蒸气。某同学设计了一个N2H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与 混合溶液,其装置如图所示:
混合溶液,其装置如图所示:
①该燃料电池的负极反应式为
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示
 气体体积已换算成标准状况下的体积
气体体积已换算成标准状况下的体积 ,写出在
,写出在 时间段铁电极上的电极反应式
时间段铁电极上的电极反应式③在
 时所得溶液的pH为
时所得溶液的pH为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】工业上通过将 与氢气反应,实现碳中和。
与氢气反应,实现碳中和。
(1)已知反应 。根据理论计算,在恒压、起始物质的量之比
。根据理论计算,在恒压、起始物质的量之比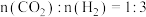 条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
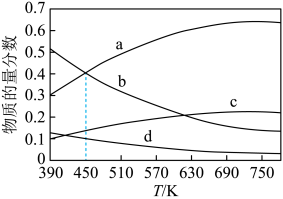
①该反应的平衡常数表达式为___________ ,该反应的
___________ 0(填“>”或“<”)。
②图中曲线b、c分别表示的是平衡时___________ 和___________ 的物质的量分数变化。
(2)用 和
和 合成
合成 的反应为
的反应为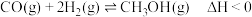 ,按照相同的物质的量投料,测得
,按照相同的物质的量投料,测得 在不同温度下的平衡转化率与压强的关系如图所示。
在不同温度下的平衡转化率与压强的关系如图所示。

①图中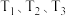 的大小关系为
的大小关系为___________ 。
②图中b、c、d点上正反应速率的关系为___________ 。
②图中a、b、d点上平衡常数的大小关系为___________ 。
(3)合成二甲醚:
反应Ⅰ:
反应Ⅱ: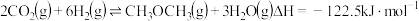
在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。其中:
的选择性随温度的变化如图所示。其中: 的选择性
的选择性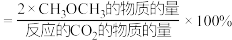 。
。

①温度高于 ,
, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是___________ 。
② 时,起始投入
时,起始投入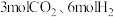 ,在催化剂作用下
,在催化剂作用下 与H2反应一段时间后,测得
与H2反应一段时间后,测得 平衡转化率为40%,
平衡转化率为40%, 的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗
的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗 的物质的量为
的物质的量为___________  。不改变反应时间和温度,一定能提高
。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有___________ 。
③合成二甲醚时较适宜的温度为 ,其原因是
,其原因是___________ 。
 与氢气反应,实现碳中和。
与氢气反应,实现碳中和。(1)已知反应
 。根据理论计算,在恒压、起始物质的量之比
。根据理论计算,在恒压、起始物质的量之比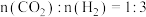 条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
①该反应的平衡常数表达式为

②图中曲线b、c分别表示的是平衡时
(2)用
 和
和 合成
合成 的反应为
的反应为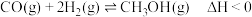 ,按照相同的物质的量投料,测得
,按照相同的物质的量投料,测得 在不同温度下的平衡转化率与压强的关系如图所示。
在不同温度下的平衡转化率与压强的关系如图所示。
①图中
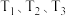 的大小关系为
的大小关系为②图中b、c、d点上正反应速率的关系为
②图中a、b、d点上平衡常数的大小关系为
(3)合成二甲醚:
反应Ⅰ:

反应Ⅱ:
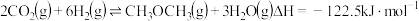
在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。其中:
的选择性随温度的变化如图所示。其中: 的选择性
的选择性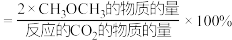 。
。
①温度高于
 ,
, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是②
 时,起始投入
时,起始投入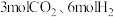 ,在催化剂作用下
,在催化剂作用下 与H2反应一段时间后,测得
与H2反应一段时间后,测得 平衡转化率为40%,
平衡转化率为40%, 的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗
的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗 的物质的量为
的物质的量为 。不改变反应时间和温度,一定能提高
。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有③合成二甲醚时较适宜的温度为
 ,其原因是
,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
I.NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
(1)写出NO2和SO2反应的热化学方程式为_________ .
(2)随温度升高,该反应化学平衡常数变化趋势是_____ .
II.(1)目前,应用NH3的催化还原法来进行烟气氮氧化物脱除,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0,该反应中,反应物总能量_____ (填“>”、“<”或“=”)生成物总能量。
(2)已知4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。

①与容器a中的反应相比,容器b中的反应改变的实验条件可能是_______ ,判断的依据是___________________ 。
②一定温度下,下列能说明反应已达到平衡状态的是____
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(3)用NH3和Cl2反应可以制备具有强氧化性的三氯胺(三氯胺在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质),方程式为3Cl2(g)+NH3(g) NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
①T℃__________ 400℃(填“>”或“<”)。
②该反应的ΔH__________ 0(填“>”或“<”)。
③该反应自发进行的条件是__________ (填高温、低温、任何温度)。
④对该反应,下列说法正确的是_________ (填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按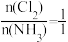 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动
I.NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
(1)写出NO2和SO2反应的热化学方程式为
(2)随温度升高,该反应化学平衡常数变化趋势是
II.(1)目前,应用NH3的催化还原法来进行烟气氮氧化物脱除,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0,该反应中,反应物总能量
(2)已知4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。 
①与容器a中的反应相比,容器b中的反应改变的实验条件可能是
②一定温度下,下列能说明反应已达到平衡状态的是
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(3)用NH3和Cl2反应可以制备具有强氧化性的三氯胺(三氯胺在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质),方程式为3Cl2(g)+NH3(g)
 NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:| t /min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②该反应的ΔH
③该反应自发进行的条件是
④对该反应,下列说法正确的是
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按
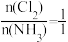 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】合成氨是目前最有效工业固氮的方法,解决数亿人口生存问题。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应 N2(g)+
N2(g)+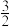 H2(g)
H2(g)  NH3(g)的∆H=
NH3(g)的∆H=___ kJ∙mol−1,该历程中反应速率最慢的步骤的化学方程式为___ 。
(2)工业合成氨反应为:N2(g)+3H2(g) 2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应平衡常数Kp(30MPa)______ Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为______ (保留2位有效数字),Kp=______ (列出计算式)。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应
 N2(g)+
N2(g)+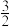 H2(g)
H2(g)  NH3(g)的∆H=
NH3(g)的∆H=(2)工业合成氨反应为:N2(g)+3H2(g)
 2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
①500℃时,反应平衡常数Kp(30MPa)
②500℃、30MPa时,氢气的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】我国对世界郑重承诺,2030 年前实现碳达峰,2060 年前实现碳中和,而研发二氧化碳的碳捕捉和碳利用技术则是关键。
I.我国力争于2030年前做到碳达峰,CO2和CH4催化重整制备合成气(主要成分为CO、H2)是CO2利用的研究热点之一。
(1)一定条件下,催化重整反应 CO2(g)+CH4(g) 2CO(g)+2H2(g) ΔH>0中CH4的平衡转化率与温度、压强的关系如图所示 (不考虑副反应),A、B、C三点对应的平衡常数KA、KB、KC的大小关系为
2CO(g)+2H2(g) ΔH>0中CH4的平衡转化率与温度、压强的关系如图所示 (不考虑副反应),A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_______ 。

(2)恒温下,往2L密闭容器中加入2molCH4、2molCO2进行该催化重整反应,2min后测得CO2的转化率为40%,则2min内平均反应速率v(CH4)=_______ mol· L-1·min‑1。
(3)在恒温、体系总压恒定为P0kPa下,往密闭容器中加入2molCH4、2molCO2进行该催化重整反应,达到平衡状态时,CO2的转化率为50%。已知气体分压=气体总压 ×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则该温度下的平衡常数Kp=_______ (kPa)2(用含P0的代数式表示)。
II.通过各国科技工作者的努力。已经开发出许多将CO2回收利用的技术。
(4)通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值认识CO2加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示

①写出甲酸盐路径决速步的化学方程式_______ 。
②下列说法正确的有_______ 。
A.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
B.不考虑H3COH* ,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
③该反应正逆反应的活化能大小为: Ea(正)_______ Ea(逆)(填“> ”或“< ”)
(5)在K2CrO7溶液中存在平衡_______ ,在CuCl2溶液中存在平衡_______ 。
I.我国力争于2030年前做到碳达峰,CO2和CH4催化重整制备合成气(主要成分为CO、H2)是CO2利用的研究热点之一。
(1)一定条件下,催化重整反应 CO2(g)+CH4(g)
 2CO(g)+2H2(g) ΔH>0中CH4的平衡转化率与温度、压强的关系如图所示 (不考虑副反应),A、B、C三点对应的平衡常数KA、KB、KC的大小关系为
2CO(g)+2H2(g) ΔH>0中CH4的平衡转化率与温度、压强的关系如图所示 (不考虑副反应),A、B、C三点对应的平衡常数KA、KB、KC的大小关系为
(2)恒温下,往2L密闭容器中加入2molCH4、2molCO2进行该催化重整反应,2min后测得CO2的转化率为40%,则2min内平均反应速率v(CH4)=
(3)在恒温、体系总压恒定为P0kPa下,往密闭容器中加入2molCH4、2molCO2进行该催化重整反应,达到平衡状态时,CO2的转化率为50%。已知气体分压=气体总压 ×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则该温度下的平衡常数Kp=
II.通过各国科技工作者的努力。已经开发出许多将CO2回收利用的技术。
(4)通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值认识CO2加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示

①写出甲酸盐路径决速步的化学方程式
②下列说法正确的有
A.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
B.不考虑H3COH* ,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
③该反应正逆反应的活化能大小为: Ea(正)
(5)在K2CrO7溶液中存在平衡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应I C4H10(g)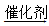 CH4(g)+CH3CH-CH3(g) △H1;
CH4(g)+CH3CH-CH3(g) △H1;
反应Ⅱ C4H10(g)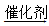 C2H6(g)+CH2=CH2(g) △H2;
C2H6(g)+CH2=CH2(g) △H2;
回答下列问题:
(1)正丁烷、乙烷和乙烯的燃烧热分别为Q1kJ·mol-1、Q2kJ·mol-1、Q3kJ·mol-1,反应Ⅱ的△H2=______________ 。
(2)一定温度下,向容积为5L的密闭容器中通入正丁烷,反应时间(t)与容器内气体总压强(p)数据如下:
①该温度下,正丁烷的平衡转化率a=__________ ;反应速率可以用单位时间内分压的变化表示,即v=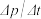 ,前2a min内正丁烷的平均反应速率
,前2a min内正丁烷的平均反应速率 =
=__________ MPa·min-1。
②若平衡时甲烷、乙烯的体积分数分别为 、
、 ,则该温度下反应I的压力平衡常数Kp=
,则该温度下反应I的压力平衡常数Kp=_________ MPa(用平衡分压代替平衡浓度计算,分压一总压×物质的量分数,保留三位有效数字)。
③若反应在恒温、恒压条件进行,平衡后反应容器的体积_________ 8.8L(填“>”“<”或“=”)。
④实际生产中发现高于640K后,乙烯和丙烯的产率随温度升高增加幅度减小,可能的原因是__________ (任写1条)。
(3)一种丁烷燃料电池工作原理如图所示。

①A电极上发生的是反应_________ (填“氧化“或“还原”)。
②写出B电极的电极反应式:______________________________________ 。
反应I C4H10(g)
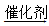 CH4(g)+CH3CH-CH3(g) △H1;
CH4(g)+CH3CH-CH3(g) △H1;反应Ⅱ C4H10(g)
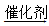 C2H6(g)+CH2=CH2(g) △H2;
C2H6(g)+CH2=CH2(g) △H2;回答下列问题:
(1)正丁烷、乙烷和乙烯的燃烧热分别为Q1kJ·mol-1、Q2kJ·mol-1、Q3kJ·mol-1,反应Ⅱ的△H2=
(2)一定温度下,向容积为5L的密闭容器中通入正丁烷,反应时间(t)与容器内气体总压强(p)数据如下:
| t/min | 0 | a | 2a | 3a | 4a |
| p/MPa | 5 | 7.2 | 8.4 | 8.8 | 8.8 |
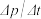 ,前2a min内正丁烷的平均反应速率
,前2a min内正丁烷的平均反应速率 =
=②若平衡时甲烷、乙烯的体积分数分别为
 、
、 ,则该温度下反应I的压力平衡常数Kp=
,则该温度下反应I的压力平衡常数Kp=③若反应在恒温、恒压条件进行,平衡后反应容器的体积
④实际生产中发现高于640K后,乙烯和丙烯的产率随温度升高增加幅度减小,可能的原因是
(3)一种丁烷燃料电池工作原理如图所示。

①A电极上发生的是反应
②写出B电极的电极反应式:
您最近一年使用:0次



