已知常温下列物质电离 的电离平衡常数分别为:
的电离平衡常数分别为: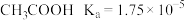 ;
;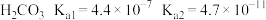 ;
;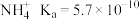 。甘氨酸(
。甘氨酸(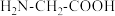 )是最简单的氨基酸。下列说法
)是最简单的氨基酸。下列说法不正确 的是
 的电离平衡常数分别为:
的电离平衡常数分别为: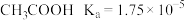 ;
;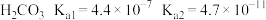 ;
;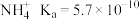 。甘氨酸(
。甘氨酸(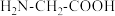 )是最简单的氨基酸。下列说法
)是最简单的氨基酸。下列说法A.甘氨酸是两性物质,既能与 溶液反应,也能与盐酸反应 溶液反应,也能与盐酸反应 |
| B.一定条件下氨基酸之间能发生聚合反应,生成更为复杂的多肽,进而构成蛋白质 |
| C.甘氨酸分子中没有手性碳原子,不存在对映异构体 |
D.甘氨酸能与 溶液反应生成二氧化碳气体 溶液反应生成二氧化碳气体 |
更新时间:2022-05-27 11:11:07
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】常温下,向 20mL0.2mol·L−1H2A 溶液中滴加 0.2mol·L−1NaOH 溶液,滴加过程中有关微粒的物质的量变化绘制在下图中。下列说法正确的是
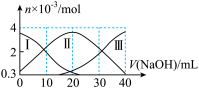

| A.当 V(NaOH)=10mL 时,溶液中粒子浓度大小关系为:c(Na+)>c(H2A)>c(HA−)>c(H+)>c(OH−) |
| B.当 V(NaOH)=20 mL 时,溶液中粒子浓度大小关系为:c(Na+)>c(H+)>c(HA−)>c(A2−)>c(H2A) |
| C.当 V(NaOH)=30 mL 时,溶液中存在以下关系:c(A2−)+2c(OH−)=c(HA−)+c(H+)+3c(H2A) |
| D.当 V(NaOH)=40mL 时,溶液中存在以下关系:c(Na+)=2[c(A2−)+c(HA−)+ c(H2A)] |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(H+)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(H+)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
| A.①③ | B.①④ | C.②⑤ | D.②④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】常温时,下列说法正确的是
| A.中和等体积、等浓度的氨水和氢氧化钠溶液至pH=7,前者消耗的盐酸多 |
| B.0.1mol/L 的NaHA溶液,其pH=4,则:c(HA-)>c((H+)>c(H2A)>c(A2-) |
| C.已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7、Ka2=4.7×10-11,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |
| D.将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液2c(OH-)+c(A-)=2c(H+)+c(HA) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】有机化合物Y可由X通过加成、消去两步反应制得,转化过程如图。下列说法错误的是
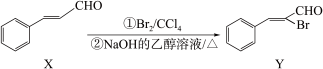
| A.X能使溴水褪色,说明X中含碳碳双键 |
| B.X存在顺反异构体 |
C.X→Y的转化过程中有副产物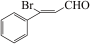 生成 生成 |
| D.Y与足量H2加成后的产物分子中只有一个手性碳原子 |
您最近一年使用:0次
【推荐2】一种食品添加剂桂醛,化学名称是3 -苯基丙烯醛,可由苯甲醛经下列方法合成,下列有关说法正确的是

| A.b物质分子中有 2个手性碳原子 |
| B.a、c分子中所有原子都可能处于同一平面 |
| C.合成路线中:a→b为取代反应,b→c为消去反应 |
| D.a、b、c三种物质可用溴水或酸性KMnO4 溶液鉴别 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】有机物AB2、 AB4、 AB8均可形成枝状高分子ABm。下列说法不正确的是


| A.AB2分子中有4种不同化学环境的氢原子 |
| B.AB4既能与强酸反应也能与强碱反应 |
| C.AB2生成ABm是缩聚反应 |
D.ABm的结构简式是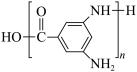 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列关于有机化合物的说法正确的是
| A.油脂的皂化反应可用硫酸作催化剂 |
| B.葡萄糖在酒化酶的作用下生成乙醇 |
| C.石油的分馏、裂化和煤的干馏均是化学变化 |
| D.汽油、乙酸和甘氨酸均能与氢氧化钠溶液反应 |
您最近一年使用:0次

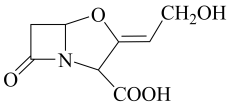
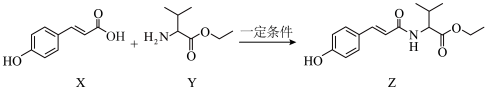
 都存在顺反异构体
都存在顺反异构体 既能与氢氧化钠溶液反应又能与盐酸反应
既能与氢氧化钠溶液反应又能与盐酸反应 可以发生消去、加成、缩聚反应
可以发生消去、加成、缩聚反应 化合物
化合物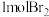 的溴水发生反应
的溴水发生反应

