反应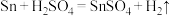 的能量变化趋势,如图所示:
的能量变化趋势,如图所示:

(1)该反应为_______ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)。
(3)若将上述反应设计成原电池,石墨棒为原电池某一极材料,该极上发生的电极反应为_______ ,原电池工作时溶液中的 移向
移向_______ 极移动(填正或负)。
(4)实验后同学们经过充分讨论,观察原电池反应特点,认为符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是_______ 。
A.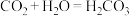 B.
B.
C. D.
D.
以KOH为电解质溶液,将所选反应设计成原电池,该电池负极反应为_______ 。
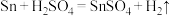 的能量变化趋势,如图所示:
的能量变化趋势,如图所示:
(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)。
| A.改锡片为锡粉 | B.加入少量碳酸钠固体 |
C.滴加少量 | D.将稀硫酸改为98%的浓硫酸 |
 移向
移向(4)实验后同学们经过充分讨论,观察原电池反应特点,认为符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.
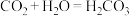 B.
B.
C.
 D.
D.
以KOH为电解质溶液,将所选反应设计成原电池,该电池负极反应为
更新时间:2022-05-27 18:43:49
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为_______ 。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
0~50s内的平均反应速率v(N2)=_______ 。
(3)已知:键能指在标准状况下,将lmol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_______ kJ/mol。
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是_______ (填“正极”或“负极”),若外电路中转移2 mol电子,则上述电池所消耗的O2在标准状况下的体积为_______ L。
(5)下列反应中,属于吸热反应的是_______ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④食物因氧化而腐败 ⑤Ba(OH)2·8H2O与NH4Cl反应 ⑥铁粉与稀盐酸反应

(1)由图中所给数据进行分析,该反应的化学方程式为
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=
(3)已知:键能指在标准状况下,将lmol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④食物因氧化而腐败 ⑤Ba(OH)2·8H2O与NH4Cl反应 ⑥铁粉与稀盐酸反应
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为______________________ 。
Ⅱ.肼(N2H4)又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知N-H键、O=O键键能分别为391kJ•mol-1、497kJ•mol-1,N2H4(g)与O2(g)反应的能量变化如图所示:

(2)N2H4(g)与O2(g)的反应是_______ (放热/吸热)反应,
(3)N2H4(g)中N-N键的键能为_____________________ 。
Ⅲ.某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如图实验。实验装置如图所示:

(4)设计装置A的目的是____________ 。
(5)为除去挥发出的HCl,X为________ 。
(6)待观察到________ (填实验现象)时可移动铜丝将其插入稀硝酸。
(7)气体Y是______ (填化学式),将Y气体推入D操作的作用是:_____ 。
(8)若装置F吸收的气体为NO2和NO的混合物,且气体物质的量之比为1:1,反应产物之一为NaNO2,则反应的化学方程式为__________ 。
甲醇合成反应:(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
Ⅱ.肼(N2H4)又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知N-H键、O=O键键能分别为391kJ•mol-1、497kJ•mol-1,N2H4(g)与O2(g)反应的能量变化如图所示:

(2)N2H4(g)与O2(g)的反应是
(3)N2H4(g)中N-N键的键能为
Ⅲ.某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如图实验。实验装置如图所示:

(4)设计装置A的目的是
(5)为除去挥发出的HCl,X为
(6)待观察到
(7)气体Y是
(8)若装置F吸收的气体为NO2和NO的混合物,且气体物质的量之比为1:1,反应产物之一为NaNO2,则反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】化学反应中均伴随有能量变化。回答下列问题:
(1)下列反应中,反应物的总能量小于生成物的总能量的是___________ (填选项字母)。
A.Na2O2与H2O反应 B.乙醇的燃烧反应 C.CaCO3受热分解
(2)已知25℃时,下列物质的相对能量如表所示:
①表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
②36g 分解生成
分解生成 和
和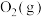
___________ (填“吸收”或“放出”)___________ kJ的热量。
(3)已知反应: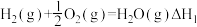

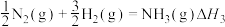
写出氨气和氧气反应生成NO2和水蒸气的热化学方程式___________ (用 、
、 、
、 、
、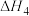 表示反应的
表示反应的 )
)
(4)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程___________ (填“吸收”或“放出”)的热量是___________ kJ。
(5)甲醇是一种新型的汽车动力燃料。
①以 和
和 为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为___________ 。
设CO以C≡O键构成,则工业制备甲醇的热化学方程式为___________ 。
(1)下列反应中,反应物的总能量小于生成物的总能量的是
A.Na2O2与H2O反应 B.乙醇的燃烧反应 C.CaCO3受热分解
(2)已知25℃时,下列物质的相对能量如表所示:
| 物质 |  | 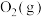 |  | 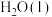 |
| 相对能量(kJ·mol-1) | 0 | 0 | -242 | -286 |
 燃烧热的热化学方程式为
燃烧热的热化学方程式为②36g
 分解生成
分解生成 和
和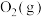
(3)已知反应:
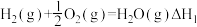

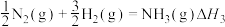
写出氨气和氧气反应生成NO2和水蒸气的热化学方程式
 、
、 、
、 、
、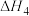 表示反应的
表示反应的 )
)(4)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程(5)甲醇是一种新型的汽车动力燃料。
①以
 和
和 为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为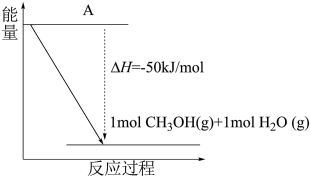
②工业上利用CO和H2来制备甲醇(CH3OH,结构式为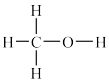 )气体。已知某些化学键的键能数据如下表:
)气体。已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验小组探究 溶液与
溶液与 溶液的反应及其速率,实验过程和现象如表。已知:
溶液的反应及其速率,实验过程和现象如表。已知:
i、 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;
ii、淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝:
即可快速变蓝:
iii、可与 发生反应:
发生反应: 。
。
(1)实验1-1的目的是___________ 。
(2) 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
为了研究 与
与 反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
(3)实验2-1不能用于测定 与KI反应的速率,原因除变色时间过短外还有
与KI反应的速率,原因除变色时间过短外还有___________ 。
(4)加入 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
猜想1: 先与
先与 反应,使
反应,使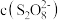 降低;
降低;
猜想2: 先与
先与 反应,___________。
反应,___________。
①甲同学提出猜想1的依据:由信息iii推测, 的还原性
的还原性___________ (填“强于”或“弱于”) 的。
的。
②乙同学根据现有数据证明猜想1不成立,理由是___________ 。
③补全猜想2:___________ 。
(5)查阅文献表明猜想2成立。根据实验2-2的数据,计算 内的平均反应速率
内的平均反应速率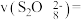
___________  (写出计算式)。
(写出计算式)。
 溶液与
溶液与 溶液的反应及其速率,实验过程和现象如表。已知:
溶液的反应及其速率,实验过程和现象如表。已知:i、
 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;ii、淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝:
即可快速变蓝:iii、可与
 发生反应:
发生反应: 。
。| 编号 | 1-1 | 1-2 |
| 实验操作 | 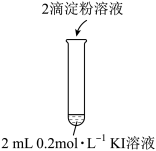 | 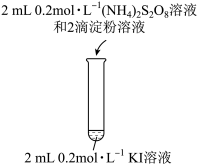 |
| 现象 | 无明显现象 | 溶液立即变蓝 |
(2)
 与
与 反应的离子方程式为
反应的离子方程式为为了研究
 与
与 反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。| 编号 | 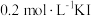 溶液 溶液 | 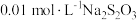 溶液 溶液 | 蒸馏水 | 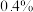 的淀粉溶液/滴 的淀粉溶液/滴 | 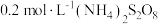 溶液 溶液 | 变色时间/s |
| 2-1 | 2 | 0 | 2.8 | 2 | 0.2 | 立即 |
| 2-2 | 2 | 0.8 | 0.2 | 2 | 0 | 30 |
 与KI反应的速率,原因除变色时间过短外还有
与KI反应的速率,原因除变色时间过短外还有(4)加入
 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。猜想1:
 先与
先与 反应,使
反应,使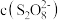 降低;
降低;猜想2:
 先与
先与 反应,___________。
反应,___________。①甲同学提出猜想1的依据:由信息iii推测,
 的还原性
的还原性 的。
的。②乙同学根据现有数据证明猜想1不成立,理由是
③补全猜想2:
(5)查阅文献表明猜想2成立。根据实验2-2的数据,计算
 内的平均反应速率
内的平均反应速率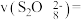
 (写出计算式)。
(写出计算式)。
您最近一年使用:0次
【推荐2】目前的锂离子电池的正极材料多是LiCoO2、LiMn2O4、LiFePO4和双离子传递型聚合物等。改良正极材料的性能是锂离子电池领域的重点方向,如用碳包覆LiFePO4和向其中掺杂金属银等。下列过程是制备该正极材料的流程图:

回答下列问题:
(1)LiFePO4中铁元素的化合价为_____ 价。已知原料是Li2CO3、FeC2O4·2H2O、NH4H2PO4和C6H12O6的混合物,其中Li、Fe、P三种元素的物质的量比为1:1:1,C6H12O6的用量占原料总质量的5%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量为_______ (保留两位小数)。
(2)将原料先行研磨4 h目的是_________ 。为了更快得到前驱体粉末,除了保持温度在50℃外,还应进行的常见操作方法是_________ 。
(3)两次焙烧均需要在高纯氮气环境下进行,原因是________ 。葡萄糖分解产生的碳除了提供还原性环境,提高产物纯度,而且可以阻止晶粒的聚集长大,控制颗粒形状,提高LiFePO4的电导率。则葡萄糖分解的化学反应方程式(分解过程中只有C一种单质生成)为________ 。600℃加热时硝酸银发生分解生成红棕色气体和3种常见单质(其中两种气体单质物质的量比为2:7),则分解时的化学反应方程式为_______ 。
(4)如图所示是用LiFePO4/Ag/C作正极材料制成的纽扣锂离子电池组装示意图。充电时,其正、负极材料所发生反应的电极方程式分别是______ 、______ (锂离子电池是靠xLi+在两极的嵌入和嵌出进行工作)。
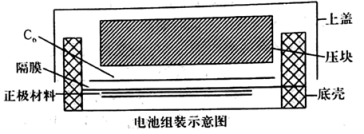

回答下列问题:
(1)LiFePO4中铁元素的化合价为
(2)将原料先行研磨4 h目的是
(3)两次焙烧均需要在高纯氮气环境下进行,原因是
(4)如图所示是用LiFePO4/Ag/C作正极材料制成的纽扣锂离子电池组装示意图。充电时,其正、负极材料所发生反应的电极方程式分别是

您最近一年使用:0次
【推荐3】Ⅰ.降低能耗是氯碱工业发展的重要方向。我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
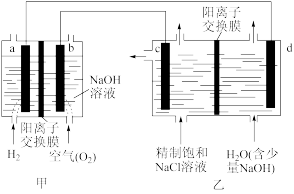
(1)写出b电极的电极反应式_______ 。
(2)写出乙装置发生的总化学方程式_______ 。
(3)若放电一段时间后,消耗空气22.4L(标况),不考虑损耗的情况下,乙池产生的气体_______ mol。
(4)下列说法正确的是_______ 。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
Ⅱ.二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH。在密闭容器中投入1mol CO2和2.75mol H2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
CH3OH(g)+H2O(g) ΔH。在密闭容器中投入1mol CO2和2.75mol H2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
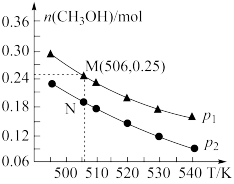
(5)二氧化碳合成甲醇正反应的ΔH_______ 0(填“>”、“<”或“=”),理由是_______ 。
(6)一定条件下,向容积不变的某密闭容器中加入a mol CO2和b mol H2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的大小关系式是
CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的大小关系式是_______ 。
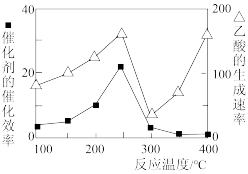
(7)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。当乙酸的生成速率主要取决于温度时,其影响范围是_______ 。

(1)写出b电极的电极反应式
(2)写出乙装置发生的总化学方程式
(3)若放电一段时间后,消耗空气22.4L(标况),不考虑损耗的情况下,乙池产生的气体
(4)下列说法正确的是
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
Ⅱ.二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH。在密闭容器中投入1mol CO2和2.75mol H2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
CH3OH(g)+H2O(g) ΔH。在密闭容器中投入1mol CO2和2.75mol H2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
(5)二氧化碳合成甲醇正反应的ΔH
(6)一定条件下,向容积不变的某密闭容器中加入a mol CO2和b mol H2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的大小关系式是
CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的大小关系式是(7)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。当乙酸的生成速率主要取决于温度时,其影响范围是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】电池的种类繁多,应用广泛。根据电化学原理回答下列问题。
(1)厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸,其原理如下图所示。图中HA表示乳酸分子, 表示乳酸根离子,回答下列问题:
表示乳酸根离子,回答下列问题:

①乳酸结构简式为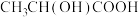 ,其中所含官能团的名称是
,其中所含官能团的名称是_____ 。
②阳极的电极反应式为_____ 。500mL10.0g/L的乳酸溶液通电一段时间后,浓度上升为145g/L(忽略溶液体积变化),阴极上产生的 在标准状况下的体积约为
在标准状况下的体积约为___________ L。[M(乳酸)=90g/mol]在浓缩室能得到浓乳酸溶液的原因是___________ 。
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。X极生成0.1mol 时,
时,___________ molLi+移向___________ (填“X”或“Y”)极。

(1)厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸,其原理如下图所示。图中HA表示乳酸分子,
 表示乳酸根离子,回答下列问题:
表示乳酸根离子,回答下列问题:
①乳酸结构简式为
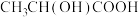 ,其中所含官能团的名称是
,其中所含官能团的名称是②阳极的电极反应式为
 在标准状况下的体积约为
在标准状况下的体积约为(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。X极生成0.1mol
 时,
时,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】请写出该反应的热化学方程式:
(1)已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,___________ 。
(2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:___________ 。
(3)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol−1,请写出1 mol NH3分解对应的热化学方程式:
2NH3(g) ΔH=-92.4 kJ·mol−1,请写出1 mol NH3分解对应的热化学方程式:___________ 。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:___________ 。
(5)CH4-CO2的催化重整不仅可以得到合成气(CO和H2)。还对温室气体的减排具有重要意义。CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)= CH4(g) △H=-75 kJ/mol
C(s)+O2(g)=CO2(g) △H=-394 kJ/mol
C(s)+ O2(g)= CO(g) △H=-111 kJ/mol
O2(g)= CO(g) △H=-111 kJ/mol
该催化重整的热化学反应方程式是___________ 。
(6)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是___________ 。
②M点对应的H2转化率是___________ 。
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。则该燃料电池的负极反应式是___________ 。
(1)已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,
(2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:
(3)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol−1,请写出1 mol NH3分解对应的热化学方程式:
2NH3(g) ΔH=-92.4 kJ·mol−1,请写出1 mol NH3分解对应的热化学方程式:(4)已知一些化学键的键能数据如表所示:
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/kJ·mol-1 | 414 | 489 | 565 | 155 |
(5)CH4-CO2的催化重整不仅可以得到合成气(CO和H2)。还对温室气体的减排具有重要意义。CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)= CH4(g) △H=-75 kJ/mol
C(s)+O2(g)=CO2(g) △H=-394 kJ/mol
C(s)+
 O2(g)= CO(g) △H=-111 kJ/mol
O2(g)= CO(g) △H=-111 kJ/mol该催化重整的热化学反应方程式是
(6)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是
②M点对应的H2转化率是
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。则该燃料电池的负极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】Ⅰ.如图是某同学设计的一个简易原电池装置。
请回答下列问题。
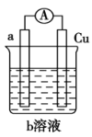
(1)若a电极材料为碳、b溶液为 溶液,则正极的电极反应式为
溶液,则正极的电极反应式为___________ ,当有 负极材料溶解时,转移的电子为
负极材料溶解时,转移的电子为___________  。
。
(2)若a电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为___________ →___________ (填电极材料,下同),溶液中的 向
向___________ 极移动。
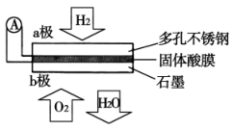
(3)某固体酸膜燃料电池(如图所示)以 固体为电解质传递
固体为电解质传递 ,电池总反应可表示为
,电池总反应可表示为 。则a为电池
。则a为电池___________ 极,b极上的电极反应为___________ 。
Ⅱ.原子间形成化学键放出能量,破坏原子间化学键需要吸收能量。已知 键、
键、 键、
键、 键的键能分别为
键的键能分别为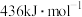 、
、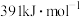 、
、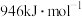 。关于工业合成氨的反应,请根据键能的数据判断下列问题。
。关于工业合成氨的反应,请根据键能的数据判断下列问题。
(4)若有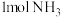 生成,需要
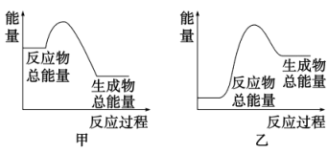
生成,需要___________ (填“吸收”或“放出”)热量___________  ;该反应的能量变化可用图
;该反应的能量变化可用图___________ 表示(填“甲”或“乙”)。
Ⅲ. 在
在 催化下可发生分解反应,为探究一定温度下
催化下可发生分解反应,为探究一定温度下 溶液的浓度、
溶液的浓度、 的浓度对
的浓度对 分解速率的影响,某同学设计了如下实验,内容如下表所示:
分解速率的影响,某同学设计了如下实验,内容如下表所示:
(5)①
___________ 。
②实验甲、乙的探究目的是___________ 。
③实验甲、丙探究催化剂浓度对 分解速率的影响情况,则
分解速率的影响情况,则
___________ ;若实验丙中产生气泡的速率较快,由此可得出的结论是___________ 。
请回答下列问题。

(1)若a电极材料为碳、b溶液为
 溶液,则正极的电极反应式为
溶液,则正极的电极反应式为 负极材料溶解时,转移的电子为
负极材料溶解时,转移的电子为 。
。(2)若a电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为
 向
向(3)某固体酸膜燃料电池(如图所示)以
 固体为电解质传递
固体为电解质传递 ,电池总反应可表示为
,电池总反应可表示为 。则a为电池
。则a为电池
Ⅱ.原子间形成化学键放出能量,破坏原子间化学键需要吸收能量。已知
 键、
键、 键、
键、 键的键能分别为
键的键能分别为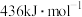 、
、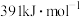 、
、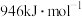 。关于工业合成氨的反应,请根据键能的数据判断下列问题。
。关于工业合成氨的反应,请根据键能的数据判断下列问题。(4)若有
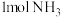 生成,需要
生成,需要 ;该反应的能量变化可用图
;该反应的能量变化可用图
Ⅲ.
 在
在 催化下可发生分解反应,为探究一定温度下
催化下可发生分解反应,为探究一定温度下 溶液的浓度、
溶液的浓度、 的浓度对
的浓度对 分解速率的影响,某同学设计了如下实验,内容如下表所示:
分解速率的影响,某同学设计了如下实验,内容如下表所示:| 实验序号 | 实验所用试剂 | ||||
酸性 溶液 溶液 |  溶液 溶液 |  | |||
 |  |  |  |  | |
| 甲 | 4 | 0.1 | 3 | 2 | 3 |
| 乙 | 4 | 0.1 | 2 | 2 |  |
| 丙 | 5 | 0.1 |  | 2 | 2 |
(5)①

②实验甲、乙的探究目的是
③实验甲、丙探究催化剂浓度对
 分解速率的影响情况,则
分解速率的影响情况,则
您最近一年使用:0次



