如图是短周期主族元素电负性与第一电离能的关系。回答下列问题:
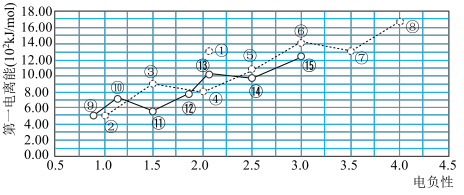
(1)元素③基态原子的电子排布式为___________ ;元素⑪的离子结构示意图为___________ 。
(2)元素①⑤⑧组成的18电子的化合物,其空间构型为___________ 。
(3)元素⑧⑨⑩⑭形成的简单离子,其离子半径由小到大的顺序为___________ (填离子符号),元素⑥⑫⑬形成的简单氢化物,熔沸点由低到高的顺序是___________ (填化学式)。
(4)实验室制备⑮单质的离子方程式为___________ 。
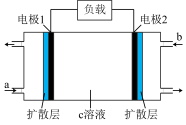
(5)我国研发的新能源汽车燃料电池工作原理如图所示,其中a为元素①与⑤形成的最简单化合物,b为元素⑦的单质,c为元素⑨的最高价氧化物对应水化物,反应后得到元素⑤的最高价含氧酸盐。则电极2上的电极反应式为___________ 。通入标准状况下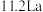 ,测得电路中转移
,测得电路中转移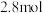 电子,则该电池电能的利用率为
电子,则该电池电能的利用率为___________ 。

(1)元素③基态原子的电子排布式为
(2)元素①⑤⑧组成的18电子的化合物,其空间构型为
(3)元素⑧⑨⑩⑭形成的简单离子,其离子半径由小到大的顺序为
(4)实验室制备⑮单质的离子方程式为
(5)我国研发的新能源汽车燃料电池工作原理如图所示,其中a为元素①与⑤形成的最简单化合物,b为元素⑦的单质,c为元素⑨的最高价氧化物对应水化物,反应后得到元素⑤的最高价含氧酸盐。则电极2上的电极反应式为
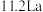 ,测得电路中转移
,测得电路中转移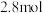 电子,则该电池电能的利用率为
电子,则该电池电能的利用率为
更新时间:2022-07-15 19:51:11
|
相似题推荐
【推荐1】大气污染的危害是多方面的,它既危害人体健康,又影响动植物的生长,严重时会影响地球的气候。大气污染主要是由人为排放的烟尘和有害气体造成的。
(1)工业接触法制硫酸的主要反应之一是2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol
2SO3(g) △H=-196.6kJ/mol
①一定条件下,将SO2于空气充分混合并反应。t min后,SO2和SO3物质的量浓度分别为amol/L和bmol/L,则以SO2表示的化学反应速率为________________
②为了提高反应速率,同时提高SO2的转化率,从而减少SO2的排放,下列条件可改变的是_______
A 增大压强 b升高温度 c增大催化剂用量d降低温度
(2)CO2的过度排放会造成另一种大气污染——“温室效应”。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径
①下列措施中,有利于降低大气中CO2浓度的有_____________
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
②另一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) = C2H4(g)+3O2(g) △H=+1411.0kJ/mol
2CO2(g)+3H2O(l) = C2H5OH(l)+3O2(g) △H=+1366.8 kJ/mol
则由乙烯水化制乙醇的热化学方程式是:____________________________________________ 。
③在一定条件下:6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
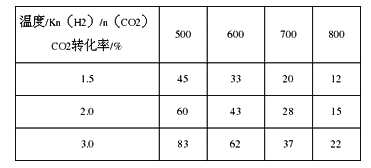
根据上表中数据分析:
i.温度一定时,提高碳氢比[n(H2)/n(CO2)],CO2的转化率________ (填“增大”“减小”或“不变”)
ii.该反应的正反应为_______ (填“吸”或“放”)热反应
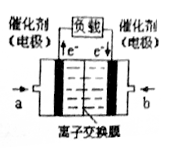
iii.为了避免乙醇燃烧释放CO2,可以设计成乙醇燃料电池,右图为该电池的结构示意图(电解质溶液为KOH溶液)。则a处电极上的电极反应式为______________________________ 。
(1)工业接触法制硫酸的主要反应之一是2SO2(g)+O2(g)
 2SO3(g) △H=-196.6kJ/mol
2SO3(g) △H=-196.6kJ/mol①一定条件下,将SO2于空气充分混合并反应。t min后,SO2和SO3物质的量浓度分别为amol/L和bmol/L,则以SO2表示的化学反应速率为
②为了提高反应速率,同时提高SO2的转化率,从而减少SO2的排放,下列条件可改变的是
A 增大压强 b升高温度 c增大催化剂用量d降低温度
(2)CO2的过度排放会造成另一种大气污染——“温室效应”。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径
①下列措施中,有利于降低大气中CO2浓度的有
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
②另一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) = C2H4(g)+3O2(g) △H=+1411.0kJ/mol
2CO2(g)+3H2O(l) = C2H5OH(l)+3O2(g) △H=+1366.8 kJ/mol
则由乙烯水化制乙醇的热化学方程式是:
③在一定条件下:6H2(g)+2CO2(g)
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
根据上表中数据分析:
i.温度一定时,提高碳氢比[n(H2)/n(CO2)],CO2的转化率
ii.该反应的正反应为
iii.为了避免乙醇燃烧释放CO2,可以设计成乙醇燃料电池,右图为该电池的结构示意图(电解质溶液为KOH溶液)。则a处电极上的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】近年来,氮氧化物进行治理已成为环境科学的重要课题。
(1)在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示。
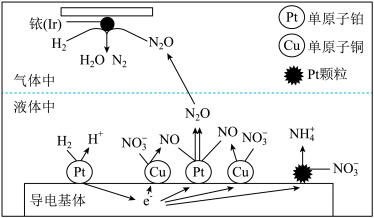
金属铱(Ir)表面发生了氧化还原反应,其还原产物的电子式是_____ ;若导电基体上的Pt颗粒增多,不利于降低溶液的含氮量,用电极反应式解释原因 _____________ 。
(2)在密闭容器中充入 10 mol CO和8 mol NO,发生反应 2NO(g)+2CO(g) N2(g) +2CO2(g) ∆H<0,如图为平衡时NO的体积分数与温度、压强的关系。
N2(g) +2CO2(g) ∆H<0,如图为平衡时NO的体积分数与温度、压强的关系。
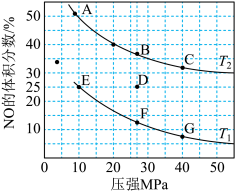
①该反应达到平衡后,为提高反应速率且同时提高转化率,可采取的措施有_______ (填序号)。
a.改用高效催化剂 b.缩小容器的体积
c.升高温度 d.减小CO2的浓度
②压强为20 MPa、温度为T2下,若反应达到平衡状态时容器的体积为4 L,则此时CO2的浓度为_______ 。
③若在D点对反应容器升温的同时增大其体积至体系压强减小,重新达到的平衡状态可能是图中A ~G点中的_______ 点。
(3)研究表明,NOx的脱除率除与还原剂、催化剂相关外,还与催化剂表面氧缺位的密集程度成正比。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:NO(g)+□→NO(a) ΔH1 K1 2NO(a)→2N(a)+O2(g) ΔH2 K2
2N(a)→N2(g)+2□ ΔH3 K3 2NO(a)→N2(g)+2O(a) ΔH4 K4
2O(a)→O2(g)+2□ ΔH5K5
注:“□”表示催化剂表面的氧缺位,“g”表示气态,“a”表示吸附态。
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是________________ 。第二阶段中各反应焓变间的关系:∆H2+∆H3=_____ ;该温度下,NO脱除反应2NO(g) N2(g)+O2(g)的平衡常数K=
N2(g)+O2(g)的平衡常数K=____ (用含K1、K2、K3的表达式表示)。
(1)在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示。

金属铱(Ir)表面发生了氧化还原反应,其还原产物的电子式是
(2)在密闭容器中充入 10 mol CO和8 mol NO,发生反应 2NO(g)+2CO(g)
 N2(g) +2CO2(g) ∆H<0,如图为平衡时NO的体积分数与温度、压强的关系。
N2(g) +2CO2(g) ∆H<0,如图为平衡时NO的体积分数与温度、压强的关系。
①该反应达到平衡后,为提高反应速率且同时提高转化率,可采取的措施有
a.改用高效催化剂 b.缩小容器的体积
c.升高温度 d.减小CO2的浓度
②压强为20 MPa、温度为T2下,若反应达到平衡状态时容器的体积为4 L,则此时CO2的浓度为
③若在D点对反应容器升温的同时增大其体积至体系压强减小,重新达到的平衡状态可能是图中A ~G点中的
(3)研究表明,NOx的脱除率除与还原剂、催化剂相关外,还与催化剂表面氧缺位的密集程度成正比。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:NO(g)+□→NO(a) ΔH1 K1 2NO(a)→2N(a)+O2(g) ΔH2 K2
2N(a)→N2(g)+2□ ΔH3 K3 2NO(a)→N2(g)+2O(a) ΔH4 K4
2O(a)→O2(g)+2□ ΔH5K5
注:“□”表示催化剂表面的氧缺位,“g”表示气态,“a”表示吸附态。
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
 N2(g)+O2(g)的平衡常数K=
N2(g)+O2(g)的平衡常数K=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某实验小组对 与
与 的反应进行探究。
的反应进行探究。
【实验前的预测】
(1)甲同学认为配制 溶液时,应先将
溶液时,应先将 固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制
固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制 溶液时加浓盐酸的目的:
溶液时加浓盐酸的目的:_______ 。
(2)乙同学分析 溶液中的微粒组成认为:
溶液中的微粒组成认为:
①溶液含 、
、 、
、 微粒,且
微粒,且
②溶液显碱性,且
你认为乙同学观点正确的是_______ (填序号)。
丙同学根据物质的价态预测 与
与 两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
【实验设计与操作】
(3)两溶液不接触的实验
按丙同学思路,设计以下实验进行相关探究。
(4)两溶液接触的反应
在 溶液中滴加
溶液中滴加 溶液,边滴加边振荡并观察现象。
溶液,边滴加边振荡并观察现象。
甲同学认为实验III红褐色的“溶液”可能是氢氧化铁胶体,他用_______ 实验证实了推测。
【实验结论与反思】
(5)通过对实验现象分析,小组同学得出如下结论:
① 溶液与
溶液与 溶液同时发生氧化还原反应和相互促进的水解反应。
溶液同时发生氧化还原反应和相互促进的水解反应。
②当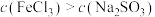 时水解反应占主导地位。
时水解反应占主导地位。
你同意他们的哪些观点_______ (填序号,若均不同意则填无)。此外,若兼顾化学反应速率和化学反应限度两个角度,你还能得出什么结论:_______ 。
 与
与 的反应进行探究。
的反应进行探究。【实验前的预测】
(1)甲同学认为配制
 溶液时,应先将
溶液时,应先将 固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制
固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制 溶液时加浓盐酸的目的:
溶液时加浓盐酸的目的:(2)乙同学分析
 溶液中的微粒组成认为:
溶液中的微粒组成认为:①溶液含
 、
、 、
、 微粒,且
微粒,且
②溶液显碱性,且

你认为乙同学观点正确的是
丙同学根据物质的价态预测
 与
与 两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。【实验设计与操作】
(3)两溶液不接触的实验
按丙同学思路,设计以下实验进行相关探究。
| 装置 | 实验现象 | 相关探究 |
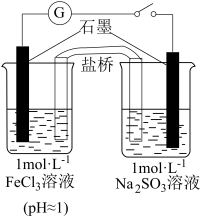 | 闭合开关后灵敏电流计指针发生偏转 | ①写出负极的电极反应式为 ②探究正极产物的实验方案为 |
在
 溶液中滴加
溶液中滴加 溶液,边滴加边振荡并观察现象。
溶液,边滴加边振荡并观察现象。| 实验编号 | 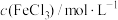 | 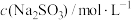 | 实验现象 |
| I | 1.0 | 1.0 | 溶液由橘黄色变为红褐色并有沉淀生成,振荡后沉淀消失。继续滴加 ,溶液颜色加深,放置一小时后溶液变为绿色 ,溶液颜色加深,放置一小时后溶液变为绿色 |
| II | 1.0 | 0.1 | 溶液由橘黄色变为红褐色,没有沉淀生成,继续滴加 ,溶液颜色加深,放置一小时后溶液变为黄色 ,溶液颜色加深,放置一小时后溶液变为黄色 |
| III | 0.1 | 1.0 | 溶液由橘黄色变为红褐色,没有沉淀生成,继续滴加 ,溶液颜色加深,放置一小时后溶液基本没有变化依然为红褐色 ,溶液颜色加深,放置一小时后溶液基本没有变化依然为红褐色 |
| IV | 0.1 | 0.1 | 溶液由橘黄色变为红色,没有沉淀生成,继续滴加 ,溶液颜色也加深,放置一小时后溶液颜色变为浅绿色,接近无色 ,溶液颜色也加深,放置一小时后溶液颜色变为浅绿色,接近无色 |
【实验结论与反思】
(5)通过对实验现象分析,小组同学得出如下结论:
①
 溶液与
溶液与 溶液同时发生氧化还原反应和相互促进的水解反应。
溶液同时发生氧化还原反应和相互促进的水解反应。②当
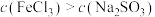 时水解反应占主导地位。
时水解反应占主导地位。你同意他们的哪些观点
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
真题
解题方法
【推荐1】氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: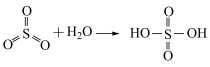
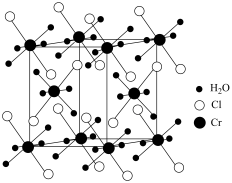
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: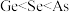 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。

利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】中国“奋斗者”号深潜器研制及海试的成功,在钛合金材料制备、锂离子电池等方面实现了重大突破。
(1)深潜器的壳体由含钛、铝等元素的Ti-62A钛合金材料制成,该合金材料的熔点比组成成分的金属_______ (选填“高”或“低”);铝元素的原子核外共有_______ 种不同能级的电子;以下方法可以比较钠和铝金属性强弱的方法_______ 。
a.比较两种金属单质的硬度和熔点
b.用钠置换氯化镁溶液中的镁
c.比较等物质的量的两种金属单质和足量盐酸反应失去的电子数
d.将空气中放置已久的这两种元素的单质分别和热水作用
e.在氯化铝溶液中逐滴滴加过量的氢氧化钠溶液
(2)氮氧化铝((AlON)是一种高硬度、耐高温的防弹材料,属于_______ 晶体,Al、O、N三种元素的简单离子半径由大到小的排列顺序是_______
(3)明矾[ ]溶液中离子浓度从大到小的顺序为
]溶液中离子浓度从大到小的顺序为_______ 。 固体能除去镁盐溶液中的
固体能除去镁盐溶液中的 ,原因是
,原因是_______ 。(用离子方程式表达)
(4)在周期表中,锂的性质与镁相似,写出锂在氧气中燃烧产物的电子式_______
(5)已知: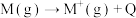 (M代表碱金属元素)
(M代表碱金属元素)
从原子结构的角度解释上述金属Q值递变的原因:_______ 。
(1)深潜器的壳体由含钛、铝等元素的Ti-62A钛合金材料制成,该合金材料的熔点比组成成分的金属
a.比较两种金属单质的硬度和熔点
b.用钠置换氯化镁溶液中的镁
c.比较等物质的量的两种金属单质和足量盐酸反应失去的电子数
d.将空气中放置已久的这两种元素的单质分别和热水作用
e.在氯化铝溶液中逐滴滴加过量的氢氧化钠溶液
(2)氮氧化铝((AlON)是一种高硬度、耐高温的防弹材料,属于
(3)明矾[
 ]溶液中离子浓度从大到小的顺序为
]溶液中离子浓度从大到小的顺序为 固体能除去镁盐溶液中的
固体能除去镁盐溶液中的 ,原因是
,原因是(4)在周期表中,锂的性质与镁相似,写出锂在氧气中燃烧产物的电子式
(5)已知:
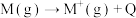 (M代表碱金属元素)
(M代表碱金属元素)| 元素 | Li | Na | K | Rb |
| Q(kJ) | 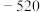 | 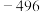 |  | 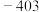 |
从原子结构的角度解释上述金属Q值递变的原因:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)B的简单气态氢化物的沸点___________ (填“高于”或“低于”)PH3,原因是___________ 。
(3)A、B、C三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(5)G元素可形成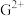 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物___________ (填“能”或“不能”)与 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比 大1 大1 |
| C | 基态原子中 电子总数与p电子总数相等 电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为3s23p1 |
| F | 基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)B的简单气态氢化物的沸点
(3)A、B、C三种元素的电负性由高到低的排列次序为
(4)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为(5)G元素可形成
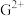 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为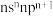 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的 ,E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子:G元素与A元素位于同一主族,其某种氧化物有剧毒。
,E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子:G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)基态B原子核外电子的轨道表示式为___________ ,基态B原子中电子占据最高能级的电子云轮廓图为___________ 形。
(2)D原子的基态原子的价电子排布式为___________ ,F元素位于元素周期表的___________ 区。
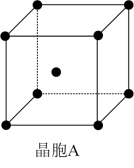
(3)用X射线衍射测定,得到E的两种晶胞A、B,其结构如图所示。晶胞A中每个E原子紧邻的原子数为___________ 。每个晶胞B中含E原子数为___________ 。

(4)A、B、C三种元素的第一电离能由大到小的顺序为___________ (用元素符号表示,下同);A、B、C三种元素的电负性由小到大的顺序为___________ 。
(5)元素B和元素C可形成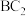 分子,该分子的空间结构为
分子,该分子的空间结构为___________ 。
(6)元素A的简单气态氢化物与元素B的简单气态氢化物相比较,稳定性较强的是___________ (填电子式)。
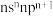 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的 ,E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子:G元素与A元素位于同一主族,其某种氧化物有剧毒。
,E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子:G元素与A元素位于同一主族,其某种氧化物有剧毒。(1)基态B原子核外电子的轨道表示式为
(2)D原子的基态原子的价电子排布式为
(3)用X射线衍射测定,得到E的两种晶胞A、B,其结构如图所示。晶胞A中每个E原子紧邻的原子数为


(4)A、B、C三种元素的第一电离能由大到小的顺序为
(5)元素B和元素C可形成
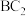 分子,该分子的空间结构为
分子,该分子的空间结构为(6)元素A的简单气态氢化物与元素B的简单气态氢化物相比较,稳定性较强的是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】A、B、C、D为短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知A是原子结构最简单的元素;B元素原子最外层上的电子数是其电子层数的2倍;A和C之间可形成A2C和A2C2两种化合物;D在同周期主族元素中原子半径最大,请回答下列问题。
(1)C元素在元素周期表中的位置是____________ ;C、D两种元素所形成的简单离子,离子半径由大到小的顺序是________________ 。(用离子符号表示)
(2)写出A2C2的电子式__________ 。
(3)在恒温下,体积为2 L的恒容容器中加入一定量的B单质和1 mol A2C蒸汽,发生:B(s)+A2C(g) ⇌BC(g)+A2(g)。2 min后,容器的压强增加了20%,则2 min内A2C的反应速率为________ 。一段时间后达到平衡,下列说法正确的是__________ 。
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2 min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在DCA溶液中可形成一种燃料电池。该电池的负极反应式为:___________ 。
(5)将0.2 mol D2C2投入到含有0.1 mol FeCl2的水溶液中恰好充分反应,反应的总化学方程式为:______________________________________________ 。
(1)C元素在元素周期表中的位置是
(2)写出A2C2的电子式
(3)在恒温下,体积为2 L的恒容容器中加入一定量的B单质和1 mol A2C蒸汽,发生:B(s)+A2C(g) ⇌BC(g)+A2(g)。2 min后,容器的压强增加了20%,则2 min内A2C的反应速率为
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2 min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在DCA溶液中可形成一种燃料电池。该电池的负极反应式为:
(5)将0.2 mol D2C2投入到含有0.1 mol FeCl2的水溶液中恰好充分反应,反应的总化学方程式为:
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐1】已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有_______ 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为_________ ,E的基态电子排布式为________ ,E3+与E2+的稳定性大小为____________ 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为__________ ,电负性由小到大的顺序为_________ 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的σ键和π键的数目之比为__________ ;F、G对应的氢化物中键能大小为F—H键_________ G—H键。
(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为_________ ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为____________ 。
(5)由A、C、F可形成两种酸类化合物,用离子方程式说明它们的酸性强弱________ 。由A、C、F与钠四种元素按原子个数比为1∶3∶1∶1组成一种化合物,其水溶液显酸性,则该溶液中各种离子的浓度由大到小的顺序为________ ,向该溶液中滴入少量的氢氧化钡溶液时发生反应的离子方程式为___________ 。
(1)A、B、C形成的此化合物中存在的化学键的类型有
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的σ键和π键的数目之比为
(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为
(5)由A、C、F可形成两种酸类化合物,用离子方程式说明它们的酸性强弱
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】下表为元素周期表的一部分。请回答下列问题:
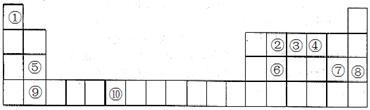
(1)上述元素中,属于s区的是___________ (填元素符号)。
(2)写出元素⑩的基态原子的电子排布式________________ 。
(3)元素第一电离能为⑤_______________ ⑨(填“大于”或“小于”)。
(4)元素③气态氢化物的中心原子有______________ 对弧对电子,其VSEPR模型为_____________ ;中心原子的杂化类型为_______________ ;该分子为_________________ 分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为___________________ 。
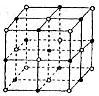
(5)元素⑦的钠盐晶胞结构如上图所示,每个Na+周围与之距离最近的Na+的个数为_____________ 。若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该钠盐的密度为________ (写出计算式)。

(1)上述元素中,属于s区的是
(2)写出元素⑩的基态原子的电子排布式
(3)元素第一电离能为⑤
(4)元素③气态氢化物的中心原子有

(5)元素⑦的钠盐晶胞结构如上图所示,每个Na+周围与之距离最近的Na+的个数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】(I)某原料经测定主要含有A、B、C、D四种原子序数依次增大的短周期元素,其相关信息如下:
请回答下列问题(用A、B、C、D、所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为__________________________________
(2)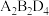 常用作除锈剂,该分子中B的杂化方式为
常用作除锈剂,该分子中B的杂化方式为_____ ;1 mol 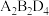 分子中含有σ键与π键的数目之比为
分子中含有σ键与π键的数目之比为_____ 。
(3)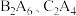 分子中均含有18个电子,它们的沸点相差较大,主要原因是
分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________
(Ⅱ)化学与生活密切相关。K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O (橙色)+CH3CH2OH
(橙色)+CH3CH2OH Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(4)基态Cr 原子的价电子排布图为__________________________________
(5)已知Cr3+等过渡元素水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为________________ 。
(6)ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有____________ (填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
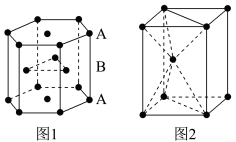
(7)锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。锌的堆积方式为_____________________ ,配位数为_______ 。
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
请回答下列问题(用A、B、C、D、所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为
(2)
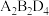 常用作除锈剂,该分子中B的杂化方式为
常用作除锈剂,该分子中B的杂化方式为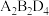 分子中含有σ键与π键的数目之比为
分子中含有σ键与π键的数目之比为(3)
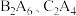 分子中均含有18个电子,它们的沸点相差较大,主要原因是
分子中均含有18个电子,它们的沸点相差较大,主要原因是(Ⅱ)化学与生活密切相关。K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O
 (橙色)+CH3CH2OH
(橙色)+CH3CH2OH Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)(4)基态Cr 原子的价电子排布图为
(5)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为
(6)ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
(7)锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。锌的堆积方式为

您最近一年使用:0次



