氮和氮的化合物与人类有密切关系。
(1)下列属于氮的固定的是_______ (填序号)。
①工业上N2和H2合成NH3
②N2和O2放电条件下生成NO
③NH3催化氧化生成NO
写出反应③的化学方程式_______ 。
(2)①治理NO污染通常是在氧化剂作用下,将NO氧化成溶解度高的NO2,然后用水或碱液吸收脱氮。下列物质可以用于氧化NO的是_______ (填序号)。
ANaCl溶液 B. K2Cr2O7溶液 C. Na2CO3溶液 D. KMnO4溶液
②NO也可用NaClO碱性溶液氧化并将其转化为硝酸盐化肥,写出该反应的离子方程式:_______ 。
③目前处理柴油车尾气中NOx和PM2.5等的方法之一,是用车用尿素[CO(NH2)2]溶液在选择性催化还原系统中将NOx无害化处理,写出该系统无害化处理NO的化学方程式:_______ 。
(3)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应,用Rh做催化剂时该反应的过程示意图如下:
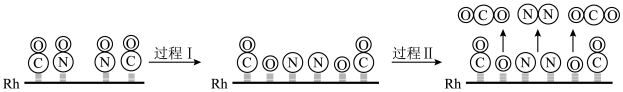
①过程I为_______ 过程(填“吸热”或“放热”)。该反应中氧化产物为_______ ,当生成1molN2时,转移电子_______ mol。
②已知过程I的焓变(lmolCO参加)为akJ/mol,过程II的焓变为bkJ/mol,则该反应的热化学方程式为_______ 。
(1)下列属于氮的固定的是
①工业上N2和H2合成NH3
②N2和O2放电条件下生成NO
③NH3催化氧化生成NO
写出反应③的化学方程式
(2)①治理NO污染通常是在氧化剂作用下,将NO氧化成溶解度高的NO2,然后用水或碱液吸收脱氮。下列物质可以用于氧化NO的是
ANaCl溶液 B. K2Cr2O7溶液 C. Na2CO3溶液 D. KMnO4溶液
②NO也可用NaClO碱性溶液氧化并将其转化为硝酸盐化肥,写出该反应的离子方程式:
③目前处理柴油车尾气中NOx和PM2.5等的方法之一,是用车用尿素[CO(NH2)2]溶液在选择性催化还原系统中将NOx无害化处理,写出该系统无害化处理NO的化学方程式:
(3)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应,用Rh做催化剂时该反应的过程示意图如下:

①过程I为
②已知过程I的焓变(lmolCO参加)为akJ/mol,过程II的焓变为bkJ/mol,则该反应的热化学方程式为
2022·四川泸州·一模 查看更多[2]
更新时间:2022/07/22 15:56:06
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)下列反应中都有水参加:
A.Cl2+ H2O +Na2SO3=2HCl + Na2SO4
B.3NO2 + H2O = 2HNO3 + NO↑
C.NaH +H2O = NaOH + H2↑
D.2H2O电解2H2↑+ O2↑
其中,水只是氧化剂的是_________ ,水既不是氧化剂又不是还原剂的是_________ ;
(2)在3BrF3+5H2O=9HF+HBrO3+O2↑+Br2反应中,若有5.4gH2O被氧化,则被还原的BrF3共______________ mol,其中被水还原的BrF3是_______________ mol。
A.Cl2+ H2O +Na2SO3=2HCl + Na2SO4
B.3NO2 + H2O = 2HNO3 + NO↑
C.NaH +H2O = NaOH + H2↑
D.2H2O电解2H2↑+ O2↑
其中,水只是氧化剂的是
(2)在3BrF3+5H2O=9HF+HBrO3+O2↑+Br2反应中,若有5.4gH2O被氧化,则被还原的BrF3共
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按照要求填空。
(1)工业上用氯气和硝酸铁在烧碱溶液中可以制备净水剂高铁酸钠(Na2FeO4),试补充完整化学反应方程式并配平:_____________
Fe(NO3)3+Cl2+NaOH→___________
(2)将mg铁粉与含有H2SO4的CuSO4溶液完全反应,铁粉全部溶解,并得到mg铜,则参加反应的H2SO4与CuSO4的物质的量之比为___________ 。
(3)一定条件下,下列物质可以通过化合反应制得的有(写序号)___________ 。
①小苏打②硫酸铝③氯化亚铁④磁性氧化铁⑤铜绿(碱式碳酸铜)⑥氢氧化铁
(4)现有镁铝合金10.2g,将其置于500mL4mol/L的盐酸中充分反应后无金属剩余,若向反应后的溶液中加入1000mL烧碱溶液,使得沉淀达到最大值,则加入的烧碱的物质的量浓度为___________ mol/L。
(5)某常见的氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得生成的氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物的化学式为___________ 。
(6)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成amol硝酸锌时,被还原的硝酸的物质的量为___________ mol。
(7)将一定量的锌与100mL18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成16.8升标况气体,将反应后的溶液稀释到1L,测得溶液中c(H+)=1mol/L,则气体中SO2为___________ mol。
(1)工业上用氯气和硝酸铁在烧碱溶液中可以制备净水剂高铁酸钠(Na2FeO4),试补充完整化学反应方程式并配平:
Fe(NO3)3+Cl2+NaOH→___________
(2)将mg铁粉与含有H2SO4的CuSO4溶液完全反应,铁粉全部溶解,并得到mg铜,则参加反应的H2SO4与CuSO4的物质的量之比为
(3)一定条件下,下列物质可以通过化合反应制得的有(写序号)
①小苏打②硫酸铝③氯化亚铁④磁性氧化铁⑤铜绿(碱式碳酸铜)⑥氢氧化铁
(4)现有镁铝合金10.2g,将其置于500mL4mol/L的盐酸中充分反应后无金属剩余,若向反应后的溶液中加入1000mL烧碱溶液,使得沉淀达到最大值,则加入的烧碱的物质的量浓度为
(5)某常见的氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得生成的氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物的化学式为
(6)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成amol硝酸锌时,被还原的硝酸的物质的量为
(7)将一定量的锌与100mL18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成16.8升标况气体,将反应后的溶液稀释到1L,测得溶液中c(H+)=1mol/L,则气体中SO2为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】Cl2通入70℃的NaOH水溶液中,发生氧化—还原反应,反应完成后,测得溶液中NaClO与NaClO3的物质的量之比为4∶1,则:
(1)配平溶液中所发生反应的化学方程式:____ Cl2+______ NaOH=____ NaCl+____ NaClO3+_____ NaClO+____ ____
(2)反应中的氧化产物为_________________ 。
(3)已知生成0.1mol NaClO,反应中转移的电子总数是__________ mol,若溶液的体积正好为100mL,则溶液中NaCl的物质的量浓度为________ mol/L。
(1)配平溶液中所发生反应的化学方程式:
(2)反应中的氧化产物为
(3)已知生成0.1mol NaClO,反应中转移的电子总数是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
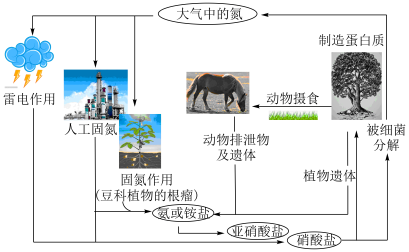
【推荐1】自然界的氮循环如下图所示。
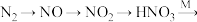 硝酸盐[如
硝酸盐[如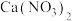 ]
]
写出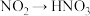 的化学方程式
的化学方程式______ 。
(2)人工固氮:工业上以氮气和氢气为原料,在高温、高压和有催化剂存在的条件下合成氨,该反应的化学方程式为______ 。由氨气可生产铵态氮肥,实验小组为检验某白色固体是否为铵态氮肥,取少量固体于试管中,加蒸馏水溶解,______ ,证明固体含
(3)在微生物作用下实现 的转化,称为硝化过程。在一定条件下,
的转化,称为硝化过程。在一定条件下, 被
被 氧化成
氧化成 ,参加反应的
,参加反应的 和
和 的物质的量之比为
的物质的量之比为______ 。
(4) (选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如下:
(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如下: 和
和 ,催化反应器中用
,催化反应器中用 还原
还原 的化学方程式:
的化学方程式:______ 。
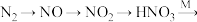 硝酸盐[如
硝酸盐[如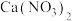 ]
]写出
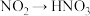 的化学方程式
的化学方程式(2)人工固氮:工业上以氮气和氢气为原料,在高温、高压和有催化剂存在的条件下合成氨,该反应的化学方程式为

(3)在微生物作用下实现
 的转化,称为硝化过程。在一定条件下,
的转化,称为硝化过程。在一定条件下, 被
被 氧化成
氧化成 ,参加反应的
,参加反应的 和
和 的物质的量之比为
的物质的量之比为(4)
 (选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如下:
(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如下: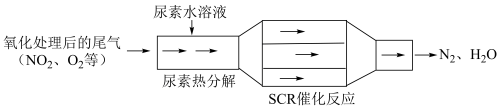
 和
和 ,催化反应器中用
,催化反应器中用 还原
还原 的化学方程式:
的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氮的氧化物是主要的大气污染物,必须脱除才能排放。
(1)臭氧与空气中的氮氧化物和_______ (填字母)在紫外线照射下产生光化学烟雾。
a.二氧化硫 b.碳氢化合物 c.二氧化碳
(2)汽车排气管内的催化剂能将CO和 转化为无害气体,发生的反应方程式为
转化为无害气体,发生的反应方程式为_______ 。
(3)工业上在催化剂作用下用 还原废气中
还原废气中 生成
生成 和
和 达到脱除目的,但当温度高于400℃时,
达到脱除目的,但当温度高于400℃时, 脱除率下降,原因可能是
脱除率下降,原因可能是_______ 。
(4)工业上氮的氧化物通常是用碱性溶液吸收。
①用 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(一种为
,生成等物质的量的两种钠盐(一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为_______ 。
②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如题图所示,曲线II表示NO的物质的量
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如题图所示,曲线II表示NO的物质的量_______ (填:“大于”、“小于”、“等于”) 物质的量:当NaOH溶液浓度高于
物质的量:当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是_______ 。
(1)臭氧与空气中的氮氧化物和
a.二氧化硫 b.碳氢化合物 c.二氧化碳
(2)汽车排气管内的催化剂能将CO和
 转化为无害气体,发生的反应方程式为
转化为无害气体,发生的反应方程式为(3)工业上在催化剂作用下用
 还原废气中
还原废气中 生成
生成 和
和 达到脱除目的,但当温度高于400℃时,
达到脱除目的,但当温度高于400℃时, 脱除率下降,原因可能是
脱除率下降,原因可能是(4)工业上氮的氧化物通常是用碱性溶液吸收。
①用
 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(一种为
,生成等物质的量的两种钠盐(一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收
 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如题图所示,曲线II表示NO的物质的量
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如题图所示,曲线II表示NO的物质的量 物质的量:当NaOH溶液浓度高于
物质的量:当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为____ mol·L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____ 。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____ 。
下列反应中的氨与氨氧化法中的氨作用相同的是____ 。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O和NO+NO2+2OH-=____ +H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为____ 。
②Cu与Cu2O的物质的量之比为____ 。
③HNO3的物质的量浓度为____ mol·L-1。
(4)有H2SO4和HNO3的混合溶液20mL,加入0.25mol•L-1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为____ mol·L-1,HNO3的物质的量浓度为____ mol·L-1。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为
下列反应中的氨与氨氧化法中的氨作用相同的是
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O和NO+NO2+2OH-=
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为
②Cu与Cu2O的物质的量之比为
③HNO3的物质的量浓度为
(4)有H2SO4和HNO3的混合溶液20mL,加入0.25mol•L-1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为
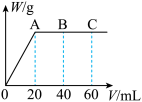
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
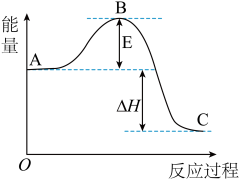
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示______________ 、________________ ,E的大小对该反应的反应热________ (填“有”或“无”)影响;
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________ ,理由是________________________________________________________________________________ ;
(3)图中ΔH=________ kJ·mol-1;
(4)已知单质硫的燃烧热ΔH=-296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)的ΔH________ (写出计算过程)。

已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
(3)图中ΔH=
(4)已知单质硫的燃烧热ΔH=-296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)的ΔH
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)在101 和298K下,
和298K下, 异构化反应过程的能量变化如图所示:
异构化反应过程的能量变化如图所示:
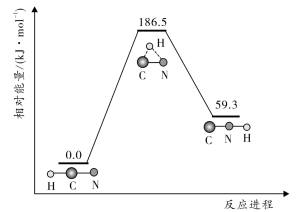
该异构化反应的
_______  ,使用催化剂
,使用催化剂_______ (选填“能”“不能”)改变该反应的 。
。
(2)肼( )又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知
)又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知 键、
键、 键的键能分别为391
键的键能分别为391 、497
、497 ,
, 与
与 反应的能量变化如图所示:
反应的能量变化如图所示:
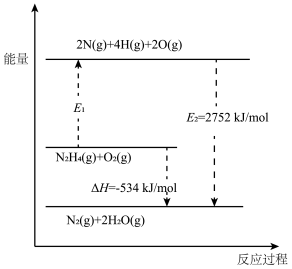
 中
中 键的键能为
键的键能为_______  。请写出一定条件下,
。请写出一定条件下, 与
与 反应的热化学方程式为
反应的热化学方程式为_______ 。
(1)在101
 和298K下,
和298K下, 异构化反应过程的能量变化如图所示:
异构化反应过程的能量变化如图所示:
该异构化反应的

 ,使用催化剂
,使用催化剂 。
。(2)肼(
 )又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知
)又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知 键、
键、 键的键能分别为391
键的键能分别为391 、497
、497 ,
, 与
与 反应的能量变化如图所示:
反应的能量变化如图所示:
 中
中 键的键能为
键的键能为 。请写出一定条件下,
。请写出一定条件下, 与
与 反应的热化学方程式为
反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】研究氮的氧化物\碳的氧化物等大气污染物的处理有重要意义。
(1)汽车尾气中NO生成过程中的能量变化如图所示。

生成1 mol NO(g)_______ ( 填“吸收"或“放出")_______ kJ 的热量。
(2)汽车排气管内安装的催化转化器可使尾气的主要污染物(NO和CO)转化为无毒的大气循环物质。一定温度下,在恒容密闭容器中发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)。下列能判断该反应达到化学平衡状态的是_______(填序号)。
2CO2(g)+N2(g)。下列能判断该反应达到化学平衡状态的是_______(填序号)。
(3)用CO2和H2合成甲醇有利于减少碳排放,其反应原理为CO2(g) +3H2(g)=CH3OH(g) +H2O(g)。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入1 mol CO2和3 mol H2,甲在T1乙在T2温度下发生上述反应,反应过程中n(CH3OH)随时间(t)的变化见下表:
①T1_______ T2(填“>”“<”或“=”)。
②甲容器中,0 ~6 min内的平均反应速率v(H2)=_______ 。
③甲容器中CO2的平衡转化率为_______
(4)一种室温下“可呼吸”的Na-CO2电池装置如图所示,电池的总反应为3CO2 +4Na=2Na2CO3+C。

①电极a为_______ 极(填“正”或“负")。
②电极b发生的电极反应为_______ 。
(1)汽车尾气中NO生成过程中的能量变化如图所示。

生成1 mol NO(g)
(2)汽车排气管内安装的催化转化器可使尾气的主要污染物(NO和CO)转化为无毒的大气循环物质。一定温度下,在恒容密闭容器中发生反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g)。下列能判断该反应达到化学平衡状态的是_______(填序号)。
2CO2(g)+N2(g)。下列能判断该反应达到化学平衡状态的是_______(填序号)。| A.反应速率v(NO)=v(CO) | B.混合气体中NO的物质的量分数保持不变 |
| C.混合气体的密度不再改变 | D.混合气体的压强不再改变 |
| t/min | 0 | 3 | 6 | 12 | 24 | 36 |
| n甲(CH3OH)/mol | 0 | 0.36 | 0.60 | 0.82 | 0.80 | 0.80 |
| n乙(CH3OH)/mol | 0 | 0.30 | 0.50 | 0.68 | 0.85 | 0.85 |
②甲容器中,0 ~6 min内的平均反应速率v(H2)=
③甲容器中CO2的平衡转化率为
(4)一种室温下“可呼吸”的Na-CO2电池装置如图所示,电池的总反应为3CO2 +4Na=2Na2CO3+C。

①电极a为
②电极b发生的电极反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)我国四大发明之一的火药是由硫磺粉、硝酸钾、木炭粉按一定比例混合而成的,爆炸时的反应为 ,在该反应的生成物中,属于非电解质的物质是
,在该反应的生成物中,属于非电解质的物质是___________ (填化学式,下同),属于电解质的物质是___________ ,还原产物是___________ ;当3.2gS参与反应时,生成的气体质量为___________ g。
(2) 是高效、绿色的水处理剂,其原理如图所示。
是高效、绿色的水处理剂,其原理如图所示。
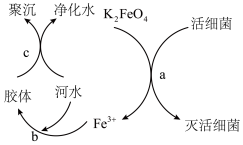
①从物质的类别来看,高铁酸钾( )属于
)属于___________ (“酸”“碱”“盐”或“氧化物”)。
②从元素的化合价角度来看, 中铁的化合价为
中铁的化合价为___________ 价,则过程a中 体现了
体现了___________ (填“氧化”或“还原”)性,活细菌发生了___________ (填“氧化”或“还原”)反应,该过程中消耗2个 时,转移的电子数目为
时,转移的电子数目为___________ 。
(3)纯碱和小苏打是日常家庭厨房中的常见用品,从物质的类别来看,均属于盐类。若取适量小苏打加水溶解,配制成溶液,再向其中加入少量澄清石灰水,发生反应的离子方程式是___________ 。
(1)我国四大发明之一的火药是由硫磺粉、硝酸钾、木炭粉按一定比例混合而成的,爆炸时的反应为
 ,在该反应的生成物中,属于非电解质的物质是
,在该反应的生成物中,属于非电解质的物质是(2)
 是高效、绿色的水处理剂,其原理如图所示。
是高效、绿色的水处理剂,其原理如图所示。
①从物质的类别来看,高铁酸钾(
 )属于
)属于②从元素的化合价角度来看,
 中铁的化合价为
中铁的化合价为 体现了
体现了 时,转移的电子数目为
时,转移的电子数目为(3)纯碱和小苏打是日常家庭厨房中的常见用品,从物质的类别来看,均属于盐类。若取适量小苏打加水溶解,配制成溶液,再向其中加入少量澄清石灰水,发生反应的离子方程式是
您最近一年使用:0次
【推荐2】已知在碱性条件下,氯气会发生自身氧化—还原反应,某条件下,反应体系的物质为:KClO3、Cl2、KCl、KOH、H2O。
(1)在该反应中KClO3是_________ (填“氧化剂”、“还原剂”或“氧化产物”、“还原产物”)。
(2)请把反应物的化学式及配平,并标出电子转移的方向和数目:
3Cl2 + 6KOH→__________ +___________ 。
(3)若反应中有1 mol电子发生转移,则参加反应的KOH 是___________ 。
(4)实验室利用6HCl + KClO3→KCl + 3H2O + 3Cl2↑ 可制取Cl2。根据该反应可推知__________ 。
A.KCl是还原产物 B.盐酸在反应中仅仅是还原剂
C.反应中转移的电子数为6 e D.从方程式可知还原性:HCl>Cl2
(1)在该反应中KClO3是
(2)请把反应物的化学式及配平,并标出电子转移的方向和数目:
3Cl2 + 6KOH→
(3)若反应中有1 mol电子发生转移,则参加反应的KOH 是
(4)实验室利用6HCl + KClO3→KCl + 3H2O + 3Cl2↑ 可制取Cl2。根据该反应可推知
A.KCl是还原产物 B.盐酸在反应中仅仅是还原剂
C.反应中转移的电子数为6 e D.从方程式可知还原性:HCl>Cl2
您最近一年使用:0次

 +10Cl-+16H+=2Mn2++5Cl2↑+8H2O反应,请回答下列问题:
+10Cl-+16H+=2Mn2++5Cl2↑+8H2O反应,请回答下列问题:

