醋酸是一种常见的弱酸,在0.1 mol·L-1醋酸中加入下列物质,分析醋酸的电离平衡移动方向及平衡时物质的浓度变化:
(1)写出醋酸的电离方程式:_______ 。
(2)加入醋酸钠固体,电离平衡_______ (填“正向”“逆向”或“不”)移动,pH_______ (填“增大”“减 小”或“不变”)。
(3)加入碳酸钙固体,电离平衡_______ (填“正向”“逆向”或“不”)移动。
(4)加入大量的水,c(OH-)_______ (填“增 大”“减小”或“不变”,下同),导电能力_______ 。
(5)升高温度,醋酸的电离平衡_______ (填“正向”“逆向”或“不”)移动。
(1)写出醋酸的电离方程式:
(2)加入醋酸钠固体,电离平衡
(3)加入碳酸钙固体,电离平衡
(4)加入大量的水,c(OH-)
(5)升高温度,醋酸的电离平衡
21-22高二上·广西玉林·期中 查看更多[4]
新疆维吾尔自治区皮山县高级中学2023-2024学年高二上学期1月期末化学试题安徽省舒城晓天中学2022-2023学年高二上学期期中考试化学试题(已下线)3.1.1 电离平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)广西玉林市市直六所普通高中2021-2022学年高二上学期期中考试理科综合化学试题
更新时间:2022-07-24 18:31:40
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为______________________________ 。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)______________ (填“>”“<”或“=”)c(CH3COO-)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________________________________ 。
(4) 25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-) =__________________ 。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为
(4) 25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-) =
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】常温下有浓度均为0.1mol/L的四种溶液:①HCl;②CH3COOH;③NaOH;④Na2CO3。
(1)这四种溶液中水的电离程度由大到小的顺序是___ (用序号填写)。
(2)等体积混合②和③的溶液中离子浓度的大小顺序是___ 。
(3)常温下,0.1 mol/L的CH3COOH溶液pH=3,则CH3COOH溶液的电离平衡常数Ka=___ 。
(4)用离子方程式表示④的水溶液呈碱性的主要原因:___ 。
(5)取10 mL溶液①,加水稀释到1000 mL,则该溶液中由水电离出的c(H+)约为___ 。
(1)这四种溶液中水的电离程度由大到小的顺序是
(2)等体积混合②和③的溶液中离子浓度的大小顺序是
(3)常温下,0.1 mol/L的CH3COOH溶液pH=3,则CH3COOH溶液的电离平衡常数Ka=
(4)用离子方程式表示④的水溶液呈碱性的主要原因:
(5)取10 mL溶液①,加水稀释到1000 mL,则该溶液中由水电离出的c(H+)约为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】常温下,将某一元酸HB和KOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸___ 。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol∙L−1___ ?(填“是”或“否”)。混合溶液中离子浓度c(B-)与c(K+)的大小关系是___ 。
A.前者大 B.后者大 C.二者相等 D.无法判断
| 实验编号 | HB物质的量浓度(mol∙L−1) | KOH物质的量浓度(mol∙L−1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol∙L−1
A.前者大 B.后者大 C.二者相等 D.无法判断
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】25℃时,50mL0.1mol/L醋酸中存在下述平衡:____________________________
若分别作如下改变,对上述平衡有何影响?
⑴加入少量冰醋酸,平衡将_________ ,溶液中c(H+)将________ (增大、减小、不变);
⑵加入一定量蒸馏水,平衡将_________ ,溶液中c(H+)将________ (增大、减小、不变)
⑶加入少量0.1mol/L盐酸,平衡将_________ ,溶液中c(H+)将________ (增大、减小、不变)
⑷加入20mL0.10mol/LNaCl,平衡将_________ ,溶液中c(H+)将________ (增大、减小、不变)
若分别作如下改变,对上述平衡有何影响?
⑴加入少量冰醋酸,平衡将
⑵加入一定量蒸馏水,平衡将
⑶加入少量0.1mol/L盐酸,平衡将
⑷加入20mL0.10mol/LNaCl,平衡将
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,请填写下列空白。
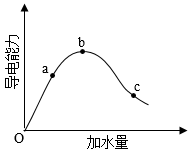
(1)加水前导电能力约为零的原因是___________ 。
(2)a、b、c三点对应的溶液中, 由小到大的顺序是
由小到大的顺序是___________ 。
(3)a、b、c三点对应的溶液中, 电离程度最大的是
电离程度最大的是___________ 。
(4)若使b点对应的溶液中 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是___________ (填序号)。
①加入
②加入NaOH固体
③加入浓硫酸
④加入 固体
固体

(1)加水前导电能力约为零的原因是
(2)a、b、c三点对应的溶液中,
 由小到大的顺序是
由小到大的顺序是(3)a、b、c三点对应的溶液中,
 电离程度最大的是
电离程度最大的是(4)若使b点对应的溶液中
 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是①加入

②加入NaOH固体
③加入浓硫酸
④加入
 固体
固体
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】按照要求填空:
(1)在氨水中存在下列电离平衡:NH3·H2O
 +OH-,下列情况能引起电离平衡向正向移动的有
+OH-,下列情况能引起电离平衡向正向移动的有____________ ;
①加NH4Cl固体 ②加NaOH溶液 ③加CH3COOH溶液 ④加水
(2)常温下,pH=10的NaOH 溶液中,由水电离的OH-浓度为___________ mol/L;
(3)在室温下,0.1mol/L NH4Cl 溶液①呈_________ 性(填“酸”“碱”或“中”),其原因是______________________ (用离子方程式表示)
(4)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸的物质的量浓度相同时,c(H+)由大到小的顺序是________ ;(用序号表示,下同)
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是____________ 。
(1)在氨水中存在下列电离平衡:NH3·H2O

 +OH-,下列情况能引起电离平衡向正向移动的有
+OH-,下列情况能引起电离平衡向正向移动的有①加NH4Cl固体 ②加NaOH溶液 ③加CH3COOH溶液 ④加水
(2)常温下,pH=10的NaOH 溶液中,由水电离的OH-浓度为
(3)在室温下,0.1mol/L NH4Cl 溶液①呈
(4)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸的物质的量浓度相同时,c(H+)由大到小的顺序是
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是
您最近一年使用:0次



