常温下,将某一元酸HB和KOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸___ 。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol∙L−1___ ?(填“是”或“否”)。混合溶液中离子浓度c(B-)与c(K+)的大小关系是___ 。
A.前者大 B.后者大 C.二者相等 D.无法判断
| 实验编号 | HB物质的量浓度(mol∙L−1) | KOH物质的量浓度(mol∙L−1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol∙L−1
A.前者大 B.后者大 C.二者相等 D.无法判断
更新时间:2020-12-30 08:27:04
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】CH3COONa溶液是常见的强碱弱酸盐溶液,可由醋酸和NaOH溶液反应得到。
(1)用离子方程式解释CH3COONa水溶液呈碱性的原因___________ 。
(2)用0.1000mol/L NaOH分别滴定25.00mL 0.1000mol/L盐酸和25.00mL 0.1000mol/L醋酸,滴定过程中pH变化曲线如下图所示。
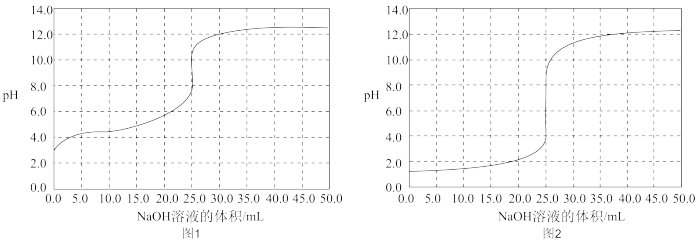
①在上述滴定过程中,不需要 使用的玻璃仪器是___________ (填序号)。
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据可判断滴定盐酸的pH变化曲线为图2,判断的理由如下(答出2点):
ⅰ.起始未滴加NaOH溶液时,___________ 。
ⅱ.___________ 。
③滴定CH3COOH溶液的过程中,当滴加12.50mL NaOH溶液时,溶液中各离子浓度由大到小的顺序是___________ (用符号“c”及“>”表示)。
(3)向0.1mol/LCH3COONa溶液中逐滴加入0.1mol/L盐酸至恰好反应。反应过程中,你认为CH3COONa的水解平衡向___________ (填“左”或“右”)移动,分析的过程:当滴入稀盐酸后,___________ 。
(1)用离子方程式解释CH3COONa水溶液呈碱性的原因
(2)用0.1000mol/L NaOH分别滴定25.00mL 0.1000mol/L盐酸和25.00mL 0.1000mol/L醋酸,滴定过程中pH变化曲线如下图所示。

①在上述滴定过程中,
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据可判断滴定盐酸的pH变化曲线为图2,判断的理由如下(答出2点):
ⅰ.起始未滴加NaOH溶液时,
ⅱ.
③滴定CH3COOH溶液的过程中,当滴加12.50mL NaOH溶液时,溶液中各离子浓度由大到小的顺序是
(3)向0.1mol/LCH3COONa溶液中逐滴加入0.1mol/L盐酸至恰好反应。反应过程中,你认为CH3COONa的水解平衡向
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】已知:I2+2 =
= +2I-,某学习小组用“间接碘量法”测定含有CuCl2.H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000mol/LNa2S2O3标准溶液20.00mL。可选用
+2I-,某学习小组用“间接碘量法”测定含有CuCl2.H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000mol/LNa2S2O3标准溶液20.00mL。可选用_______ 作滴定指示剂,滴定终点的现象是_______ 。
 =
= +2I-,某学习小组用“间接碘量法”测定含有CuCl2.H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000mol/LNa2S2O3标准溶液20.00mL。可选用
+2I-,某学习小组用“间接碘量法”测定含有CuCl2.H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000mol/LNa2S2O3标准溶液20.00mL。可选用
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定。滴定过程中pH随滴加溶液的体积变化关系如图所示。回答下列问题:
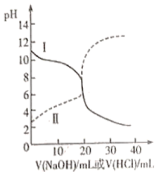
(1)表示氨水滴定过程中pH变化情况的是曲线___________ (填“Ⅰ”或“Ⅱ”)。由图中信息可知,25℃时0.1mol/L醋酸溶液的电离程度___________ (填“大于”“小于”或“等于”,下同)10%。当横坐标为20mL时,曲线Ⅰ对应的纵坐标应___________ 7。
(2)滴加溶液到10mL时,曲线Ⅱ所表示的溶液中c(H+)-c(OH-)___________ (结果中不能包含阳离子浓度)。

(1)表示氨水滴定过程中pH变化情况的是曲线
(2)滴加溶液到10mL时,曲线Ⅱ所表示的溶液中c(H+)-c(OH-)
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________ 。
(2)25℃时,NH3·H2O电离平衡常数Kb=1.8×10-5,物质的量浓度为0.10mol/L的氨水中,c(OH-)为___________ (列出算式即可)。
(3)将③和④按体积比1:1混合后,混合液中各离子浓度由大到小的顺序是___________ 。
(4)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”)___________ 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=___________ 。
(5)25℃时,pH与体积均相同的醋酸溶液A与硫酸B分别与足量镁条充分反应,下列说法不正确 的是 ___________ (填字母序号)。
a.开始反应时的速率:A < B
b.放出等量氢气所需要的时间A=B
c.生成氢气的总体积:A > B
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(2)25℃时,NH3·H2O电离平衡常数Kb=1.8×10-5,物质的量浓度为0.10mol/L的氨水中,c(OH-)为
(3)将③和④按体积比1:1混合后,混合液中各离子浓度由大到小的顺序是
(4)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”)
(5)25℃时,pH与体积均相同的醋酸溶液A与硫酸B分别与足量镁条充分反应,下列说法
a.开始反应时的速率:A < B
b.放出等量氢气所需要的时间A=B
c.生成氢气的总体积:A > B
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】常温下,有0.1 mol∙L−1的四种溶液:
①NaOH ②Na2CO3 ③NaHSO4 ④NH4Cl
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:___________ 。
(2)溶液①中由水电离出的氢氧根浓度为___________ 。
(3)溶液①、③等体积混合后,溶液中c(H+)___________ c(OH-)(填“>”、“<”或“=”)。
(4)溶液④中各离子浓度从大到小的顺序是___________ 。
(5)热的②溶液可以去油污,原因是___________ (用化学用语解释)
①NaOH ②Na2CO3 ③NaHSO4 ④NH4Cl
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:
(2)溶液①中由水电离出的氢氧根浓度为
(3)溶液①、③等体积混合后,溶液中c(H+)
(4)溶液④中各离子浓度从大到小的顺序是
(5)热的②溶液可以去油污,原因是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】现有以下物质:①铁②稀硝酸 ③硫酸氢钠④氢硫酸 ⑤冰醋酸⑥蔗糖溶液⑦三氧化硫气体⑧硫酸钡晶体。回答下列问题(用相应物质序号填写):
(1)属于弱电解质的有__________________________ 。
(2)写出⑧的溶解平衡的离子方程式__________________________ 。
(3)写出③熔融状态下的电离方程式__________________________ 。
(4)写出④在水中的电离方程式__________________________ 。
(1)属于弱电解质的有
(2)写出⑧的溶解平衡的离子方程式
(3)写出③熔融状态下的电离方程式
(4)写出④在水中的电离方程式
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】(1)已知:25℃,101kP下,CO的燃烧热为283kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
写出CO(g)和H2O(g)作用生成CO2和H2的热化学方程式:_______ 。
(2)CuCl2溶液显酸性,原因是_______ (用离子方程式回答);某温度下的CuCl2饱和溶液,升高温度,溶液中Cu2+浓度将_______ ,Cl-浓度将_______ ;若饱和溶液降温,析出固体的化学式为_______ ;若将溶液蒸干、灼烧得到固体的化学式为_______ 。
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
写出CO(g)和H2O(g)作用生成CO2和H2的热化学方程式:
(2)CuCl2溶液显酸性,原因是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】电离常数是研究弱电解质的重要工具,25℃时一些酸的电离常数如下表所示。
请回答:
(1)浓度相同的阴离子在水溶液中结合H+的能力: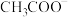
_______  (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
(2)25℃时,pH相同的NaClO和 两种溶液的浓度大小:
两种溶液的浓度大小: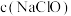
_______  (填“<”、“>”或“=”)。。
(填“<”、“>”或“=”)。。
(3)硫酸在水溶液中是强酸,在冰醋酸中部分电离,写出硫酸在冰醋酸中的电离方程式_______ 。
(4)向NaClO溶液中通入少量的 气体,写出发生反应的离子方程式
气体,写出发生反应的离子方程式_______ 。
(5)25℃时, 的水解平衡常数
的水解平衡常数
_______ (结果保留2位有效数字)。
| 化学式 |  |  | HClO |
电离常数( ) ) | 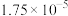 | 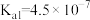 、 、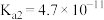 |  |
(1)浓度相同的阴离子在水溶液中结合H+的能力:
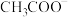
 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。(2)25℃时,pH相同的NaClO和
 两种溶液的浓度大小:
两种溶液的浓度大小: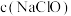
 (填“<”、“>”或“=”)。。
(填“<”、“>”或“=”)。。(3)硫酸在水溶液中是强酸,在冰醋酸中部分电离,写出硫酸在冰醋酸中的电离方程式
(4)向NaClO溶液中通入少量的
 气体,写出发生反应的离子方程式
气体,写出发生反应的离子方程式(5)25℃时,
 的水解平衡常数
的水解平衡常数
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:_____ 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,该溶液可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____ 。
(3)吸收液吸收SO2的过程中,pH随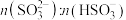 变化关系如下表:
变化关系如下表:
①上表判断 溶液显
溶液显_____ 性,用化学平衡原理解释:_____ 。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):_____ 。
a.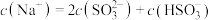
b.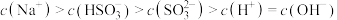
c.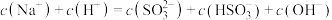
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,该溶液可由NaOH溶液吸收SO2制得,该反应的离子方程式是
(3)吸收液吸收SO2的过程中,pH随
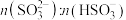 变化关系如下表:
变化关系如下表: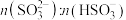 | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
 溶液显
溶液显②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.
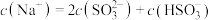
b.
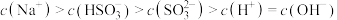
c.
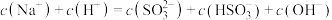
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是____________________ ;向其中加入少量KOH溶液时,发生反应的离子方程式是____________________ 。
(2)现将 HA溶液和
HA溶液和 NaOH溶液等体积混合,得到缓冲溶液。
NaOH溶液等体积混合,得到缓冲溶液。
①若HA为 ,该溶液显酸性,则溶液中
,该溶液显酸性,则溶液中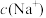
________ 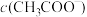 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
②若HA为 ,该溶液显碱性,溶液中所有的离子按浓度由大到小排列的顺序是
,该溶液显碱性,溶液中所有的离子按浓度由大到小排列的顺序是_______________ 。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
(2)现将
 HA溶液和
HA溶液和 NaOH溶液等体积混合,得到缓冲溶液。
NaOH溶液等体积混合,得到缓冲溶液。①若HA为
 ,该溶液显酸性,则溶液中
,该溶液显酸性,则溶液中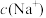
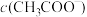 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。②若HA为
 ,该溶液显碱性,溶液中所有的离子按浓度由大到小排列的顺序是
,该溶液显碱性,溶液中所有的离子按浓度由大到小排列的顺序是
您最近一年使用:0次



