CH3COONa溶液是常见的强碱弱酸盐溶液,可由醋酸和NaOH溶液反应得到。
(1)用离子方程式解释CH3COONa水溶液呈碱性的原因___________ 。
(2)用0.1000mol/L NaOH分别滴定25.00mL 0.1000mol/L盐酸和25.00mL 0.1000mol/L醋酸,滴定过程中pH变化曲线如下图所示。
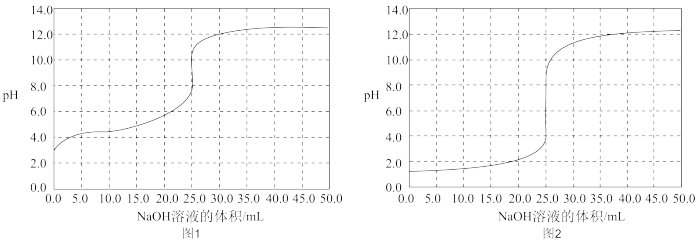
①在上述滴定过程中,不需要 使用的玻璃仪器是___________ (填序号)。
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据可判断滴定盐酸的pH变化曲线为图2,判断的理由如下(答出2点):
ⅰ.起始未滴加NaOH溶液时,___________ 。
ⅱ.___________ 。
③滴定CH3COOH溶液的过程中,当滴加12.50mL NaOH溶液时,溶液中各离子浓度由大到小的顺序是___________ (用符号“c”及“>”表示)。
(3)向0.1mol/LCH3COONa溶液中逐滴加入0.1mol/L盐酸至恰好反应。反应过程中,你认为CH3COONa的水解平衡向___________ (填“左”或“右”)移动,分析的过程:当滴入稀盐酸后,___________ 。
(1)用离子方程式解释CH3COONa水溶液呈碱性的原因
(2)用0.1000mol/L NaOH分别滴定25.00mL 0.1000mol/L盐酸和25.00mL 0.1000mol/L醋酸,滴定过程中pH变化曲线如下图所示。

①在上述滴定过程中,
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据可判断滴定盐酸的pH变化曲线为图2,判断的理由如下(答出2点):
ⅰ.起始未滴加NaOH溶液时,
ⅱ.
③滴定CH3COOH溶液的过程中,当滴加12.50mL NaOH溶液时,溶液中各离子浓度由大到小的顺序是
(3)向0.1mol/LCH3COONa溶液中逐滴加入0.1mol/L盐酸至恰好反应。反应过程中,你认为CH3COONa的水解平衡向
更新时间:2021-11-12 10:14:33
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。成品中S2−的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取25.00mL0.1000mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000mol·L−1Na2S2O3溶液滴定,反应式为I2+2 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为_______ 。
 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】二氧化氯(ClO2)是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和还原法。
(1)过硫酸盐氧化法:用原料亚氯酸钠(NaClO2)和过硫酸钠(Na2S2O8)直接反应,操作简单,同时可得到副产品Na2SO4。
制备时发生反应的离子方程式为___________ 。
(2)盐酸还原法:此法制得的二氧化氯消毒液中常含有ClO2和Cl2两种主要成分。为测定某二氧化氯消毒液中ClO2的浓度,进行如下实验:
量取5.00mL二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00mL,再向其中加入过量KI溶液,充分振荡;用0.10mol/LNa2S2O3标准溶液滴定至浅黄色后,加入指示剂,继续滴定至终点,消耗Na2S2O3标准溶液5.50mL;加入稀H2SO4调节溶液pH=3,再用0.10mol/LNa2S2O3标准溶液滴定,滴至浅黄色时加入指示剂,继续滴定至终点,第二次滴定消耗Na2S2O3溶液20.00mL。
已知:2ClO2+2KI=2KClO2+I2
KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O
2Na2S2O3+I2=Na2S4O6+2NaI
计算该二氧化氯消毒液中ClO2的物质的量浓度___________ 。(写出计算过程)
(1)过硫酸盐氧化法:用原料亚氯酸钠(NaClO2)和过硫酸钠(Na2S2O8)直接反应,操作简单,同时可得到副产品Na2SO4。
制备时发生反应的离子方程式为
(2)盐酸还原法:此法制得的二氧化氯消毒液中常含有ClO2和Cl2两种主要成分。为测定某二氧化氯消毒液中ClO2的浓度,进行如下实验:
量取5.00mL二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00mL,再向其中加入过量KI溶液,充分振荡;用0.10mol/LNa2S2O3标准溶液滴定至浅黄色后,加入指示剂,继续滴定至终点,消耗Na2S2O3标准溶液5.50mL;加入稀H2SO4调节溶液pH=3,再用0.10mol/LNa2S2O3标准溶液滴定,滴至浅黄色时加入指示剂,继续滴定至终点,第二次滴定消耗Na2S2O3溶液20.00mL。
已知:2ClO2+2KI=2KClO2+I2
KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O
2Na2S2O3+I2=Na2S4O6+2NaI
计算该二氧化氯消毒液中ClO2的物质的量浓度
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】测定溶液中的钙离子浓度的基本操作为:向溶液中加入(NH4)2C2O4将钙离子转化为CaC2O4沉淀,滤出沉淀,将沉淀溶于硫酸中,生成H2C2O4和CaSO4稀溶液。然后加入KMnO4标准溶液,将H2C2O4完全氧化。再用 (NH4)2Fe(SO4)2 溶液滴定过量的KMnO4,现取20.00mL某溶液进行上述处理。加入0.1000mol/LKMnO4标准溶液12.00mL,消耗0.2000mol/L的(NH4)2Fe(SO4)2溶液20.00mL。
(1)写出KMnO4与H2C2O4反应的离子方程式___________ 。
(2)求溶液中钙离子的浓度___________ 。
(1)写出KMnO4与H2C2O4反应的离子方程式
(2)求溶液中钙离子的浓度
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定。滴定过程中pH随滴加溶液的体积变化关系如图所示。回答下列问题:
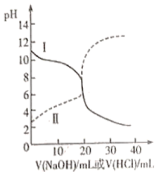
(1)表示氨水滴定过程中pH变化情况的是曲线___________ (填“Ⅰ”或“Ⅱ”)。由图中信息可知,25℃时0.1mol/L醋酸溶液的电离程度___________ (填“大于”“小于”或“等于”,下同)10%。当横坐标为20mL时,曲线Ⅰ对应的纵坐标应___________ 7。
(2)滴加溶液到10mL时,曲线Ⅱ所表示的溶液中c(H+)-c(OH-)___________ (结果中不能包含阳离子浓度)。

(1)表示氨水滴定过程中pH变化情况的是曲线
(2)滴加溶液到10mL时,曲线Ⅱ所表示的溶液中c(H+)-c(OH-)
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】测定产品Li2S的纯度取产品a g于锥形瓶中,加入V1 mL c1 mol·L-1的硫酸(足量),充分反应后排尽产生的气体,滴入2滴酚酞,用c2 mol·L-1的NaOH标准溶液进行滴定,达到滴定终点时,消耗NaOH标准溶液的体积为V2 mL
(1)达到滴定终点的现象是_______________________________________
(2)产品Li2S的质量分数为________ (用代数式表示)
(1)达到滴定终点的现象是
(2)产品Li2S的质量分数为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】描述弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)
表1
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是________ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________ (填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________ (选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是_____________________________ 。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH >7,该溶液中离子浓度从大到小的排列为________________________ 。
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表1
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH >7,该溶液中离子浓度从大到小的排列为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】请根据所学知识回答:
(1)CH3COONa溶液中各种离子的浓度由大到小顺序为_______ 。
(2)请分析氯化铵溶液显酸性的原因_______ 。
(3)实验室中配制FeCl3溶液时常加入_______ 溶液以抑制其水解。
(4)氯化银在水中存在沉淀溶解平衡:AgCl(s) Ag++Cl‒。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1 mol·L‒1盐酸溶液中,充分搅拌后,相同温度下银离子浓度的大小关系是
Ag++Cl‒。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1 mol·L‒1盐酸溶液中,充分搅拌后,相同温度下银离子浓度的大小关系是_______ (填写序号)。
(1)CH3COONa溶液中各种离子的浓度由大到小顺序为
(2)请分析氯化铵溶液显酸性的原因
(3)实验室中配制FeCl3溶液时常加入
(4)氯化银在水中存在沉淀溶解平衡:AgCl(s)
 Ag++Cl‒。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1 mol·L‒1盐酸溶液中,充分搅拌后,相同温度下银离子浓度的大小关系是
Ag++Cl‒。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1 mol·L‒1盐酸溶液中,充分搅拌后,相同温度下银离子浓度的大小关系是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】回答下列问题:
(1)水的离子积常数Kw与温度t(℃)的关系如图所示:
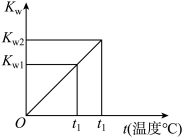
若t1=25℃,则Kw1=_______ ;若t2=100℃时,Kw2=10-12,则此时0.05mol·L-1的Ba(OH)2溶液的pH=_______ 。
(2)常温下用NaOH、氨水、CH3COOH、HCl、NH4HSO4五种溶液进行下列实验:
①浓度均为0.1mol/L的HCl和CH3COOH的pH:HCl_______ CH3COOH(填“<”“>”或“=”)。
②将xL0.01mol/L氨水与yL0.01mol/LHCl溶液充分反应至溶液呈中性,x、y大小关系为:x_______ y(填“<”“>”或“=”)。
③浓度均为0.1mol/L的NH4HSO4与NaOH等体积混合,反应的离子方程式为_______ ;此时溶液呈_______ 性(填“酸性”碱性”或“中性”)。
④用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是_______ (填写序号)。
① ②
② ③c
③c 和c
和c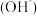 的乘积 ④
的乘积 ④ 的物质的量
的物质的量
(1)水的离子积常数Kw与温度t(℃)的关系如图所示:

若t1=25℃,则Kw1=
(2)常温下用NaOH、氨水、CH3COOH、HCl、NH4HSO4五种溶液进行下列实验:
①浓度均为0.1mol/L的HCl和CH3COOH的pH:HCl
②将xL0.01mol/L氨水与yL0.01mol/LHCl溶液充分反应至溶液呈中性,x、y大小关系为:x
③浓度均为0.1mol/L的NH4HSO4与NaOH等体积混合,反应的离子方程式为
④用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
①
 ②
② ③c
③c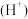 和c
和c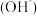 的乘积 ④
的乘积 ④ 的物质的量
的物质的量
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】常温下,将0.1000 molL-1 NaOH溶液滴入20.00 mL 0.1000 molL-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如图所示。
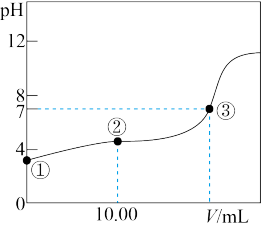
(1)HA与NaOH溶液反应的离子方程式是___________ 。
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是___________ (填序号)。
a.c(Na+)= c(HA)+c(A-) b.c(Na+)+c(H+)=c(A-)+c(OH-) c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V___________ 20.00 mL(填“>”、“<”或“=”)。

(1)HA与NaOH溶液反应的离子方程式是
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是
a.c(Na+)= c(HA)+c(A-) b.c(Na+)+c(H+)=c(A-)+c(OH-) c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】(1)将等体积等物质的量浓度的盐酸和氨水混合后,呈___________ 性,溶液中c( )与c(Cl-)的大小关系是
)与c(Cl-)的大小关系是___________ ;
(2)常温下,将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈___________ 性,溶液中c( )与c(Cl-)的大小关系是
)与c(Cl-)的大小关系是___________ ;
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中c( )与c(Cl-)浓度相等,则混合溶液呈
)与c(Cl-)浓度相等,则混合溶液呈___________ 性,盐酸与氨水体积大小关系是___________ ;
(4)常温下,将m mol/L的盐酸和n mol/L氨水等体积混合后,溶液的pH=7,m与n的大小关系是___________ ,则盐酸中c(H+)与氨水中c(OH-)的大小关系是___________ 。
 )与c(Cl-)的大小关系是
)与c(Cl-)的大小关系是(2)常温下,将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈
 )与c(Cl-)的大小关系是
)与c(Cl-)的大小关系是(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中c(
 )与c(Cl-)浓度相等,则混合溶液呈
)与c(Cl-)浓度相等,则混合溶液呈(4)常温下,将m mol/L的盐酸和n mol/L氨水等体积混合后,溶液的pH=7,m与n的大小关系是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】(1)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中HCO3―、CO32―、H2CO3 三种微粒的浓度由大到小 的顺序为:_______________________________ 。
(2)NaHCO3溶液与硫酸铝溶液混合的离子方程式 _______________________________ 。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________ 。
(2)NaHCO3溶液与硫酸铝溶液混合的
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=
您最近一年使用:0次



