回答下列问题:
(1)水的离子积常数Kw与温度t(℃)的关系如图所示:
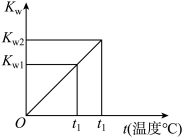
若t1=25℃,则Kw1=_______ ;若t2=100℃时,Kw2=10-12,则此时0.05mol·L-1的Ba(OH)2溶液的pH=_______ 。
(2)常温下用NaOH、氨水、CH3COOH、HCl、NH4HSO4五种溶液进行下列实验:
①浓度均为0.1mol/L的HCl和CH3COOH的pH:HCl_______ CH3COOH(填“<”“>”或“=”)。
②将xL0.01mol/L氨水与yL0.01mol/LHCl溶液充分反应至溶液呈中性,x、y大小关系为:x_______ y(填“<”“>”或“=”)。
③浓度均为0.1mol/L的NH4HSO4与NaOH等体积混合,反应的离子方程式为_______ ;此时溶液呈_______ 性(填“酸性”碱性”或“中性”)。
④用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是_______ (填写序号)。
① ②
② ③c
③c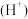 和c
和c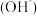 的乘积 ④
的乘积 ④ 的物质的量
的物质的量
(1)水的离子积常数Kw与温度t(℃)的关系如图所示:

若t1=25℃,则Kw1=
(2)常温下用NaOH、氨水、CH3COOH、HCl、NH4HSO4五种溶液进行下列实验:
①浓度均为0.1mol/L的HCl和CH3COOH的pH:HCl
②将xL0.01mol/L氨水与yL0.01mol/LHCl溶液充分反应至溶液呈中性,x、y大小关系为:x
③浓度均为0.1mol/L的NH4HSO4与NaOH等体积混合,反应的离子方程式为
④用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
①
 ②
② ③c
③c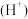 和c
和c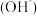 的乘积 ④
的乘积 ④ 的物质的量
的物质的量
更新时间:2023-02-02 16:57:28
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】下表中的物质为化学实验室常用药品:
回答下列问题:
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):_______ ;常温时,0.1mol·L-1的溶液呈碱性的是_______ (填序号)。
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=_______ ;常温时,pH=3的H2SO4溶液中,由水电离出的c水(H+)=_______ mol‧L-1;pH=10的Na2CO3溶液中由水电离出的c水(OH-)=_______ mol‧L-1。
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka_______ (填“增大”“减小”或“不变”。
(4)写出NaHCO3在生活中的一种用途:_______ 。
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | H2SO4 | CH3COOH | NaHCO3 | Na2CO3 | NH4Cl | NH3·H2O | HCl | NaCl |
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka
(4)写出NaHCO3在生活中的一种用途:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作________ (填“正确”或“错误”),该操作是否一定有误差?并说明原因_______________________ 。
(2)若用此方法分别测定c(OH-)相等的氢氧化钠溶液和氨水的pH,误差较大的是_______ ,原因是__________________________ 。
(3)只从下列试剂中选择实验所需的试剂,你能否区分0.1mol∙L-1硫酸溶液和0.01mol∙L-1硫酸溶液?___________ ,简述操作过程:___________________________ 。
试剂:A.紫色石蕊试液 B.酚酞试液 C.甲基橙溶液 D.蒸馏水 E.氯化钡溶液 F.pH试纸
(1)该学生的操作
(2)若用此方法分别测定c(OH-)相等的氢氧化钠溶液和氨水的pH,误差较大的是
(3)只从下列试剂中选择实验所需的试剂,你能否区分0.1mol∙L-1硫酸溶液和0.01mol∙L-1硫酸溶液?
试剂:A.紫色石蕊试液 B.酚酞试液 C.甲基橙溶液 D.蒸馏水 E.氯化钡溶液 F.pH试纸
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】电解质水溶液中存在电离平衡、水解平衡,已知部分弱电解质的电离常数如下表:
回答下列问题:
(1) 的
的 溶液和
溶液和 的
的 溶液中,
溶液中,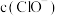
___________ 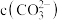 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2) 、
、 、
、 、
、 中,结合质子能力最强的是
中,结合质子能力最强的是___________ ,将少量 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是___________ 。
(3)将体积相同, 的
的 和
和 的
的 ,加水稀释到
,加水稀释到 ,需水的体积:
,需水的体积:
___________ (填“大于”“小于”或者“等于”,下同) ;分别与足量的锌粉反应,反应过程中的平均反应速率:HCOOH
;分别与足量的锌粉反应,反应过程中的平均反应速率:HCOOH_______ H2SO4。
(4)25℃时, 的
的 和
和 的氨水等体积混合后溶液呈
的氨水等体积混合后溶液呈___________ (填“酸”或“碱”)性;若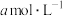 的
的 与
与 的
的 溶液等体积混合,所得溶液中
溶液等体积混合,所得溶液中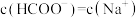 ,则该温度下
,则该温度下 的电离常数
的电离常数
____ (用含a的代数式表示)。
| 弱酸 |  |  |  |  |
| 电离常数(25℃) |  | 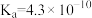 | 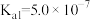 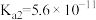 | 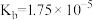 |
回答下列问题:
(1)
 的
的 溶液和
溶液和 的
的 溶液中,
溶液中,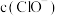
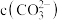 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)
 、
、 、
、 、
、 中,结合质子能力最强的是
中,结合质子能力最强的是 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是(3)将体积相同,
 的
的 和
和 的
的 ,加水稀释到
,加水稀释到 ,需水的体积:
,需水的体积:
 ;分别与足量的锌粉反应,反应过程中的平均反应速率:HCOOH
;分别与足量的锌粉反应,反应过程中的平均反应速率:HCOOH(4)25℃时,
 的
的 和
和 的氨水等体积混合后溶液呈
的氨水等体积混合后溶液呈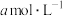 的
的 与
与 的
的 溶液等体积混合,所得溶液中
溶液等体积混合,所得溶液中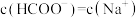 ,则该温度下
,则该温度下 的电离常数
的电离常数
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】25 ℃时,分析下列溶液的氢离子和氢氧根离子浓度
| 纯水 | 0.1 mol·L-1 NaOH溶液 | 0.1 mol·L-1盐酸 | |
| c(H+)/mol·L-1 | |||
| c(OH-)/mol·L-1 | |||
| c(H+) 、c(OH-)的相对大小 | c(H+)< c(OH-) | c(H+)> c(OH-) | |
| 溶液的酸碱性 |
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】25℃时,水的电离程度很小,1L纯水中只有___ mol水电离。水的离子积常数Kw=___ ,水的电离是___ 过程,升高温度,能促进水的电离,所以Kw随温度升高而___ 。
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】物质A—E都是由下表中的离子组成或生成的,常温下各物质从lmL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E。请回答:
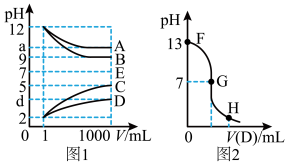
(1)根据图1中各物质的pH变化关系,写出下列物质的化学式:B:___ 。
(2)图l中a>9的理由是___ 。
(3)另取浓度为C1的B溶液25ml,向其中逐滴滴加0.2mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示。
①C1为___ 。
②G点溶液呈中性,则加入D溶液的体积V___ (填“>”、“<’’或“=”)12.5mL。
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC=___ 。
| 阳离子 | NH 、H+、Na+ 、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |

(1)根据图1中各物质的pH变化关系,写出下列物质的化学式:B:
(2)图l中a>9的理由是
(3)另取浓度为C1的B溶液25ml,向其中逐滴滴加0.2mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示。
①C1为
②G点溶液呈中性,则加入D溶液的体积V
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】回答下列问题:
(1)写出下列物质的电离方程式:H2SO4_______ 、NH3·H2O_______ 、H2S_______ 、NaHCO3_______ 。
(2)现有①CH3COOH、②HCl两种溶液,选择填空:
A.①>② B.①<② C.①=②
①当它们的物质的量浓度相同时,其pH的关系为_______ 。
②当它们的物质的量浓度、体积相同时,消耗NaOH的物质的量的关系为_______ 。
③当它们的pH相同、体积相同时,分别加入足量锌,相同状况下产生气体的体积关系为_______ 。
(3)已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是_______。
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是_______。
(1)写出下列物质的电离方程式:H2SO4
(2)现有①CH3COOH、②HCl两种溶液,选择填空:
A.①>② B.①<② C.①=②
①当它们的物质的量浓度相同时,其pH的关系为
②当它们的物质的量浓度、体积相同时,消耗NaOH的物质的量的关系为
③当它们的pH相同、体积相同时,分别加入足量锌,相同状况下产生气体的体积关系为
(3)已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH
 CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是_______。
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是_______。| A.加少量烧碱固体 | B.降低温度 | C.加少量醋酸钠固体 | D.加水 |
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为______________________________ 。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)______________ (填“>”“<”或“=”)c(CH3COO-)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________________________________ 。
(4) 25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-) =__________________ 。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为
(4) 25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-) =
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】酸、碱、盐在水溶液中的离子反应在生活和生产中有广泛的应用,请回答下列问题。
(1)洗涤剂中的 俗称“纯碱”的原因是
俗称“纯碱”的原因是___________ (用离子方程式表示),洗涤油腻餐具时,使用温水效果更佳,原因是___________ 。
(2) 时,相同
时,相同 的盐酸与
的盐酸与 溶液分别加水稀释100倍后,比较两溶液的
溶液分别加水稀释100倍后,比较两溶液的 大小:盐酸
大小:盐酸___________  溶液(填“>”、“=”或“<”)。
溶液(填“>”、“=”或“<”)。
(3)菠菜等植物中含有丰富的草酸( ),草酸对生命活动有重要影响。
),草酸对生命活动有重要影响。
①草酸是一种二元弱酸,写出它在水中的电离方程式___________ ,要使溶液中 的电离平衡正向移动且
的电离平衡正向移动且 增大,可以采取的措施有
增大,可以采取的措施有___________ 。
②已知 时,
时,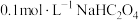 ,溶液的
,溶液的 ,则
,则 溶液中
溶液中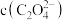 、
、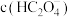 、
、 由小到大的顺序为
由小到大的顺序为___________ 。
(1)洗涤剂中的
 俗称“纯碱”的原因是
俗称“纯碱”的原因是(2)
 时,相同
时,相同 的盐酸与
的盐酸与 溶液分别加水稀释100倍后,比较两溶液的
溶液分别加水稀释100倍后,比较两溶液的 大小:盐酸
大小:盐酸 溶液(填“>”、“=”或“<”)。
溶液(填“>”、“=”或“<”)。(3)菠菜等植物中含有丰富的草酸(
 ),草酸对生命活动有重要影响。
),草酸对生命活动有重要影响。①草酸是一种二元弱酸,写出它在水中的电离方程式
 的电离平衡正向移动且
的电离平衡正向移动且 增大,可以采取的措施有
增大,可以采取的措施有②已知
 时,
时,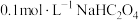 ,溶液的
,溶液的 ,则
,则 溶液中
溶液中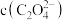 、
、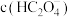 、
、 由小到大的顺序为
由小到大的顺序为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】白醋是照调中的酸味辅料,能改善调节人体的新陈代谢,其主要成分为CH3COOH,为一元弱酸,回答下列问题:
(1)25℃时,pH=5的醋酸溶液中,由水电离出的c(H+)=_____ mol∙L−1。
(2)已知CH3COOH的Ka=1.74×10−5,NH3∙H2O的Kb=1.74×10−5,则CH3COONH4的浓溶液呈_____ (填“酸性”或“中性”或“碱性”);将CH3COONH4加到Mg(OH)2悬浊液中,发现沉淀溶解,试解释原因:______ (用文字和方程式说明)。
(3)用如图所示装置测定Zn和4.0 mol∙L−1、2.0 mol∙L−1醋酸的反应速率:
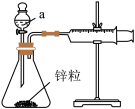
①仪器a的名称为_____ 。
②Zn和醋酸溶液反应的离子方程式为______ 。
③设计实验方案:在不同浓度醋酸溶液下,测定_____ (要求所测得的数据能直观体现反应速率大小)。
(1)25℃时,pH=5的醋酸溶液中,由水电离出的c(H+)=
(2)已知CH3COOH的Ka=1.74×10−5,NH3∙H2O的Kb=1.74×10−5,则CH3COONH4的浓溶液呈
(3)用如图所示装置测定Zn和4.0 mol∙L−1、2.0 mol∙L−1醋酸的反应速率:

①仪器a的名称为
②Zn和醋酸溶液反应的离子方程式为
③设计实验方案:在不同浓度醋酸溶液下,测定
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】水溶液是生命体赖以生存的环境,许多化学反应都是在水溶液中进行的。
I.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)室温下,关于 的
的 溶液,下列分析正确的是
溶液,下列分析正确的是
(2)物质的量浓度均为0.1 的六种溶液①
的六种溶液①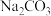 ②
② ③NaClO④
③NaClO④ ⑤
⑤ ⑥
⑥ ,pH由小到大的顺序
,pH由小到大的顺序___________ (填序号)。
(3)向次氯酸钠溶液通入少量 发生反应的离子方程式
发生反应的离子方程式___________ 。
(4)碳酸氢铵溶液显___________ (填“酸”、“中”或“碱”)性。
(5)向a 的
的 溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度
溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度___________  (用含a的式子表示)。
(用含a的式子表示)。
II. 是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴
是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴 ,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
(6)则 和水反应的化学方程式为:
和水反应的化学方程式为:___________ 。
(7)若将 溶液直接蒸干得不到无水
溶液直接蒸干得不到无水 ,用
,用 与
与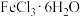 混合共热,则可得到无水
混合共热,则可得到无水 ,其原因是
,其原因是___________ 。(用简要的文字回答)
I.25℃时,部分物质的电离平衡常数如表所示:
| 化学式 |  |  |  |  |
| 电离平衡常数 |  |  |   | 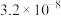 |
请回答下列问题:
(1)室温下,关于
 的
的 溶液,下列分析正确的是
溶液,下列分析正确的是 A.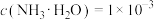  |
B.由水电离出的  |
C.加入少量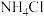 固体, 固体, 的电离平衡逆向移动, 的电离平衡逆向移动, 的值减小 的值减小 |
D.加入等体积 的盐酸,所得溶液: 的盐酸,所得溶液: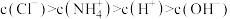 |
 的六种溶液①
的六种溶液①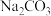 ②
② ③NaClO④
③NaClO④ ⑤
⑤ ⑥
⑥ ,pH由小到大的顺序
,pH由小到大的顺序(3)向次氯酸钠溶液通入少量
 发生反应的离子方程式
发生反应的离子方程式(4)碳酸氢铵溶液显
(5)向a
 的
的 溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度
溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度 (用含a的式子表示)。
(用含a的式子表示)。II.
 是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴
是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴 ,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。(6)则
 和水反应的化学方程式为:
和水反应的化学方程式为:(7)若将
 溶液直接蒸干得不到无水
溶液直接蒸干得不到无水 ,用
,用 与
与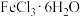 混合共热,则可得到无水
混合共热,则可得到无水 ,其原因是
,其原因是
您最近一年使用:0次

 的颜色是
的颜色是 的方法(用化学方程式表示)
的方法(用化学方程式表示)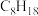 )完全燃烧生成液态水放出的热量为5518kJ(298K、
)完全燃烧生成液态水放出的热量为5518kJ(298K、 时测定)。写出该条件下,辛烷燃烧的热化学方程式
时测定)。写出该条件下,辛烷燃烧的热化学方程式


