环境保护是实现社会发展的前提,保护环境,确保人与自然的和谐,是经济能够得到进一步发展的前提,也是人类文明延续的保证。因此,保护和改善生态环境,实现人类社会的持续发展,是全人类紧迫而艰巨的任务。回答下列问题:
(1)绿色化学是预防污染的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。下列方法符合绿色化学思想的是___________
(2)二氧化碳气体能引起温室效应,为有效降低二氧化碳排放,在第七十五届联合国大会上,我国向国际社会作出“碳达峰、碳中和”的郑重承诺,由此推动了二氧化碳中综合利用的研究。
①“碳捕捉技术”可实现二氧化碳的分离、储存和利用,其工艺流程如图所示,下列叙述正确的是___________
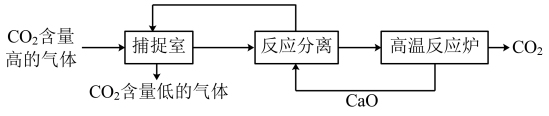
A. 是引起酸雨的主要物质之一 B.能源消耗低是该技术的一大优点
是引起酸雨的主要物质之一 B.能源消耗低是该技术的一大优点
C.捕捉 可使用小苏打溶液。 D.捕捉到的
可使用小苏打溶液。 D.捕捉到的 可作化工原料
可作化工原料
②将二氧化碳转化为甲醇是实现碳中和的有效途径;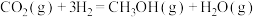 ,如图表示该反应进行过程中的能量变化。
,如图表示该反应进行过程中的能量变化。

图中曲线___________ (填“a”或“b”)表示使用催化剂时的反应进程,使用催化剂对该反应的反应热小___________ 影响(填“有”或“无”)。若H—H的键能为hkJ/mol,则C=O的键能为___________ ;写出图示表示反应的热化学方程式___________ 。
(1)绿色化学是预防污染的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。下列方法符合绿色化学思想的是___________
| A.处理废弃物 | B.治理污染点 | C.减少有毒物 | D.杜绝污染源 |
①“碳捕捉技术”可实现二氧化碳的分离、储存和利用,其工艺流程如图所示,下列叙述正确的是

A.
 是引起酸雨的主要物质之一 B.能源消耗低是该技术的一大优点
是引起酸雨的主要物质之一 B.能源消耗低是该技术的一大优点C.捕捉
 可使用小苏打溶液。 D.捕捉到的
可使用小苏打溶液。 D.捕捉到的 可作化工原料
可作化工原料②将二氧化碳转化为甲醇是实现碳中和的有效途径;
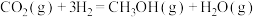 ,如图表示该反应进行过程中的能量变化。
,如图表示该反应进行过程中的能量变化。
图中曲线
更新时间:2022-07-14 18:00:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。已知:
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:____________ ;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为______ ;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条)_________ 、_________ ;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:

①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是__________ 。
②煅烧炉中产生的固态副产品为__________ ,生产流程中能被循环利用的物质X为__________ 。
| 化学键 | N≡N | H—O | N—H | O=O |
| 键能/kJ·mol-1 | 945 | 463 | 391 | 498 |
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6mol/L) | 4.8 | 5.9 | 6.0 |
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条)
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:

①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
②煅烧炉中产生的固态副产品为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】在我国南海、东海海底均存在大量的可燃冰(天然气水合物,可表示为 )。
)。
2017年5月,中国首次海域可燃冰试采成功。2017年11月3日,国务院正式批准将可燃冰列为新矿种。可燃冰的开采和利用,既有助于解决人类面临的能源危机,又能生成一系列的工业产品。
(1)对某可燃冰矿样进行定量分析,取一定量样品,释放出的甲烷气体体积折合成标准状况后为166 m3,剩余 H2O 的体积为0.8m3,则该样品的化学式中 x=_________________ 。
(2)已知下表数据,且知 H2O(l)=H2O(g) △H=+41
用甲烷燃烧热表示的热化学方程式为_____________________________________________________ 。
(3)甲烷燃料电池相较于直接燃烧甲烷有着更高的能量转化效率,某甲烷燃料电池,正极通入空气,以某种金属氧化物为离子导体(金属离子空穴中能传导 O2-),该电池负极的电极反应式为__________________________________________ 。
(4)甲烷与水蒸气重整制氢是工业上获得氢气的重要手段。若甲烷与脱盐水在一定条件下反应生成H2,同时得到体积比为1:3的CO2和CO,该反应的化学方程式为_____________________________________ 。混合气体中的CO2可用浓氨水脱除,同时获得氮肥NH4HCO3,该反应的离子方程式是_________________________________________________________ 。
 )。
)。2017年5月,中国首次海域可燃冰试采成功。2017年11月3日,国务院正式批准将可燃冰列为新矿种。可燃冰的开采和利用,既有助于解决人类面临的能源危机,又能生成一系列的工业产品。
(1)对某可燃冰矿样进行定量分析,取一定量样品,释放出的甲烷气体体积折合成标准状况后为166 m3,剩余 H2O 的体积为0.8m3,则该样品的化学式中 x=
(2)已知下表数据,且知 H2O(l)=H2O(g) △H=+41

| 化学键 | C—H | O=O | C=O | H—O |
键能/  | 413 | 498 | 803 | 463 |
用甲烷燃烧热表示的热化学方程式为
(3)甲烷燃料电池相较于直接燃烧甲烷有着更高的能量转化效率,某甲烷燃料电池,正极通入空气,以某种金属氧化物为离子导体(金属离子空穴中能传导 O2-),该电池负极的电极反应式为
(4)甲烷与水蒸气重整制氢是工业上获得氢气的重要手段。若甲烷与脱盐水在一定条件下反应生成H2,同时得到体积比为1:3的CO2和CO,该反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2Cl的电子式:________ 。
(2)写出NH2Cl与水反应的化学方程式:________ 。
(3)一定条件下,可以用Cl2(g)和NH3(g)制得NH2Cl(g)同时得到HCl(g),已知部分化学键的键能如下表:
写出该反应的热化学方程式:________ 。
II.亚硝酸氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在一定条件下合成。保持恒温恒容条件下,将物质的量之和为3mol的NO和Cl2以不同的氮氯比进行反应2NO(g)+Cl2(g) ⇌ 2NOCl2(g)△H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:

(4)图中T1、T2的关系为T1_______ T2 (填“>”、“=”、“<”)。
(5)图中纵坐标为物质_______ (填化学式)的转化率
(6)图中A、B、C三点中平衡时NOCl体积分数最大的是_______ (填“A”、“B”、“C”)。
(7)若容器的体积为1L,则B点的平衡常数为_______ 。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2Cl的电子式:
(2)写出NH2Cl与水反应的化学方程式:
(3)一定条件下,可以用Cl2(g)和NH3(g)制得NH2Cl(g)同时得到HCl(g),已知部分化学键的键能如下表:
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式:
II.亚硝酸氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在一定条件下合成。保持恒温恒容条件下,将物质的量之和为3mol的NO和Cl2以不同的氮氯比进行反应2NO(g)+Cl2(g) ⇌ 2NOCl2(g)△H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:

(4)图中T1、T2的关系为T1
(5)图中纵坐标为物质
(6)图中A、B、C三点中平衡时NOCl体积分数最大的是
(7)若容器的体积为1L,则B点的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___ 。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:
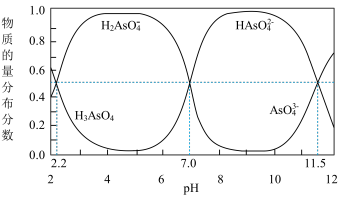
①lgKa1(H3AsO4)=_____ 。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___ 。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s) 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)
 As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g) 4As(g) △H
4As(g) △H
①△H=____ kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
由上表判断催化剂X____ (填“优于”或“劣于”)Y,理由是_____ 。
(4)反应2As2S3(s) 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正)_____ v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____ kPa,该反应的Kp=_____ kPa5(Kp为以分压表示的平衡常数)。
(1)AsH3的电子式为
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:

①lgKa1(H3AsO4)=
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s)
 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1反应Ⅱ.As2O3(g)+3C(s)

 As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1反应Ⅲ.As4(g)
 4As(g) △H
4As(g) △H①△H=
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
| 反应Ⅱ | 反应Ⅲ | ||
| 活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 | |
(4)反应2As2S3(s)
 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
①对应温度下,B点的反应速率v(正)
②A点处,AsS(g)的分压为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮的化合物在生产生活中有着广泛应用,与此有关的研究已经获得多次诺贝尔化学奖。目前气态含氨化合物及相关转化依然是科学家研究的热门问题。请回答下列问题:
(1)2007年,诺贝尔化学奖授予了埃特尔,以表彰其对合成氨反应机理的研究。 时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。

①图中决速步骤的反应方程式为___________ 。该步反应的活化能
___________  。
。
②相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是___________ 。
(2)环境保护与绿色发展是我们需要关注的。NO是大气污染物,目前采用 溶液液相氧化法脱除烟气中的NO,其主要过程如下:
溶液液相氧化法脱除烟气中的NO,其主要过程如下:
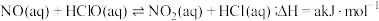
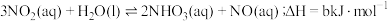
写出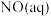 转化为
转化为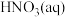 的热化学方程式
的热化学方程式___________ 。
(3)活性炭还原法也是消除氮氧化物污染的有效方法,原理为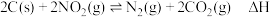 ,已知该反应的正、逆反应速率方程分别为
,已知该反应的正、逆反应速率方程分别为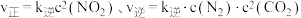 ,其中
,其中 分别为正、逆反应速率常数,变化曲线如图所示,则该反应的反应热
分别为正、逆反应速率常数,变化曲线如图所示,则该反应的反应热
___________ 0(填“>”、“<”或“=”),写出推理过程___________ 。

(4)一定温度下,在体积为3L的恒容密闭容器中加入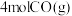 和
和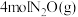 发生反应
发生反应 测得
测得 和
和 的物质的量随时间的变化如图所示:
的物质的量随时间的变化如图所示:

①在A点时,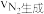
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②计算A点CO(g)的转化率___________ 。
③求该温度下的化学平衡常数K=___________ 。
(5)合成氨使制碱工业发展迅速,索尔维制碱法制备纯碱的制备流程如图所示,其反应原理与侯氏制碱法相同。下列说法不正确的是___________;

(1)2007年,诺贝尔化学奖授予了埃特尔,以表彰其对合成氨反应机理的研究。
 时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
①图中决速步骤的反应方程式为

 。
。②相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是
(2)环境保护与绿色发展是我们需要关注的。NO是大气污染物,目前采用
 溶液液相氧化法脱除烟气中的NO,其主要过程如下:
溶液液相氧化法脱除烟气中的NO,其主要过程如下: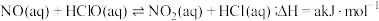
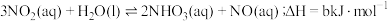
写出
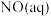 转化为
转化为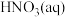 的热化学方程式
的热化学方程式(3)活性炭还原法也是消除氮氧化物污染的有效方法,原理为
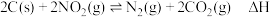 ,已知该反应的正、逆反应速率方程分别为
,已知该反应的正、逆反应速率方程分别为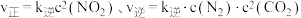 ,其中
,其中 分别为正、逆反应速率常数,变化曲线如图所示,则该反应的反应热
分别为正、逆反应速率常数,变化曲线如图所示,则该反应的反应热

(4)一定温度下,在体积为3L的恒容密闭容器中加入
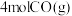 和
和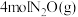 发生反应
发生反应 测得
测得 和
和 的物质的量随时间的变化如图所示:
的物质的量随时间的变化如图所示:
①在A点时,
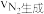
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②计算A点CO(g)的转化率
③求该温度下的化学平衡常数K=
(5)合成氨使制碱工业发展迅速,索尔维制碱法制备纯碱的制备流程如图所示,其反应原理与侯氏制碱法相同。下列说法不正确的是___________;

A.图示的流程中循环利用的物质只有 |
| B.饱和食盐水精制过程需用图示中的操作1 |
C.吸氨和碳酸化所用 和 和 最佳比为 最佳比为 |
| D.两种制碱法的食盐利用率相同 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题。
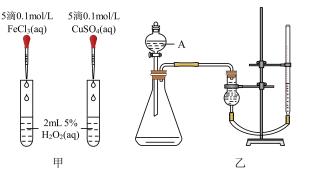
(1)定性分析:如图甲可通过观察_______________ ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________ 。
(2)定量分析:如图乙所示,实验时均以生成20mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________ ,实验中需要测量的数据是________ ,为了减少实验误差,反应前后量气管两边液面的高度应保持一致,则在反应后应采取的操作方法是_______________ 。

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成20mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐1】化合物G是一种药物合成中间体,其合成路线如图:

已知:R1CH2COOCH2CH3+R2COOCH2CH3
 +CH3CH2OH
+CH3CH2OH
(1)化合物A的名称是_______ 。反应②和⑤的反应类型分别是_______ 、_______ 。
(2)写出C到D的反应方程式:_______ 。
(3)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四种不同环境的氢原子,其个数比为6:2:1:1,写出两种符合要求的X的结构简式:_______ 、_______ 。
(4)面向“碳中和”的绿色碳化学是当前研究的重要方向。反应②产物己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:

分析“绿色”合成路线比过去的工业合成路线的优点_______ 。
(5)设计由乙酸乙酯和1,4-二溴丁烷() 制备
制备 的合成路线:
的合成路线:_______ (无机试剂任选)。(备注:①参照所提供的信息②表示方法为:A B
B
 目标产物)
目标产物)

已知:R1CH2COOCH2CH3+R2COOCH2CH3

 +CH3CH2OH
+CH3CH2OH(1)化合物A的名称是
(2)写出C到D的反应方程式:
(3)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四种不同环境的氢原子,其个数比为6:2:1:1,写出两种符合要求的X的结构简式:
(4)面向“碳中和”的绿色碳化学是当前研究的重要方向。反应②产物己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:

分析“绿色”合成路线比过去的工业合成路线的优点
(5)设计由乙酸乙酯和1,4-二溴丁烷()
 制备
制备 的合成路线:
的合成路线: B
B
 目标产物)
目标产物)
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐2】乙烯是重要化工原料。结合如图路线回答下列问题。

(1)反应①的化学方程式是_______ 。
(2)B的官能团名称是_______ 。
(3)反应④的化学方程式是_______ 。
(4)F是一种高分子物质,可用于制作食品塑料袋等,F的结构简式是_______ 。
(5)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%。下列转化符合绿色化学要求的是_______ (填序号)。
a.乙醇制取乙醛 b.甲烷制备CH3Cl c.2CH3CHO+O2 2CH3COOH
2CH3COOH

(1)反应①的化学方程式是
(2)B的官能团名称是
(3)反应④的化学方程式是
(4)F是一种高分子物质,可用于制作食品塑料袋等,F的结构简式是
(5)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%。下列转化符合绿色化学要求的是
a.乙醇制取乙醛 b.甲烷制备CH3Cl c.2CH3CHO+O2
 2CH3COOH
2CH3COOH
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,下图是几种工业生产的联合生产工艺:

请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为_________ (填化学式),阴极反应式为__________ 。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是______ 装置戊进行反应时需要的环境为________ (填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中

请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
您最近一年使用:0次



