氧钒(IV)碱式碳酸铵为紫色晶体,难溶于水,是制备热敏材料 的原料,其化学式为
的原料,其化学式为 。实验室以
。实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:

已知:+4价钒在弱酸性条件下具有还原性,能被 氧化。
氧化。
(1)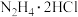 为离子化合物,
为离子化合物, 中含有的σ键数目为
中含有的σ键数目为_______ 。
(2)步骤1中生成 的同时生成一种无色无污染的气体,该反应的化学方程式为
的同时生成一种无色无污染的气体,该反应的化学方程式为_______ 。
(3)步骤2可在下图装置(气密性良好)中进行。
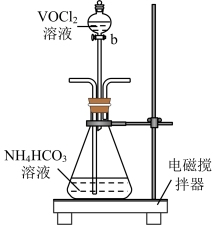
制备过程中,需向锥形瓶中通入 ,作用是
,作用是_______ ,所得紫色晶体残留的杂质离子主要为_______ 。
(4)步骤3洗涤晶体时需用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,选择饱和
溶液洗涤3次,再用无水乙醇洗涤2次,选择饱和 溶液的原因是
溶液的原因是_______ 。
(5)已知:①去除溶液中 可依次加入尿素溶液(还原
可依次加入尿素溶液(还原 )、亚硝酸钠溶液(氧化尿素)。
)、亚硝酸钠溶液(氧化尿素)。
②滴定反应: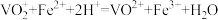 。
。
补充完整测定氧钒(Ⅳ)碱式碳酸按晶体中钒的含量的实验方案:称量5.1000g样品于锥形瓶中,_______ 。(实验中须使用的试剂是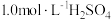 溶液、
溶液、 溶液、尿素溶液、亚硝酸钠溶液、0.0800mol/L的
溶液、尿素溶液、亚硝酸钠溶液、0.0800mol/L的 标准溶液,滴定终点的现象描述不作要求)
标准溶液,滴定终点的现象描述不作要求)
 的原料,其化学式为
的原料,其化学式为 。实验室以
。实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
已知:+4价钒在弱酸性条件下具有还原性,能被
 氧化。
氧化。(1)
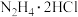 为离子化合物,
为离子化合物, 中含有的σ键数目为
中含有的σ键数目为(2)步骤1中生成
 的同时生成一种无色无污染的气体,该反应的化学方程式为
的同时生成一种无色无污染的气体,该反应的化学方程式为(3)步骤2可在下图装置(气密性良好)中进行。

制备过程中,需向锥形瓶中通入
 ,作用是
,作用是(4)步骤3洗涤晶体时需用饱和
 溶液洗涤3次,再用无水乙醇洗涤2次,选择饱和
溶液洗涤3次,再用无水乙醇洗涤2次,选择饱和 溶液的原因是
溶液的原因是(5)已知:①去除溶液中
 可依次加入尿素溶液(还原
可依次加入尿素溶液(还原 )、亚硝酸钠溶液(氧化尿素)。
)、亚硝酸钠溶液(氧化尿素)。②滴定反应:
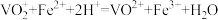 。
。补充完整测定氧钒(Ⅳ)碱式碳酸按晶体中钒的含量的实验方案:称量5.1000g样品于锥形瓶中,
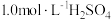 溶液、
溶液、 溶液、尿素溶液、亚硝酸钠溶液、0.0800mol/L的
溶液、尿素溶液、亚硝酸钠溶液、0.0800mol/L的 标准溶液,滴定终点的现象描述不作要求)
标准溶液,滴定终点的现象描述不作要求)
2022·江苏南京·模拟预测 查看更多[4]
(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(工业流程题)(已下线)专题五 化学常用计量与化学计算-实战高考·二轮复习核心突破(已下线)专题讲座(九) 化学实验中规范答题(练)-2023年高考化学一轮复习讲练测(全国通用)江苏省南京市第十三中学2022届高三下学期适应性考试化学试题
更新时间:2022-07-28 21:43:37
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】水合肼(N2H4·H2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
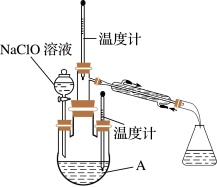
实验1:制备NaClO溶液。(已知:3NaClO 2NaCl+NaClO3)
2NaCl+NaClO3)
(1)如图装置Ⅰ中烧瓶内发生反应的化学方程式为___________ 。
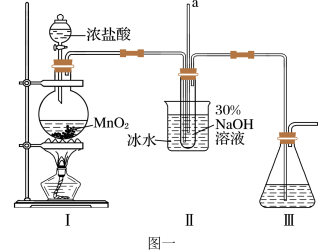
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有__________ (填字母)。
a.烧杯 b.容量瓶 c.玻璃棒 d.烧瓶
(3)图中装置Ⅱ中用冰水浴控制温度的目的是__________ 。
实验2:制取水合肼。
(4)图中充分反应后,____________ (填操作名称)A中溶液即可得到水合肼的粗产品。若分液漏斗滴液速度过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。写出该过程反应生成氮气的化学方程式 ________ 。
实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15 mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,碘的标准溶液盛放在________ (填“酸式”或“碱式”)滴定管中。
②下列能导致馏分中水合肼的含量测定结果偏高的是_________ (填字母)。
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_________ 。
实验1:制备NaClO溶液。(已知:3NaClO
 2NaCl+NaClO3)
2NaCl+NaClO3)(1)如图装置Ⅰ中烧瓶内发生反应的化学方程式为

(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有
a.烧杯 b.容量瓶 c.玻璃棒 d.烧瓶
(3)图中装置Ⅱ中用冰水浴控制温度的目的是
实验2:制取水合肼。
(4)图中充分反应后,

实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15 mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,碘的标准溶液盛放在
②下列能导致馏分中水合肼的含量测定结果偏高的是
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】滴定法是化学分析的常用方法,某兴趣小组利用滴定法进行如下实验。
【实验I】用 的
的 溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出实验步骤:
溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出实验步骤:
A.分别向碱式滴定管、酸式滴定管注入 标准溶液和待测醋酸至0刻度以上2~3cm
标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用 标准溶液滴定至终点,记下滴定管液面的刻度
标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2滴指示剂
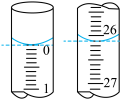
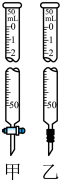
(1)①从上述实验步骤中选出正确的并按操作先后排序:______________ (用字母表示)。
②滴定开始和结束时读数若如图所示, 标准溶液的体积为
标准溶液的体积为__________ mL。
(2)有学生在实验过程中实验数据记录如下:
进行滴定操作时滴定管的正确操作应该是_______________ (填选项字母)。
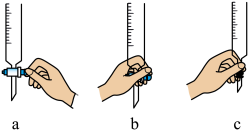
根据实验数据计算,c(待测液)_________ 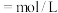 ,若滴定时标准液和待测液的浓度变大,滴定突跃范围变
,若滴定时标准液和待测液的浓度变大,滴定突跃范围变____________ (填“宽”“窄”)。
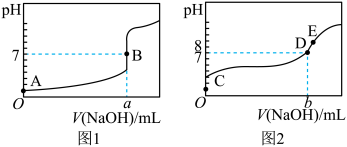
(3)常温下,若用 溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:达到B、D状态时,反应消耗的
溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:达到B、D状态时,反应消耗的 溶液的体积a
溶液的体积a______ b(填“>”“<”或“=”)。
(4)测定 的纯度。
的纯度。
称取ag样品,先用硫酸溶解,配成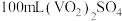 溶液,取20mL溶液置于锥形瓶中,再加入
溶液,取20mL溶液置于锥形瓶中,再加入 溶液
溶液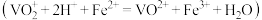 ,最后用
,最后用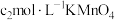 溶液滴定过量的
溶液滴定过量的 至
至___________________ (填现象)表示到达滴定终点.消耗 溶液的体积为
溶液的体积为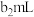 ,已知
,已知 被还原为
被还原为 ,
, 的质量分数是
的质量分数是__________ ( 的摩尔质量:
的摩尔质量: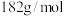 ),下列情况会导致产品纯度偏大的是
),下列情况会导致产品纯度偏大的是_________ (填标号)。
A. 溶液部分变质(含
溶液部分变质(含 ) B.滴定达终点时,仰视刻度线读数
) B.滴定达终点时,仰视刻度线读数
C.滴定前,在锥形瓶中加水稀释待测液 D.滴定终点时,滴定管尖嘴内有气泡生成
E. 溶液因露空放置太久而变质F.酸式滴定管未用标准液润洗
溶液因露空放置太久而变质F.酸式滴定管未用标准液润洗
【实验I】用
 的
的 溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出实验步骤:
溶液测定某食用白醋中醋酸的物质的量浓度,某同学列出实验步骤:A.分别向碱式滴定管、酸式滴定管注入
 标准溶液和待测醋酸至0刻度以上2~3cm
标准溶液和待测醋酸至0刻度以上2~3cmB.调节滴定管液面至0或0刻度以下,记下读数
C.用
 标准溶液滴定至终点,记下滴定管液面的刻度
标准溶液滴定至终点,记下滴定管液面的刻度D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2滴指示剂


(1)①从上述实验步骤中选出正确的并按操作先后排序:
②滴定开始和结束时读数若如图所示,
 标准溶液的体积为
标准溶液的体积为(2)有学生在实验过程中实验数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗 | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 1.10 | 21.00 |
3 | 25.00 | 2.20 | 22.20 |

根据实验数据计算,c(待测液)
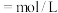 ,若滴定时标准液和待测液的浓度变大,滴定突跃范围变
,若滴定时标准液和待测液的浓度变大,滴定突跃范围变(3)常温下,若用
 溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:达到B、D状态时,反应消耗的
溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:达到B、D状态时,反应消耗的 溶液的体积a
溶液的体积a
(4)测定
 的纯度。
的纯度。称取ag样品,先用硫酸溶解,配成
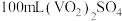 溶液,取20mL溶液置于锥形瓶中,再加入
溶液,取20mL溶液置于锥形瓶中,再加入 溶液
溶液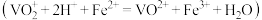 ,最后用
,最后用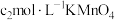 溶液滴定过量的
溶液滴定过量的 至
至 溶液的体积为
溶液的体积为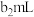 ,已知
,已知 被还原为
被还原为 ,
, 的质量分数是
的质量分数是 的摩尔质量:
的摩尔质量: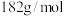 ),下列情况会导致产品纯度偏大的是
),下列情况会导致产品纯度偏大的是A.
 溶液部分变质(含
溶液部分变质(含 ) B.滴定达终点时,仰视刻度线读数
) B.滴定达终点时,仰视刻度线读数C.滴定前,在锥形瓶中加水稀释待测液 D.滴定终点时,滴定管尖嘴内有气泡生成
E.
 溶液因露空放置太久而变质F.酸式滴定管未用标准液润洗
溶液因露空放置太久而变质F.酸式滴定管未用标准液润洗
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某学习小组用凯氏定氮法(Kjeldahl method)来测定农产品中氮的含量,测定过程如下:
I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。

回答下列问题:
(1)实验前要检验B装置的气密性,具体操作为______________________________ 。
(2)盛放氢氧化钠溶液的仪器名称为__________________ ;玻璃管2的作用是___________________ ;圆底烧瓶中碎瓷片的作用是_________________________________________ 。
(3)将“谷物处理后所得的铵盐”加入三颈瓶中,打开玻璃塞、旋开K2,加入足量氢氧化钠溶液,关闭K2,打开K1,点燃酒精灯使水蒸气进入B装置。
①B装置中反应的离子方程式为_______________________________ 。
②C装置冰水混合物的作用是__________________________________ 。
III.滴定、计算氮的含量
(4)取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择____________________ 。
a.甲基橙 b.酚酞 c.甲基橙或酚酞
②该谷物样品中氮的百分含量为_____________ 。(保留2位小数)
I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。

回答下列问题:
(1)实验前要检验B装置的气密性,具体操作为
(2)盛放氢氧化钠溶液的仪器名称为
(3)将“谷物处理后所得的铵盐”加入三颈瓶中,打开玻璃塞、旋开K2,加入足量氢氧化钠溶液,关闭K2,打开K1,点燃酒精灯使水蒸气进入B装置。
①B装置中反应的离子方程式为
②C装置冰水混合物的作用是
III.滴定、计算氮的含量
(4)取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择
a.甲基橙 b.酚酞 c.甲基橙或酚酞
②该谷物样品中氮的百分含量为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
(1)与NF3分子互为等电子体的分子为________ 。
(2)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图甲。
写出Fe3+的基态电子排布式________ 。
写出该反应的化学方程式:______________ 。
(3)维生素B4结构如图乙,则1mol维生素B4分子中含有σ键的数目为______ mol。
(4)配合物丙的结构见图,丙中含有__________ (填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
丙中碳原子的杂化方式有______________ 。
(1)与NF3分子互为等电子体的分子为
(2)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图甲。
写出Fe3+的基态电子排布式
写出该反应的化学方程式:
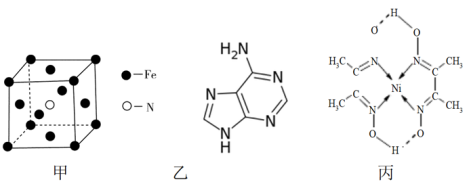
(3)维生素B4结构如图乙,则1mol维生素B4分子中含有σ键的数目为
(4)配合物丙的结构见图,丙中含有
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
丙中碳原子的杂化方式有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中________ 区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式___________ 。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为_________________ 。
②溶液中的水存在H3O+、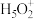 等微粒形式,
等微粒形式,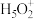 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则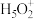 的结构式为
的结构式为___________ 。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:
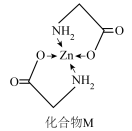
①1 mol M含有的σ键的数目为___________ 。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、 等,NH3的分子空间构型为
等,NH3的分子空间构型为____________ , 的中心氮原子杂化方式为
的中心氮原子杂化方式为__________ 。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷__________ (填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
则ZnX2熔点如表变化的原因是____________________ 。
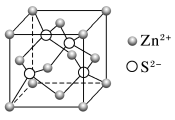
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加 德罗常数的值。则该晶体的密度为________ g·cm-3(写计算表达式)。
(1)Cu、Zn在周期表中
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为
②溶液中的水存在H3O+、
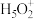 等微粒形式,
等微粒形式,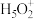 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则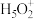 的结构式为
的结构式为(3)Zn的某种化合物M是很好的补锌剂,结构式如图:

①1 mol M含有的σ键的数目为
②常见含氮的配体有 H2NCH2 COOˉ、NH3、
 等,NH3的分子空间构型为
等,NH3的分子空间构型为 的中心氮原子杂化方式为
的中心氮原子杂化方式为③M在人体内吸收率高的原因可能是锌形成配合物后,电荷
(4)卤化锌的熔点如表:
| 卤化锌/ ZnX2 | ZnF2 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 872 | 283 | 394 |
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加 德罗常数的值。则该晶体的密度为

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】已知: ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。
(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为_______ 。
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是_______ 。
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。
①
 中
中 键的数目为
键的数目为_______ 。
②蚀刻能力恢复的化学方程式为_______ 。
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出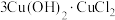 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
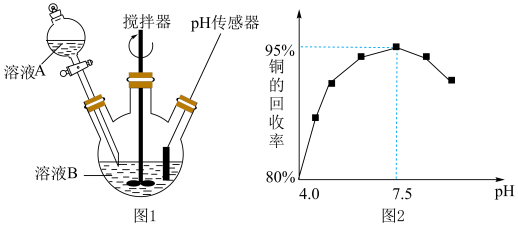
①为减少 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为_______ (选填“酸性”或“碱性”)蚀刻废液。
② 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为_______ 。
(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中_______ 。(实验中必须 使用的试剂:20% 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
 ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为
 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。①

 中
中 键的数目为
键的数目为②蚀刻能力恢复的化学方程式为
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出
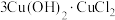 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
①为减少
 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为②
 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中
 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2,还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题:
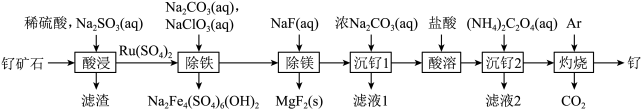
(1)Na2Fe4(SO4)6(OH)2中Fe的化合价为____ 。
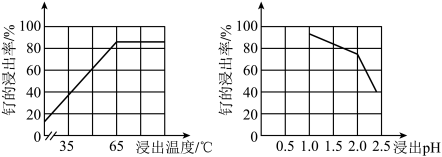
(2)“酸浸”时,Na2SO3的作用____ 。“滤渣”的主要成分有SiO2和____ (填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是____ 。
(3)“除铁”的离子方程式为____ 。(提示:1molNaClO3参与反应,转移6mol电子)
(4)从“滤液2”中可提取一种化肥,其电子式为____ 。
(5)“灼烧”时Ar的作用是____ 。
(6)某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为____ 。(保留三位有效数字)

(1)Na2Fe4(SO4)6(OH)2中Fe的化合价为
(2)“酸浸”时,Na2SO3的作用

(3)“除铁”的离子方程式为
(4)从“滤液2”中可提取一种化肥,其电子式为
(5)“灼烧”时Ar的作用是
(6)某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
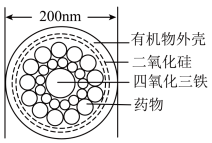
【推荐2】Ⅰ.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
(1)中国科学院上海硅酸盐研究所研制出“纳米药物分子运输车”,该“运输车”可提高肿瘤的治疗效果,其结构如下图所示。下列有关说法正确的是___________。
(2)Fe3O4能和稀硫酸反应,生成的两种盐是___________ 。验证反应后溶液中含有Fe2+的最恰当的试剂是___________ 。
A.氯水 B.酸性高锰酸钾溶液 C.硫氰化钾溶液 D.NaOH溶液
Ⅱ.铁粉在氧气中燃烧是制取Fe3O4最为快捷的方法。
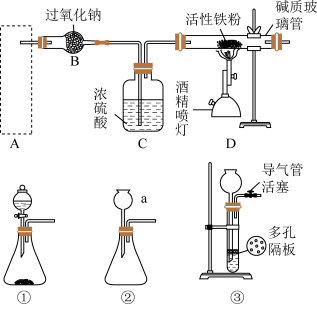
A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
(3)根据题目要求,A装置最好选___________ 。(从上图①、②、③中选择)
A.① B.② C.③
(4)在加入试剂之前,需对装置进行气密性检查。写出检查①的气密性的操作:___________ ,向分液漏斗中加足量水,塞紧玻璃塞,打开玻璃旋塞,过一会儿,水不再下滴,说明装置①的气密性良好。如果把分液漏斗改成恒压滴液漏斗,是否可以用上述步骤检验装置的气密性?___________ 。
(5)写出B装置中反应的化学方程式___________ 。
Ⅲ.氧化沉淀法也是制取Fe3O4的一种常见方法,其制取流程如下图所示:
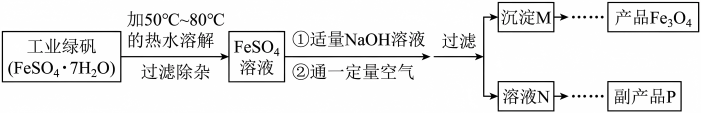
(6)副产品P是___________ (填写化学式),由溶液N获得该副产品的操作是:加热浓缩→___________ →过滤洗涤 → 晶体加热至完全失去结晶水。
(7)某兴趣小组模仿上述流程制取Fe3O4并测定其产率。具体操作如下:
Ⅰ.测定绿矾的含量:称取3.0 g工业绿矾,配制成250.00 mL溶液。量取25.00 mL溶液于锥形瓶中,用0.010 00 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液的平均体积为20.00 mL。
(滴定时发生反应的离子方程式为5Fe2++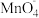 +8H+=5Fe3++Mn2++4H2O)
+8H+=5Fe3++Mn2++4H2O)
Ⅱ.称取300g工业绿矾,通过上述流程最终制得50g Fe3O4。
计算产品Fe3O4的产率________ 。(保留4位有效数字)(写出计算过程)
(1)中国科学院上海硅酸盐研究所研制出“纳米药物分子运输车”,该“运输车”可提高肿瘤的治疗效果,其结构如下图所示。下列有关说法正确的是___________。

| A.该“运输车”中四氧化三铁是碱性氧化物 |
| B.四氧化三铁起到“磁性导航仪”的作用 |
| C.该“运输车”的外壳不含碳元素 |
| D.该“运输车”分散于水中所得的分散系属于胶体 |
(2)Fe3O4能和稀硫酸反应,生成的两种盐是
A.氯水 B.酸性高锰酸钾溶液 C.硫氰化钾溶液 D.NaOH溶液
Ⅱ.铁粉在氧气中燃烧是制取Fe3O4最为快捷的方法。

A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
(3)根据题目要求,A装置最好选
A.① B.② C.③
(4)在加入试剂之前,需对装置进行气密性检查。写出检查①的气密性的操作:
(5)写出B装置中反应的化学方程式
Ⅲ.氧化沉淀法也是制取Fe3O4的一种常见方法,其制取流程如下图所示:

(6)副产品P是
(7)某兴趣小组模仿上述流程制取Fe3O4并测定其产率。具体操作如下:
Ⅰ.测定绿矾的含量:称取3.0 g工业绿矾,配制成250.00 mL溶液。量取25.00 mL溶液于锥形瓶中,用0.010 00 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液的平均体积为20.00 mL。
(滴定时发生反应的离子方程式为5Fe2++
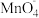 +8H+=5Fe3++Mn2++4H2O)
+8H+=5Fe3++Mn2++4H2O)Ⅱ.称取300g工业绿矾,通过上述流程最终制得50g Fe3O4。
计算产品Fe3O4的产率
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】无水氯化钴 用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO含少量NiO、CuO、FeO和
用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO含少量NiO、CuO、FeO和 等)为原料制备无水氯化钴的工艺流程如下:
等)为原料制备无水氯化钴的工艺流程如下:
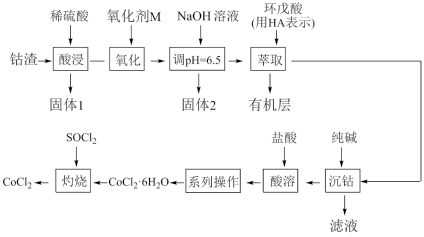
已知几种金属氢氧化物沉淀的pH如下表所示:
请回答下列问题:
(1)固体1的主要成分是___________ (填化学式)。
(2)试剂M为 ,其作用是
,其作用是___________ 。(用离子方程式表示)
(3)“调 ”时除去的“固体2”的成分是
”时除去的“固体2”的成分是___________ (填化学式),“萃取”目的是除去___________ 离子(填离子符号)。
(4)测定 产品纯度:准确称取m g产品溶于水配制成250mL溶液,量取25.0mL于锥形瓶中,加入几滴
产品纯度:准确称取m g产品溶于水配制成250mL溶液,量取25.0mL于锥形瓶中,加入几滴 溶液作指示剂,用
溶液作指示剂,用 滴定至终点,消耗滴定液体积为x mL。该产品纯度为
滴定至终点,消耗滴定液体积为x mL。该产品纯度为___________ (用含m、c和x的代数式表示)。
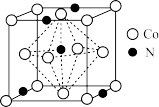
(5)金属钴与氮元素可形成氮化物晶体,所成晶体的结构其中一种为立方晶胞如图。则该晶体的化学式为___________ ,目前最常用测定晶体结构方法是利用___________ 技术。
 用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO含少量NiO、CuO、FeO和
用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO含少量NiO、CuO、FeO和 等)为原料制备无水氯化钴的工艺流程如下:
等)为原料制备无水氯化钴的工艺流程如下:
已知几种金属氢氧化物沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀时pH | 7.6 | 4.4 | 6.8 | 1.9 | 7.5 |
| 完全沉淀时pH | 9.2 | 6.4 | 8.4 | 3.2 | 9.5 |
请回答下列问题:
(1)固体1的主要成分是
(2)试剂M为
 ,其作用是
,其作用是(3)“调
 ”时除去的“固体2”的成分是
”时除去的“固体2”的成分是(4)测定
 产品纯度:准确称取m g产品溶于水配制成250mL溶液,量取25.0mL于锥形瓶中,加入几滴
产品纯度:准确称取m g产品溶于水配制成250mL溶液,量取25.0mL于锥形瓶中,加入几滴 溶液作指示剂,用
溶液作指示剂,用 滴定至终点,消耗滴定液体积为x mL。该产品纯度为
滴定至终点,消耗滴定液体积为x mL。该产品纯度为(5)金属钴与氮元素可形成氮化物晶体,所成晶体的结构其中一种为立方晶胞如图。则该晶体的化学式为

您最近一年使用:0次



