用如下装置进行实验:
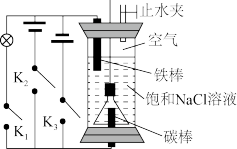
(1)关闭上端止水夹,接通K1,一段时间后用压强传感器测得装置上部压强减小,铁棒表面出现锈迹。则铁棒主要发生,_______ 腐蚀(填“析氢”或“吸氧”);此时碳棒上的电极反应式为:_______ 。
(2)Na2FeO4是一种新型净水剂,可以通过以下反应制备:Fe(OH)2+2Cl2+6NaOH=Na2FeO4+4NaCl+4H2O,为制得Na2FeO4,用一支倒扣的漏斗罩住碳极,如图,首先打开止水夹,断开K1、K2,接通K3。几分钟后,漏斗中产生的气体是_______ ;此时发生的总反应化学方程式为:_______ 。
(3)断开K1、K3,接通K2。阳极的电极反应式为_______ 。打开漏斗上口软塞,发生(2)中反应生成Na2FeO4。
(4)Na2FeO4有强氧化性可用于杀菌消毒,还可净水,其净水的原理是_______ 。

(1)关闭上端止水夹,接通K1,一段时间后用压强传感器测得装置上部压强减小,铁棒表面出现锈迹。则铁棒主要发生,
(2)Na2FeO4是一种新型净水剂,可以通过以下反应制备:Fe(OH)2+2Cl2+6NaOH=Na2FeO4+4NaCl+4H2O,为制得Na2FeO4,用一支倒扣的漏斗罩住碳极,如图,首先打开止水夹,断开K1、K2,接通K3。几分钟后,漏斗中产生的气体是
(3)断开K1、K3,接通K2。阳极的电极反应式为
(4)Na2FeO4有强氧化性可用于杀菌消毒,还可净水,其净水的原理是
更新时间:2022-04-12 09:30:41
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.红磷在氯气中燃烧的能量变化关系如图所示。
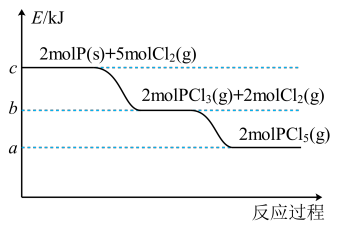
(1)根据图中信息,反应PCl3(g)+Cl2(g)=PCl5(g)_______ (填“放出”或“吸收”)_______ kJ热量。
(2)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下1 g SiH4自燃放出热量a kJ。SiH4自燃的热化学方程式为_______ 。
Ⅱ.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能,该电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-= +3H2O
+3H2O
(3)负极上的电极反应为_______ 。
(4)消耗标准状况下5.6LO2时,有_______  电子发生转移。
电子发生转移。
(5)开始放电时,正极附近溶液的pH_______ (填“增大”、“减小”或“不变”)。
(6)用该燃料电池作为电能来源,用石墨电极电解硫酸铜溶液,阳极发生的电极反应式为_______ 。

(1)根据图中信息,反应PCl3(g)+Cl2(g)=PCl5(g)
(2)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下1 g SiH4自燃放出热量a kJ。SiH4自燃的热化学方程式为
Ⅱ.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能,该电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-=
 +3H2O
+3H2O(3)负极上的电极反应为
(4)消耗标准状况下5.6LO2时,有
 电子发生转移。
电子发生转移。(5)开始放电时,正极附近溶液的pH
(6)用该燃料电池作为电能来源,用石墨电极电解硫酸铜溶液,阳极发生的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化合物,在生产生活中有重要意义。
I.雾霾严重影响人们的生活,雾霾的形成与汽车排放的NOx等有毒气体有关。
(1)通过活性炭对汽车尾气进行处理,相关原理为C(s)+2NO(g) N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是
N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是_____ 。
(2)在催化转化器中,汽车尾气中CO和NO可发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①实验b从开始至平衡时的反应速率v(CO)=_____ 。
②实验a中NO的平衡转化率为_____ 。
③与实验b相比,实验c改变的条件是_____ 。
Ⅱ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池。无污染,能量高,有广泛的应用前景,其工作原理如图所示:

(3)回答下列问题:
①该燃料电池中正极通入的物质是______ ,负极发生的反应式为______ 。
②电池工作时,OH-移向______ 电极(填“a”或b”)。
③当电池放电转移10mol电子时,至少消耗燃料肼______ g。
I.雾霾严重影响人们的生活,雾霾的形成与汽车排放的NOx等有毒气体有关。
(1)通过活性炭对汽车尾气进行处理,相关原理为C(s)+2NO(g)
 N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是
N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是| A.2v正(NO)=v逆(CO2) |
| B.单位时间内断裂1个N≡N同时生成1个C=O |
| C.混合气体中N2的体积分数保持不变 |
| D.恒温、恒容条件下,混合气体的平均摩尔质量保持不变 |
 2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①实验b从开始至平衡时的反应速率v(CO)=
②实验a中NO的平衡转化率为
③与实验b相比,实验c改变的条件是
Ⅱ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池。无污染,能量高,有广泛的应用前景,其工作原理如图所示:

(3)回答下列问题:
①该燃料电池中正极通入的物质是
②电池工作时,OH-移向
③当电池放电转移10mol电子时,至少消耗燃料肼
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】I.根据组成原电池的条件,试以反应: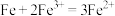 设计一个原电池
设计一个原电池
(1)画出示意图井标出原电池的正、负极电极材料和电解质溶液(画在下面方框中)_______

(2)电极反应式:负极电极反应式:_______ ;正极电极反应式:_______
II.探究化学反应速率:
(3)某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
①为了完成探究,本实验还应该待测数据可以是_______ ,实验I和实验II可以探究_______ 对锌与稀硫酸反应速率的影响,表中Vx=_______ 。
②实验I在反应5min后,测得产生了2.24L气体(标准状况),则该时间段内H2SO4的平均反应速率是_______ mol·L-l·min1-1。
③以时间为横坐标,氢气体积为纵坐标,在框内画出实验I和实验Ⅲ从反应开始到反应结束的实验曲线图。_______

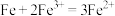 设计一个原电池
设计一个原电池(1)画出示意图井标出原电池的正、负极电极材料和电解质溶液(画在下面方框中)

(2)电极反应式:负极电极反应式:
II.探究化学反应速率:
(3)某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
| 序号 | 纯锌粉/g |  硫酸/mL 硫酸/mL | 温度/℃ | 硫酸铜固体/g | 加入蒸馏水/mL |
| I | 5.0 | 100.0 | 25 | 0 | 0 |
| II | 5.0 | 50.0 | 25 | 0 | Vx |
| III | 5.0 | 100.0 | 25 | 0.5 | 0 |
①为了完成探究,本实验还应该待测数据可以是
②实验I在反应5min后,测得产生了2.24L气体(标准状况),则该时间段内H2SO4的平均反应速率是
③以时间为横坐标,氢气体积为纵坐标,在框内画出实验I和实验Ⅲ从反应开始到反应结束的实验曲线图。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。请按要求回答相关问题:
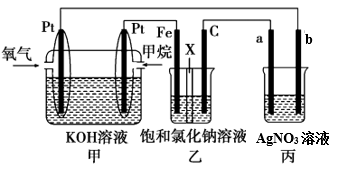
(1)甲装置电池负极发生的电极反应式是:_______
(2)乙中X是_______ (阴、阳)离子交换膜,向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因_______
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为_______
(4)若丙装置中a、b电极均为Cu,则丙中发生的离子反应是_______
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解 的原理如图所示
的原理如图所示
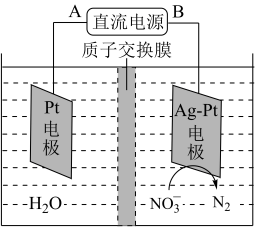
Ag-Pt电极上的电极反应式为_______

(1)甲装置电池负极发生的电极反应式是:
(2)乙中X是
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为
(4)若丙装置中a、b电极均为Cu,则丙中发生的离子反应是
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解
 的原理如图所示
的原理如图所示
Ag-Pt电极上的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲烷是非常重要的能源和化工原料,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1,写出CH4还原NO2至N2的热化学方程式:_____ 。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒镀铜。
①a处应通入______ (填“CH4”或“O2”),a处电极上发生的电极反应式是 ___________ 。
②电镀结束后,装置Ⅱ中Cu2+的物质的量浓度____ (填写“变大”“变小”或“不变”)。
③若实验过程中Ⅱ中的铜片质量减少了1.28g,则Ⅰ中理论上消耗CH4的体积(标准状况)__ _L。
(3)若将题(2)装置Ⅱ中的两电极均改为石墨惰性电极 ,电解质溶液仍为CuSO4溶液。
①写出装置Ⅱ中发生的总化学反应方程式_________ 。
②电解硫酸铜溶液一段时间后,装置Ⅱ中溶液的pH____ (填写“变大”“变小”或“不变”);要使原溶液复原,可向电解后的溶液中加入_______ 。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1,写出CH4还原NO2至N2的热化学方程式:
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒镀铜。
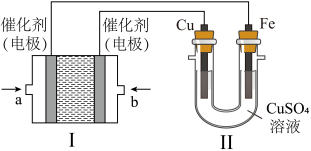
①a处应通入
②电镀结束后,装置Ⅱ中Cu2+的物质的量浓度
③若实验过程中Ⅱ中的铜片质量减少了1.28g,则Ⅰ中理论上消耗CH4的体积(标准状况)
(3)若将题(2)装置Ⅱ中的两电极均改为石墨
①写出装置Ⅱ中发生的总化学反应方程式
②电解硫酸铜溶液一段时间后,装置Ⅱ中溶液的pH
您最近一年使用:0次
【推荐3】课题式研究性学习是培养学生创造思维的良好方法。某研究性学习小组将下列装置如图连接,D、E、X、Y都是铂电极、C、F是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
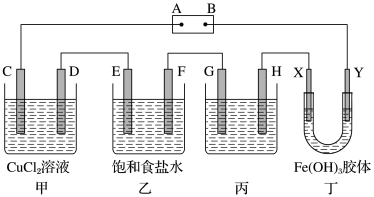
(1)B极的名称是___ 。
(2)甲装置中电解反应的总化学方程式是:___ 。
(3)设电解质溶液过量,电解后乙池中加入___ (填物质名称)可以使溶液复原。
(4)设甲池中溶液的体积在电解前后都是500ml,乙池中溶液的体积在电解前后都是200mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为___ mol/L;乙池中溶液的pH=___ ;
(5)装置丁中的现象是___ 。

(1)B极的名称是
(2)甲装置中电解反应的总化学方程式是:
(3)设电解质溶液过量,电解后乙池中加入
(4)设甲池中溶液的体积在电解前后都是500ml,乙池中溶液的体积在电解前后都是200mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为
(5)装置丁中的现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.某原电池-电解池组合如图1,请回答下列问题:

(1)装置甲中负极电极反应式为___________ 。
(2)装置乙中X为___________ 离子交换膜(填“阳”或“阴”),总反应的离子方程式为___________ 。
(3)粗铜中含有锌、银等杂质,丙装置电解一段时间后,硫酸铜溶液浓度将___________ (填“增大”“减小”或“不变”)
Ⅱ.利用图2装置进行中和热测定

(4)已知:①在量热计内筒先加入50mL0.50mol/L盐酸,再迅速一次性加入50mL0.55mol/LNaOH溶液;
②处理数据得到平均温度变化量Δt=3.2℃;
③Q=cmΔt。
设盐酸和NaOH溶液的密度均为1g·cm-3,反应后溶液的比热容c=4.18J/(g·℃)
请计算:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=________ kJ/mol(结果保留一位小数)。
(5)利用上述装置重新做实验,测得反应热ΔH偏大,其原因不可能是___________。

(1)装置甲中负极电极反应式为
(2)装置乙中X为
(3)粗铜中含有锌、银等杂质,丙装置电解一段时间后,硫酸铜溶液浓度将
Ⅱ.利用图2装置进行中和热测定

(4)已知:①在量热计内筒先加入50mL0.50mol/L盐酸,再迅速一次性加入50mL0.55mol/LNaOH溶液;
②处理数据得到平均温度变化量Δt=3.2℃;
③Q=cmΔt。
设盐酸和NaOH溶液的密度均为1g·cm-3,反应后溶液的比热容c=4.18J/(g·℃)
请计算:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=
(5)利用上述装置重新做实验,测得反应热ΔH偏大,其原因不可能是___________。
| A.将玻璃搅拌器改为铜质搅拌器 | B.改用0.45mol/L盐酸进行实验 |
| C.将NaOH溶液分批加入内筒 | D.杯盖未盖严 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。NiSO4·6H2O晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu2+、Zn2+、Fe2+等)为原料获得。操作步骤如图:
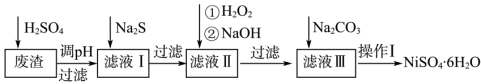
已知:Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.3×10-24,Ksp(NiS)=1.1×10-21,Fe(OH)3的Ksp=1.0×10-39。
(1)加入Na2S的目的是除去Zn2+,Cu2+,反应的离子方程式是____ 、____ 。
(2)滤液II中加入H2O2的目的是____ 。
(3)向滤液II中加入NaOH调节pH在一范围内生成氢化铁沉淀。若要使溶液中c(Fe3+)≤1.0×10-6mol·L-1,则应该控制溶液pH范围不小于____ 。
(4)加入Na2CO3的目的是沉淀Ni2+。Na2CO3溶液中离子浓度由大到小的顺序是____ 。
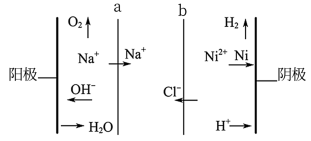
(5)双膜三室电解法处理含镍废水并回收金属镍的原理如图所示。判断a是____ (填“阳膜”或“阴膜”),阴极反应是____ 。

已知:Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.3×10-24,Ksp(NiS)=1.1×10-21,Fe(OH)3的Ksp=1.0×10-39。
(1)加入Na2S的目的是除去Zn2+,Cu2+,反应的离子方程式是
(2)滤液II中加入H2O2的目的是
(3)向滤液II中加入NaOH调节pH在一范围内生成氢化铁沉淀。若要使溶液中c(Fe3+)≤1.0×10-6mol·L-1,则应该控制溶液pH范围不小于
(4)加入Na2CO3的目的是沉淀Ni2+。Na2CO3溶液中离子浓度由大到小的顺序是
(5)双膜三室电解法处理含镍废水并回收金属镍的原理如图所示。判断a是

您最近一年使用:0次
【推荐3】绿水青山就是金山银山,保护生态环境、建设生态文明是历史发展的需要。氮氧化物易导致酸雨、光化学烟雾等环境问题,消除氮污染已成为人类共识,消除氮氧化物有多种方法:
(1)活性炭还原法。某研究小组向容积均为 2L 的甲(温度为 T1),乙(温度为 T2)两个 恒容密闭容器中充入足量的活性炭和 4mol 的 NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g),反应过程中两容器内 CO2的物质的量随时 间的变化关系如图所示。

①ΔH______ 0 (填“>”或“<”),判断的依据___________
②乙容器中反应达到平衡后,再充入 2molNO 和 2mol 的 CO2,此时 v(正)____________ v(逆)(填“>”或“<” 或“=”)。
(2)NH3催化还原法。NH3催化还原法的原理如图所示:

①若烟气中 c(NO2):c(NO)=1:1,发生如图 中所示的脱氮反应,反应过程中转移 2mol 电子时放出的热量为 151.7kJ,则该脱氮反应的热化学方程式为:_________
②如图所示是一定时间内,在不同温度下分别使用催化剂 Mn 和 Cr 时的脱氮率,由此可知工业上使用的最佳催化剂和相应最佳温度分别为________ ;使用 Mn 作催化剂时,脱氮率 a-b 段呈现如图 所示变化的原因可能是_________

(3)电化学法。用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示(质子膜允许 H+和 H2O 通过)

①图中电极 I 应该接电源的_________ (填“正极”或“负极”),该电极反应方程式为__________
②吸收塔中每产生 0.5mol HSO ,理论上处理 NO 在标准状况下的体积为
,理论上处理 NO 在标准状况下的体积为______ L
(1)活性炭还原法。某研究小组向容积均为 2L 的甲(温度为 T1),乙(温度为 T2)两个 恒容密闭容器中充入足量的活性炭和 4mol 的 NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g),反应过程中两容器内 CO2的物质的量随时 间的变化关系如图所示。

①ΔH
②乙容器中反应达到平衡后,再充入 2molNO 和 2mol 的 CO2,此时 v(正)
(2)NH3催化还原法。NH3催化还原法的原理如图所示:

①若烟气中 c(NO2):c(NO)=1:1,发生如图 中所示的脱氮反应,反应过程中转移 2mol 电子时放出的热量为 151.7kJ,则该脱氮反应的热化学方程式为:
②如图所示是一定时间内,在不同温度下分别使用催化剂 Mn 和 Cr 时的脱氮率,由此可知工业上使用的最佳催化剂和相应最佳温度分别为

(3)电化学法。用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示(质子膜允许 H+和 H2O 通过)

①图中电极 I 应该接电源的
②吸收塔中每产生 0.5mol HSO
 ,理论上处理 NO 在标准状况下的体积为
,理论上处理 NO 在标准状况下的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某研究性学习小组为探究影响钢铁生锈的因素,设计了如下方案:在四只小烧瓶中分别放入下列物质:A瓶,干燥的细铁丝;B瓶,浸过食盐水的细铁丝;C瓶,浸过清水的细铁丝;D瓶,食盐水及细铁丝,并使铁丝完全浸没在食盐水中。然后组装成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如表(表中所列数据为导管中水面上升的高度/cm)所示。
不同时间水面上升的高度
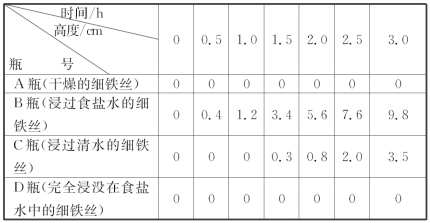
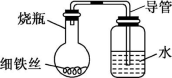
请回答下列问题:
(1)导管中水面上升的原因为_________________________________ 。
(2)上述实验中,细铁丝生锈的速率由大到小的顺序为(填小烧瓶号)____________________ 。
(3)影响钢铁生锈的因素主要有_________________________________ 。
(4)为防止铁的锈蚀,工业上普遍采用的方法有____________________ (答两种方法)。
不同时间水面上升的高度


请回答下列问题:
(1)导管中水面上升的原因为
(2)上述实验中,细铁丝生锈的速率由大到小的顺序为(填小烧瓶号)
(3)影响钢铁生锈的因素主要有
(4)为防止铁的锈蚀,工业上普遍采用的方法有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】填空。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知①2CH4(g)+ 3O2(g) = 2 CO(g)+ 4 H2O(l) △H1 = -1214.6 kJ/mol
②2 CO(g)+ O2(g) =2 CO2(g) ΔH2 = -566 kJ/mol
则反应CH4(g)+2O2(g) = CO2(g)+2H2O(l) 的△H=_______ 。
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:
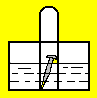
若液面上升,发生_______ 腐蚀(填“析氢”或“吸氧”),负极电极反应式:_______ ,正极电极反应式:_______
(3)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是_______ 。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知①2CH4(g)+ 3O2(g) = 2 CO(g)+ 4 H2O(l) △H1 = -1214.6 kJ/mol
②2 CO(g)+ O2(g) =2 CO2(g) ΔH2 = -566 kJ/mol
则反应CH4(g)+2O2(g) = CO2(g)+2H2O(l) 的△H=
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:

若液面上升,发生
(3)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是
您最近一年使用:0次
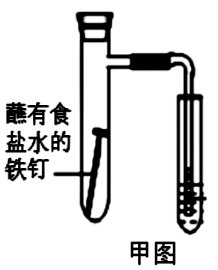
【推荐3】铜铁是目前人们使用量最大的合金材料,铁及其化合物也是人们日常生活中应用广泛的一类物质。回答下列问题:
(1)下图中铁钉发生的电化学腐蚀类型是________ ,负极反应式为__________ 。
(2)实验室配置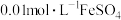 溶液时,需向溶液中滴加几滴稀硫酸,其目的是
溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________ , 溶液中离子浓度由大到小的顺序是
溶液中离子浓度由大到小的顺序是________ 。
(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾( )。其中
)。其中 的化合价是
的化合价是________ ,其净水过程中既表现出强氧化性,又表现了强吸附性,则 与水反应的离子方程式为
与水反应的离子方程式为__________ 。
(4)羰基铁酸[ ]是一种二元弱酸,其第一步电离方程式为
]是一种二元弱酸,其第一步电离方程式为__________ 。
(5)25℃时,向含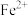 的溶液中加入一定量的
的溶液中加入一定量的 后,
后, 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的 ,
,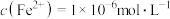 。通过计算判断所得的
。通过计算判断所得的 中是否含有
中是否含有 杂质:
杂质:________ (已知: ,
,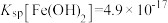 )
)
(1)下图中铁钉发生的电化学腐蚀类型是

(2)实验室配置
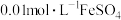 溶液时,需向溶液中滴加几滴稀硫酸,其目的是
溶液时,需向溶液中滴加几滴稀硫酸,其目的是 溶液中离子浓度由大到小的顺序是
溶液中离子浓度由大到小的顺序是(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾(
 )。其中
)。其中 的化合价是
的化合价是 与水反应的离子方程式为
与水反应的离子方程式为(4)羰基铁酸[
 ]是一种二元弱酸,其第一步电离方程式为
]是一种二元弱酸,其第一步电离方程式为(5)25℃时,向含
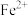 的溶液中加入一定量的
的溶液中加入一定量的 后,
后, 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的 ,
,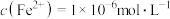 。通过计算判断所得的
。通过计算判断所得的 中是否含有
中是否含有 杂质:
杂质: ,
,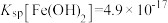 )
)
您最近一年使用:0次



