高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH>0
Fe(s)+CO2(g)ΔH>0
其平衡常数可表示为K=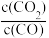 ,已知1100℃时K=0.263.化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
,已知1100℃时K=0.263.化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比___________ ,平衡常数K___________ 。(以上均填“增大”“减小”或“不变”)
(2)1100℃时测得高炉中c(CO2)=0.025mol·L-1、c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态:___________ (填“是”或“否”,若填“是”,则后面问题可不答),此时反应向___________ (填“正反应”或“逆反应”)方向进行,其原因是___________ 。
 Fe(s)+CO2(g)ΔH>0
Fe(s)+CO2(g)ΔH>0其平衡常数可表示为K=
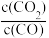 ,已知1100℃时K=0.263.化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
,已知1100℃时K=0.263.化学平衡常数只与温度有关,不随浓度和压强的变化而变化。(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比
(2)1100℃时测得高炉中c(CO2)=0.025mol·L-1、c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态:
2022高二·上海·专题练习 查看更多[2]
(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)上海市闵行中学2022-2023学年高二下学期期末(等级)考试化学试题
更新时间:2022-08-28 07:49:20
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】某种工业废水中含有一定量的Cr2O 和CrO
和CrO ,它们易被人体吸收积累而导致肝癌。
,它们易被人体吸收积累而导致肝癌。
I.污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
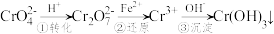
(1)已知第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
①Cr2O 中Cr的化合价是
中Cr的化合价是___________ 。
②常温下,若平衡体系的pH=12,则溶液显___________ 色。
(2)第②步发生反应的离子方程式为___________ 。
(3)往FeCl3+3KSCN 3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动
3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动___________ (向逆反应方向、向正反应方向、不移动)
II.取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,充分反应后滴入几滴淀粉作指示剂。
步骤Ⅲ:用0.1000mol·L-1的Na2S2O3溶液测定上面产生的碘单质。(I2+2Na2S2O3=2NaI+Na2S4O6)当溶液由蓝色变无色时为滴定终点,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL废水经酸化后,含有Cr2O 的物质的量为
的物质的量为___________ mol。
 和CrO
和CrO ,它们易被人体吸收积累而导致肝癌。
,它们易被人体吸收积累而导致肝癌。I.污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
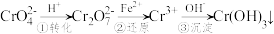
(1)已知第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O①Cr2O
 中Cr的化合价是
中Cr的化合价是②常温下,若平衡体系的pH=12,则溶液显
(2)第②步发生反应的离子方程式为
(3)往FeCl3+3KSCN
 3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动
3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动II.取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,充分反应后滴入几滴淀粉作指示剂。
步骤Ⅲ:用0.1000mol·L-1的Na2S2O3溶液测定上面产生的碘单质。(I2+2Na2S2O3=2NaI+Na2S4O6)当溶液由蓝色变无色时为滴定终点,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL废水经酸化后,含有Cr2O
 的物质的量为
的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】向某密闭容器中充入NO2气体,发生反应2NO2(g) N2O4(g):
N2O4(g):
(1)恒温恒压时,平衡后充入惰性气体,平衡___ 移动(填“正向”、“逆向”或“不”);
(2)平衡后慢慢压缩气体体积,平衡向右移动,混合气体颜色___ (填“加深”、“变浅”或“不变”);
(3)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2转化率为a,向体积为2L的恒压密闭容器中充入2molNO2,达到平衡状态时NO2转化率为b,则a__ b(填“>”、“<”或“=”);
(4)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2体积分数为a,再向该容器中继续充入1molN2O4,达到新平衡后NO2体积分数为b,则a__ b(填“>”、“<”或“=”)。
 N2O4(g):
N2O4(g):(1)恒温恒压时,平衡后充入惰性气体,平衡
(2)平衡后慢慢压缩气体体积,平衡向右移动,混合气体颜色
(3)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2转化率为a,向体积为2L的恒压密闭容器中充入2molNO2,达到平衡状态时NO2转化率为b,则a
(4)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2体积分数为a,再向该容器中继续充入1molN2O4,达到新平衡后NO2体积分数为b,则a
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】勒夏特列原理在生产生活中有许多重要应用。完成下列填空:
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止________________________ 。
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色) H++Z—(蓝色)。在中性溶液中。石蕊试液呈
H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________ 色;要使石蕊试液呈红色,可加入____________________________ 。
(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是_______________________ 。
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是_________ (选填编号)。
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)
 H++Z—(蓝色)。在中性溶液中。石蕊试液呈
H++Z—(蓝色)。在中性溶液中。石蕊试液呈(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】反应2HI(g) H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:

(1)实验1中,反应在0〜10 min内平均速率v(HI)为_______ mol·L-1·min-1。仔细分析上表数据可推知Q ______ 0 (填“>”“<”或“=”)。
(2)实验2中,HI的初始浓度c2为_____ mol·L-1.设平衡前实验1的平均反应速率为v1,平衡前实验3的平均反应速率为v3,则v1____ v3 (填“>”“<”或“=”),且 c3为________ mol·L-1。
 H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
(1)实验1中,反应在0〜10 min内平均速率v(HI)为
(2)实验2中,HI的初始浓度c2为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g) 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1
⑴该反应500℃时的平衡常数________ 450℃时的平衡常数(填“>”、“<”或“=”)。
⑵判断该反应达到平衡状态的标志是_______________ 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行的是_______________ 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO30.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡____________ 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______ mol。
2SO2(g)+O2(g)
 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1⑴该反应500℃时的平衡常数
⑵判断该反应达到平衡状态的标志是
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行的是
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO30.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】利用太阳能光解水,制备的H2用于还原CO2可以在一定条件下合成CH3OH(不考虑副反应),CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0,可实现资源的再利用。回答下列问题:
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3 a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为_______ 。
(2)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
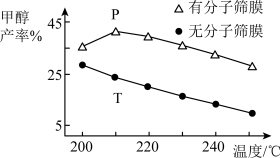
①甲醇平衡产率随温度升高而降低的原因为_______ 。
②P点甲醇产率高于T点的原因为_______ 。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为_______ °C。
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3 a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
(2)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为
您最近一年使用:0次



