某溶液由K+、Cu2+、Ba2+、Fe3+、CO 、SO
、SO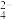 、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
③在②所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子_______ ;
(2)原溶液中一定存在的离子是_______ ;
(3)原溶液中可能存在的离子是_______ 。
(4)请写出①中发生反应的离子方程式_______
 、SO
、SO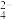 、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
、Cl-中的若干种离子组成,取适量该溶液进行如下实验:①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
③在②所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子
(2)原溶液中一定存在的离子是
(3)原溶液中可能存在的离子是
(4)请写出①中发生反应的离子方程式
更新时间:2022-10-15 09:59:43
|
相似题推荐
【推荐1】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,沸点为-5.5℃,遇水和潮气分解。请回答下列问题:
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制Cl2,Zn和稀HNO3制NO。
①制取NO的离子方程式为___________ 。
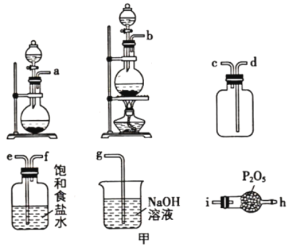
②选用如图甲所示的部分装置预制备一瓶干燥、纯净的氯气,各玻璃导管接口连接顺序为___________ (气流方向从左至右)。
(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如图乙所示:反应原理:NaNO2+2HCl=NOCl+NaCl+H2O。
制取装置图:
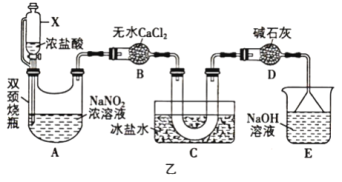
①仪器X为恒压分液漏斗,用它代替分液漏斗优点是___________ 。
②装置C的U形管中观察到的现象是___________ ,装置D的作用是___________ 。
(3)取少量产品NOCl滴入盛有水的试管中,液面方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为___________ 。
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制Cl2,Zn和稀HNO3制NO。
①制取NO的离子方程式为
②选用如图甲所示的部分装置预制备一瓶干燥、纯净的氯气,各玻璃导管接口连接顺序为

(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如图乙所示:反应原理:NaNO2+2HCl=NOCl+NaCl+H2O。
制取装置图:

①仪器X为恒压分液漏斗,用它代替分液漏斗优点是
②装置C的U形管中观察到的现象是
(3)取少量产品NOCl滴入盛有水的试管中,液面方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】某未知溶液中只可能大量存在下列离子: 、
、 、
、 、
、 、
、 、
、 。为探究其组成,某实验小组进行了以下实验:
。为探究其组成,某实验小组进行了以下实验:
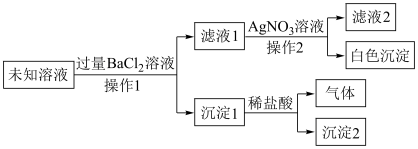
(1)写出“沉淀2”的化学式_______ 。
(2)“沉淀1”与稀盐酸反应的离子方程式为_______ 。
(3)原溶液中一定大量存在的离子是_______ ,一定不存在的离子是_______ ,可能存在的离子是_______ 。
(4)若检验溶液中是否存在铵根离子,可以向溶液中加入_______ 溶液(填化学式),再加热产生可使湿润的红色石蕊试纸变_______ (“红”或“蓝”)的气体。则证明溶液中存在铵根离子。反应的离子方程式为_______ 。
 、
、 、
、 、
、 、
、 、
、 。为探究其组成,某实验小组进行了以下实验:
。为探究其组成,某实验小组进行了以下实验:
(1)写出“沉淀2”的化学式
(2)“沉淀1”与稀盐酸反应的离子方程式为
(3)原溶液中一定大量存在的离子是
(4)若检验溶液中是否存在铵根离子,可以向溶液中加入
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
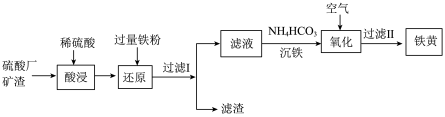
【推荐3】Ⅰ.以硫酸厂矿渣(含 Fe2O3、 α-Al2O3、SiO2等)为原料制备铁黄[FeO(OH)]的一种工艺流程如图所示:
资料:i. α-Al2O3化学性质极不活泼,不溶于水也不溶于酸或碱,γ-Al2O3不溶于水,可溶于强酸或强碱
ii.Ksp(CaCO3)=2.8×10-9;Ksp(FeCO3)=2×10-11;
(1)将mg 含 Fe2O3·nH2O的γ-Al2O3溶于 200mL pH=1 的硫酸溶液中,然后加入100mL 氨水,使溶液中的Fe3+和 Al3+恰好完全沉淀,则所加氨水的浓度为___________
(2)向“酸浸”后的溶液中加入KSCN,溶液会变红,变红过程发生的离子方程式是___________ 。
(3)“滤渣”中主要成分为(填化学式)___________ 。
(4)“沉铁”过程中铁元素大部分转化为 FeCO3,但往往有副产物 Fe(OH)2生成,分析原因是___________ 。
(5)若用 CaCO3“沉铁”, 则无副产物Fe(OH)2产生, 当反应完成时, 溶液中_____ 。
(6)下列物质中可以通过化合反应制备得到的是___________
(7)写出氧化过程生成铁黄的化学方程式___________ 。
Ⅱ.为确定“滤液”中Fe2+的物质的量浓度,选用 K2Cr2O7标准溶液滴定溶液中的 Fe2+,离子方程式为 (未配平)。
(未配平)。
(8)向滴定管中注入K2Cr2O7标准溶液前, 滴定管需要检漏、用蒸馏水洗涤和___________ 。
(9)若滴定 xmL“滤液”中的 Fe2+,消耗a mol/LK2Cr2O7标准溶液 bmL, 则滤液中c(Fe2+)=______ mol/L。

资料:i. α-Al2O3化学性质极不活泼,不溶于水也不溶于酸或碱,γ-Al2O3不溶于水,可溶于强酸或强碱
ii.Ksp(CaCO3)=2.8×10-9;Ksp(FeCO3)=2×10-11;
(1)将mg 含 Fe2O3·nH2O的γ-Al2O3溶于 200mL pH=1 的硫酸溶液中,然后加入100mL 氨水,使溶液中的Fe3+和 Al3+恰好完全沉淀,则所加氨水的浓度为___________
| A.0.2mol/L | B.0.1mol/L | C.0.05mol/L | D.0.02mol/L |
(2)向“酸浸”后的溶液中加入KSCN,溶液会变红,变红过程发生的离子方程式是
(3)“滤渣”中主要成分为(填化学式)
(4)“沉铁”过程中铁元素大部分转化为 FeCO3,但往往有副产物 Fe(OH)2生成,分析原因是
(5)若用 CaCO3“沉铁”, 则无副产物Fe(OH)2产生, 当反应完成时, 溶液中
(6)下列物质中可以通过化合反应制备得到的是___________
| A.FeCl2 | B.Fe(OH)2 | C.Fe(OH)3 | D.Fe2O3 |
(7)写出氧化过程生成铁黄的化学方程式
Ⅱ.为确定“滤液”中Fe2+的物质的量浓度,选用 K2Cr2O7标准溶液滴定溶液中的 Fe2+,离子方程式为
 (未配平)。
(未配平)。(8)向滴定管中注入K2Cr2O7标准溶液前, 滴定管需要检漏、用蒸馏水洗涤和
(9)若滴定 xmL“滤液”中的 Fe2+,消耗a mol/LK2Cr2O7标准溶液 bmL, 则滤液中c(Fe2+)=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】某强酸性溶液X,可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色,G为红褐色。回答下列问题:
中一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色,G为红褐色。回答下列问题:
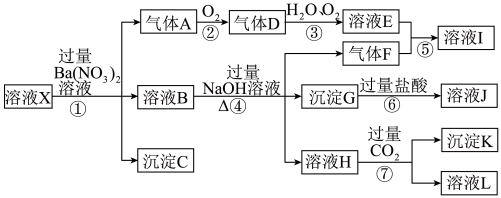
(1)由强酸性条件即可判断溶液X中一定不存在的离子有:___________ 用相应的离子方程式表示不存在的理由___________ ;
(2)产生气体A的离子方程式为___________ ;
(3)转化⑤产生I的化学方程式为___________ ;
(4)若转化③中,D、 、
、 三种物质恰好发生化合反应生成E,则反应中D与
三种物质恰好发生化合反应生成E,则反应中D与 的物质的量之比为
的物质的量之比为___________ ;用化学方程式表示浓溶液E保存方法原因___________
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色,G为红褐色。回答下列问题:
中一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色,G为红褐色。回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有:
(2)产生气体A的离子方程式为
(3)转化⑤产生I的化学方程式为
(4)若转化③中,D、
 、
、 三种物质恰好发生化合反应生成E,则反应中D与
三种物质恰好发生化合反应生成E,则反应中D与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】有甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、CO32-、SO42-中的不同阴、阳离子各一种组成,已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。
(1)它们的化学式分别为甲_________ 、乙_________ 、丁_________ 。
(2)写出甲溶液和丁溶液反应的离子方程式:_________________________ 。
(3)检验乙中阴离子所用试剂的名称是____________________ 。
(1)它们的化学式分别为甲
(2)写出甲溶液和丁溶液反应的离子方程式:
(3)检验乙中阴离子所用试剂的名称是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
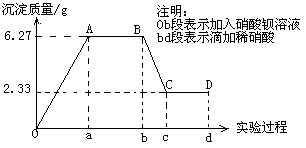
【推荐3】下列是某研究性学习小组对某无色水样成分的检测过程,已知该水样中只可能含有K+ 、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取了100ml水样进行实验:向水样中先滴加硝酸钡溶液,再滴加1mol·L-1硝酸,实验过程中沉淀质量与所加试剂量的关系变化如下图所示:
(1)观察知该水样中一定不含有的阳离子是________ 。
(2)水样中一定含有的阴离子是________ 其相应的物质的量比为________ 。
(3)试根据实验结果推测K+是否存在_______ (填“是”或“否”)若存在,其物质的量浓度的范围是______ mol·L-1(若不存在,则不必回答)。
(4)设计简单实验验证原水样中可能存在的离子_______________________________________________ (写出实验步骤、现象和结论)。
(1)观察知该水样中一定不含有的阳离子是
(2)水样中一定含有的阴离子是
(3)试根据实验结果推测K+是否存在
(4)设计简单实验验证原水样中可能存在的离子
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】在某钠盐溶液中,除 之外可能还含有等物质的量的下列阴离子中的一种或多种:
之外可能还含有等物质的量的下列阴离子中的一种或多种: 、
、 、
、 、
、 、
、 、
、 。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
(1)原溶液中是否有
_______ (填“有”或“没有”),
(2)生成的气体中一定有_______ ,它具有的性质是_______ (填字母序号)。
A、无色无味 B、无色有刺激性气味 C、属于大气污染物 D、难溶于水 E、能被NaOH溶液吸收
(3)溶液中减少的离子是_______ ,原因是_______ ,_______ (用2个离子方程式表示)。
(4)原溶液中除了减少的3种离子可能还含有的阴离子是_______ 。
 之外可能还含有等物质的量的下列阴离子中的一种或多种:
之外可能还含有等物质的量的下列阴离子中的一种或多种: 、
、 、
、 、
、 、
、 、
、 。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。(1)原溶液中是否有

(2)生成的气体中一定有
A、无色无味 B、无色有刺激性气味 C、属于大气污染物 D、难溶于水 E、能被NaOH溶液吸收
(3)溶液中减少的离子是
(4)原溶液中除了减少的3种离子可能还含有的阴离子是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有1L的无色溶液可能含有阳离子是K+、Cu2+、Ca2+,含有的阴离子可能Cl﹣、CO32-、SO42- 现做以下实验:
①取50ml的溶液在大烧杯中加入中,向溶液中加入过量的BaCl2溶液振荡,有白色沉淀生成;过滤,干燥,烘干后得4.30g固体
②将所得白色固体配成悬浊液后加入过量稀硝酸,白色沉淀部分消失,并有气泡产生;将剩余固体过滤干燥后称量得到2.33g
③取少量①实验后上层清液滴入AgNO3溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原溶液中肯定不含有______________ ,一定含有______________ 可能含有____________ ,请设计方案证明:_______________________ 。
(2)写出一定发生的离子方程式:_______________________ ,___________________ ,__________________ 。
(3)若经证明没有Cl﹣则该溶液中的K+的物质的量浓度是:_____________________ 。
①取50ml的溶液在大烧杯中加入中,向溶液中加入过量的BaCl2溶液振荡,有白色沉淀生成;过滤,干燥,烘干后得4.30g固体
②将所得白色固体配成悬浊液后加入过量稀硝酸,白色沉淀部分消失,并有气泡产生;将剩余固体过滤干燥后称量得到2.33g
③取少量①实验后上层清液滴入AgNO3溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原溶液中肯定不含有
(2)写出一定发生的离子方程式:
(3)若经证明没有Cl﹣则该溶液中的K+的物质的量浓度是:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】Ⅰ、A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:
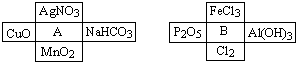
请回答下列问题:
(1)A溶液与B溶液反应的离子方程式______ .
(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为______
(3)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是:______ .
Ⅱ、在Na+浓度为0.6mol/L的某澄清溶液中,还可能含有表中的若干种离子:
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
试回答下列问题:
(1)实验I中生成沉淀的离子方程式为______ 。
(2)实验Ⅱ中判断沉淀是否洗涤干净的操作为:______ 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,判断K+______ 一定存在(填“是”或“否”),若存在,其最小浓度为______ 。(若不存在,此空不需填写)

请回答下列问题:
(1)A溶液与B溶液反应的离子方程式
(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为
(3)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是:
Ⅱ、在Na+浓度为0.6mol/L的某澄清溶液中,还可能含有表中的若干种离子:
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SO42-、SiO32- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验I中生成沉淀的离子方程式为
(2)实验Ⅱ中判断沉淀是否洗涤干净的操作为:
(3)通过实验I、Ⅱ、Ⅲ和必要计算,判断K+
您最近一年使用:0次



