碳酸氢钠属于抗酸药,用于碱化尿液及酸血症,也可用于胃酸过多,在潮湿空气中缓缓分解。某化学小组用如下方法对某品牌碳酸氢钠片中的含量进行了探究(可能含有少量Na2CO3,药品中不含干扰测定的物质)。
【鉴别】
a.取铂丝,用盐酸湿润后,蘸取药品粉末,在无色火焰中燃烧,火焰显黄色。
b.向本品水溶液中加盐酸产生泡沸现象。
【检查】配置药品质量分数为0.8%的水溶液,测pH为8.3。
【含量测定】小组采用滴定法进行含量测定:
I.用已准确称量的药品固体ag配制一定体积的溶液VmL。(此时主要溶质为NaHCO3和少量Na2CO3)
II.取V1mL上述溶液于锥形瓶中,加入酚酞指示剂2—3滴。
III.用1mol/L盐酸标准溶液滴定II中溶液至第一终点时,消耗盐酸溶液V2mL。 (此时溶质为NaCl和NaHCO3)
IV.再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,又消耗盐酸溶液V3mL。
已知:H2CO3的电离平衡常数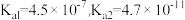 ;
;
常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色、8.2<pH<10浅红色、pH>10红色
甲基橙:pH<3.1红色、3.1<pH<4.4橙色、pH>4.4黄色
(1)请写出“鉴别”中产生泡沸现象主要反应的离子反应方程式:_______ 。
(2)请结合化学用语解释“检查”中水溶液pH为8.3的主要原因(不考虑杂质影响):_______ 。
(3)“含量测定”的步骤I中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和_______ 。
(4)滴定过程中应选择如图所示滴定管_______ (填字母)。

(5)步骤V中第二步滴定用甲基橙滴定至终点的现象是由_______ 色变为橙色。
(6)药品中碳酸氢钠的质量分数为_______ 。(碳酸氢钠摩尔质量: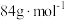 )
)
【鉴别】
a.取铂丝,用盐酸湿润后,蘸取药品粉末,在无色火焰中燃烧,火焰显黄色。
b.向本品水溶液中加盐酸产生泡沸现象。
【检查】配置药品质量分数为0.8%的水溶液,测pH为8.3。
【含量测定】小组采用滴定法进行含量测定:
I.用已准确称量的药品固体ag配制一定体积的溶液VmL。(此时主要溶质为NaHCO3和少量Na2CO3)
II.取V1mL上述溶液于锥形瓶中,加入酚酞指示剂2—3滴。
III.用1mol/L盐酸标准溶液滴定II中溶液至第一终点时,消耗盐酸溶液V2mL。 (此时溶质为NaCl和NaHCO3)
IV.再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,又消耗盐酸溶液V3mL。
已知:H2CO3的电离平衡常数
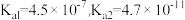 ;
;常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色、8.2<pH<10浅红色、pH>10红色
甲基橙:pH<3.1红色、3.1<pH<4.4橙色、pH>4.4黄色
(1)请写出“鉴别”中产生泡沸现象主要反应的离子反应方程式:
(2)请结合化学用语解释“检查”中水溶液pH为8.3的主要原因(不考虑杂质影响):
(3)“含量测定”的步骤I中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和
(4)滴定过程中应选择如图所示滴定管

(5)步骤V中第二步滴定用甲基橙滴定至终点的现象是由
(6)药品中碳酸氢钠的质量分数为
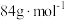 )
)
更新时间:2022-11-04 20:52:01
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】有A、B、C、D四种物质的溶液,在进行焰色反应时,都呈黄色,它们之间可发生如图所示的变化。
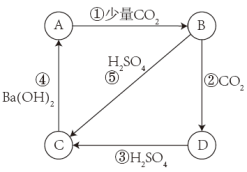
(1)这四种物质分别为A_______ ;B_______ ;C_______ ;D_______ 。
(2)写出有关反应的化学方程式:
①_______
②_______
④_______

(1)这四种物质分别为A
(2)写出有关反应的化学方程式:
①
②
④
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】纯碱在纺织、肥皂、造纸、玻璃、火药等行业有着广泛的应用,人类在制碱方法的工业化道路上不断探索。
I.已知:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。某化学小组用如图装置进行模拟实验。
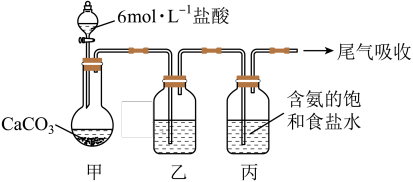
(1)装置乙中盛放的是_____ ,其作用是_____ (用化学方程式表示)。
(2)装置丙需控制温度在30~35℃,温度不宜过高的原因是_____ 。
(3)装置内中产生NaHCO3沉淀,经过滤、洗涤、灼烧,可以得到Na2CO3,其中检验NaHCO3洗涤干净的操作是_____ 。
Ⅱ.我国近代化学工业的奠基人侯德榜先生,设计出“联合制碱法”,提高了食盐的转化率,缩短了生产流程,减少了对环境的污染,工艺流程如图:
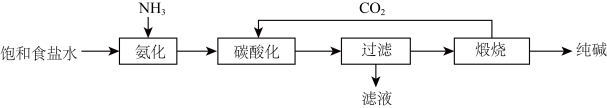
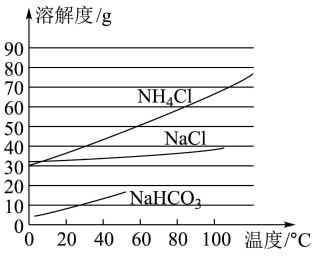
已知:
①在101kPa时,NH3、CO2的溶解度(气体的压力为101kPa时溶解在1体积水中并换算成标准状况下的气体体积数)如表,部分盐的溶解度曲线如图,②温度高于60℃时,NaHCO3开始分解。
试回答下列问题:
(4)流程中先“氨化”再“碳酸化”的原因是_____ 。
(5)“侯氏制碱法”所得NH4Cl样品中含有少量的NaCl和NaHCO3,请设计实验方案提纯NH4Cl样品:将NH4Cl样品溶解于水,_____ ,冰水洗涤,低温干燥(实验中必须用到的试剂:盐酸)。
I.已知:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。某化学小组用如图装置进行模拟实验。

(1)装置乙中盛放的是
(2)装置丙需控制温度在30~35℃,温度不宜过高的原因是
(3)装置内中产生NaHCO3沉淀,经过滤、洗涤、灼烧,可以得到Na2CO3,其中检验NaHCO3洗涤干净的操作是
Ⅱ.我国近代化学工业的奠基人侯德榜先生,设计出“联合制碱法”,提高了食盐的转化率,缩短了生产流程,减少了对环境的污染,工艺流程如图:

已知:
①在101kPa时,NH3、CO2的溶解度(气体的压力为101kPa时溶解在1体积水中并换算成标准状况下的气体体积数)如表,部分盐的溶解度曲线如图,②温度高于60℃时,NaHCO3开始分解。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 气体在水中的溶解度 | NH3 | 1130 | 870 | 680 | 530 | 400 | 290 | 200 |
| CO2 | 1.713 | 1.194 | 0.878 | 0.665 | 0.530 | 0.436 | 0.359 | |

试回答下列问题:
(4)流程中先“氨化”再“碳酸化”的原因是
(5)“侯氏制碱法”所得NH4Cl样品中含有少量的NaCl和NaHCO3,请设计实验方案提纯NH4Cl样品:将NH4Cl样品溶解于水,
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】某强碱性溶液可能含有的离子是K+、NH 、A13+、A1O
、A13+、A1O 、SO
、SO 、SiO
、SiO 、CO
、CO 、Cl—中的某几种离子,现进行如下实验:
、Cl—中的某几种离子,现进行如下实验:
I.取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
II.另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_________ ,肯定不存在的离子是_________ 。
(2)已知一定量的原溶液中加入5mL0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl—?______
(3)按照反应顺序逐步书写出II中发生反应的离子反应方程式
①__________________ ;②______________________ ;
③__________________ ;④______________________ ;
⑤_____________ 。
 、A13+、A1O
、A13+、A1O 、SO
、SO 、SiO
、SiO 、CO
、CO 、Cl—中的某几种离子,现进行如下实验:
、Cl—中的某几种离子,现进行如下实验:I.取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
II.另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是
(2)已知一定量的原溶液中加入5mL0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl—?
(3)按照反应顺序逐步书写出II中发生反应的离子反应方程式
①
③
⑤
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】亚硝酸钠(NaNO2)用途很广泛:可制药;作食品防腐剂、显色剂;作印染工业的媒染剂、漂白剂、缓蚀剂等。某兴趣小组欲制备亚硝酸钠并进行实验探究,查阅资料可知:
①Na2O2+2NO=2NaNO2;②Na2O2+2NO2=2NaNO3;③NO可被酸性KMnO4氧化成 。
。
【制备NaNO2】装置如图:
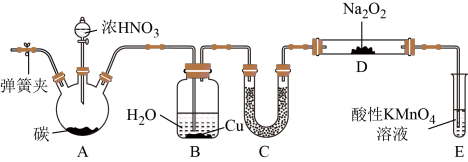
(1)Na2O2是___________ (填“共价化合物”或“离子化合物”)。
(2)U形管C中的试剂可以是___________ 。
(3)试管E中反应的离子方程式为___________ 。
(4)以上装置有设计缺陷,会使产品中杂质增多。改进方法是___________ 。
【测定某NaNO2样品纯度】
(5)①称量0.5000 g某NaNO2样品(假设杂质不反应),溶于水配成500 mL溶液。
②取25.00 mL待测液于锥形瓶中,加入足量KI酸性溶液,滴入2~3滴淀粉溶液。
③取一支______ (填“酸”或“碱”)式滴定管用蒸馏水洗净后,用0.0100 mol/L Na2S2O3溶液润洗,装液,排出下端尖嘴内的气泡,调整液面,记下读数。
④进行滴定,记录读数。重复实验后,平均消耗Na2S2O3溶液的体积为30.00 mL。(已知:2 +2I-+4H+=2NO+I2+2H2O;2Na2S2O3+I2=2NaI+Na2S4O6)。
+2I-+4H+=2NO+I2+2H2O;2Na2S2O3+I2=2NaI+Na2S4O6)。
(6)样品中NaNO2的质量分数为___________ 。
(7)下列情况可能会使测得的NaNO2纯度偏低的是___________(填标号)。
①Na2O2+2NO=2NaNO2;②Na2O2+2NO2=2NaNO3;③NO可被酸性KMnO4氧化成
 。
。【制备NaNO2】装置如图:
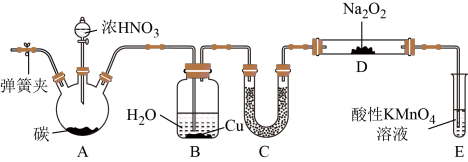
(1)Na2O2是
(2)U形管C中的试剂可以是
(3)试管E中反应的离子方程式为
(4)以上装置有设计缺陷,会使产品中杂质增多。改进方法是
【测定某NaNO2样品纯度】
(5)①称量0.5000 g某NaNO2样品(假设杂质不反应),溶于水配成500 mL溶液。
②取25.00 mL待测液于锥形瓶中,加入足量KI酸性溶液,滴入2~3滴淀粉溶液。
③取一支
④进行滴定,记录读数。重复实验后,平均消耗Na2S2O3溶液的体积为30.00 mL。(已知:2
 +2I-+4H+=2NO+I2+2H2O;2Na2S2O3+I2=2NaI+Na2S4O6)。
+2I-+4H+=2NO+I2+2H2O;2Na2S2O3+I2=2NaI+Na2S4O6)。(6)样品中NaNO2的质量分数为
(7)下列情况可能会使测得的NaNO2纯度偏低的是___________(填标号)。
| A.操作②中使用的锥形瓶未干燥 |
| B.操作③中未排尽下端尖嘴内的气泡 |
| C.操作④当滴入半滴Na2S2O3溶液,溶液由蓝色变为无色时,立即停止滴定 |
| D.整个滴定操作过慢,用时过长 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】滴定常用来定同分析,在科研、实验、工农业生产、环保等方面应用广泛。回答下列问题:
Ⅰ.现称取 某品牌奶粉利用凯氏定氮法和滴定法测其含氮量,其原理是在高温浓硫酸的作用下,将样品中的有机氮转化为无机铵盐,冷却后加入过量的碱,再将氨蒸出后用一定量水充分吸收,最后利用标准酸溶液滴定吸收液,推算样品中的含氮量。
某品牌奶粉利用凯氏定氮法和滴定法测其含氮量,其原理是在高温浓硫酸的作用下,将样品中的有机氮转化为无机铵盐,冷却后加入过量的碱,再将氨蒸出后用一定量水充分吸收,最后利用标准酸溶液滴定吸收液,推算样品中的含氮量。
(1)向酸式滴定管中注入标准盐酸之前的一步操作为_______ 。
(2)用甲基橙作指示剂,用标准盐酸滴定吸收液,终点现象为_______ 。
(3)滴定全部吸收液,消耗 盐酸VmL,则样品中氮元素的质量分数为
盐酸VmL,则样品中氮元素的质量分数为_______ 。(用含m、c、V的代数式表示)。
Ⅱ.某化学兴趣小组利用滴定原理测定无水碱式氯化铜 [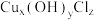 ]组成实验如下:
]组成实验如下:
①溶解:称取产品 ,加稀硝酸溶解,并加水定容至
,加稀硝酸溶解,并加水定容至 ,得到待测液。
,得到待测液。
②铜的测定:取 待测液,加入足量稀的氢氧化钠溶液,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为
待测液,加入足量稀的氢氧化钠溶液,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为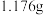 。
。
③沉淀滴定法测定氯,步骤如下:
a.准确量取 待测液于雉形瓶中,加入
待测液于雉形瓶中,加入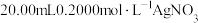 溶液,充分反应;
溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用 标准溶液滴定过量的
标准溶液滴定过量的 溶液;
溶液;
d.重复实验操作三次,消耗 溶液的体积平均为
溶液的体积平均为 。已知
。已知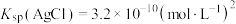 ,
,
(4)滴定可选用的指示剂是_______(填标号)。
(5)步骤b加入硝基苯的作用_______ ,如果不加硝基苯,则导致所测含氯量_______ (填“偏大”、“偏小”或“不变”)。
(6)根据上述实验结果可推知该碱式氯化铜的化学式为_______ 。
Ⅰ.现称取
 某品牌奶粉利用凯氏定氮法和滴定法测其含氮量,其原理是在高温浓硫酸的作用下,将样品中的有机氮转化为无机铵盐,冷却后加入过量的碱,再将氨蒸出后用一定量水充分吸收,最后利用标准酸溶液滴定吸收液,推算样品中的含氮量。
某品牌奶粉利用凯氏定氮法和滴定法测其含氮量,其原理是在高温浓硫酸的作用下,将样品中的有机氮转化为无机铵盐,冷却后加入过量的碱,再将氨蒸出后用一定量水充分吸收,最后利用标准酸溶液滴定吸收液,推算样品中的含氮量。(1)向酸式滴定管中注入标准盐酸之前的一步操作为
(2)用甲基橙作指示剂,用标准盐酸滴定吸收液,终点现象为
(3)滴定全部吸收液,消耗
 盐酸VmL,则样品中氮元素的质量分数为
盐酸VmL,则样品中氮元素的质量分数为Ⅱ.某化学兴趣小组利用滴定原理测定无水碱式氯化铜 [
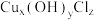 ]组成实验如下:
]组成实验如下:①溶解:称取产品
 ,加稀硝酸溶解,并加水定容至
,加稀硝酸溶解,并加水定容至 ,得到待测液。
,得到待测液。②铜的测定:取
 待测液,加入足量稀的氢氧化钠溶液,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为
待测液,加入足量稀的氢氧化钠溶液,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为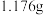 。
。③沉淀滴定法测定氯,步骤如下:
a.准确量取
 待测液于雉形瓶中,加入
待测液于雉形瓶中,加入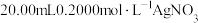 溶液,充分反应;
溶液,充分反应;b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用
 标准溶液滴定过量的
标准溶液滴定过量的 溶液;
溶液;d.重复实验操作三次,消耗
 溶液的体积平均为
溶液的体积平均为 。已知
。已知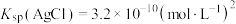 ,
,
(4)滴定可选用的指示剂是_______(填标号)。
A. | B. | C. | D. |
(6)根据上述实验结果可推知该碱式氯化铜的化学式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:

已知:①稀土离子易与 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:
发生反应: ;
;
②硫脲: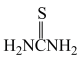 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是___________ (填写化学式)。
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式___________ 。
(3)焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是______ 。
(4)加入硫脲的目的是将CeF22+还原为Ce3+,反应的离子方程式为___________ 。
(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为___________ 。
(6)下列关于步骤④的说法正确的是___________(填字母)。
(7)取所得产品7.00gCeO2溶解后配成250mL溶液。取25.00mL该溶液用0.20mol。L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,滴定时发生反应 ,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为___________ 。(保留三位有效数字)。

已知:①稀土离子易与
 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:
发生反应: ;
;②硫脲:
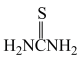 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式
(3)焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是
(4)加入硫脲的目的是将CeF22+还原为Ce3+,反应的离子方程式为
(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(6)下列关于步骤④的说法正确的是___________(填字母)。
A.该步骤发生的反应是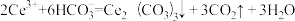 |
| B.可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度 |
| C.过滤时选择减压过滤能够大大提高过滤效率 |
| D.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率 |
(7)取所得产品7.00gCeO2溶解后配成250mL溶液。取25.00mL该溶液用0.20mol。L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,滴定时发生反应
 ,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】氯化铁常用于污水处理、印染工业、电子工业等领域。氯化铁易升华、易潮解,某化学兴趣小组设计实验制备氯化铁并探究其性质,回答下列问题:
Ⅰ.制备 固体。
固体。
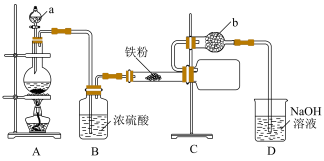
(1)仪器 的名称是
的名称是___________ ,仪器 中的试剂是
中的试剂是___________ 。
(2)装置 用浓盐酸和
用浓盐酸和 固体反应制备氯气,其反应的化学方程式为
固体反应制备氯气,其反应的化学方程式为___________ 。
(3)上述装置中有一处明显错误是___________ 。
Ⅱ.探究影响 水解平衡的因素。
水解平衡的因素。
提出假设:外界条件改变, 溶液水解平衡会发生移动
溶液水解平衡会发生移动
设计方案并完成实验
实验1:探究稀释 溶液对水解平衡移动的影响
溶液对水解平衡移动的影响
将 溶液分别稀释10倍和100倍,测定
溶液分别稀释10倍和100倍,测定 :
:
(4)实验证明稀释 溶液,水解平衡正向移动,结合表中数据,给出判断理由:
溶液,水解平衡正向移动,结合表中数据,给出判断理由:_______ 。
(5)计算实验ⅱ中 的水解度(转化率)为
的水解度(转化率)为______ (只列出计算式,忽略水自身电离的影响)。
实验2:探究温度对水解平衡移动的影响
已知: 水解程度越大,其溶液颜色越深,透光率越低。
水解程度越大,其溶液颜色越深,透光率越低。
分别将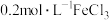 溶液和
溶液和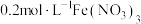 溶液持续加热,当温度上升至
溶液持续加热,当温度上升至 时停止加热,让溶液自然冷却,测定该过程中溶液透光率的变化,实验结果如下图:
时停止加热,让溶液自然冷却,测定该过程中溶液透光率的变化,实验结果如下图:

(6)结合图像分析,小组推测 溶液颜色(透光率)随温度变化的改变并不一定是仅由水解平衡所致,理由是
溶液颜色(透光率)随温度变化的改变并不一定是仅由水解平衡所致,理由是________ 。
查阅资料:溶液中存在配位平衡: (黄色);
(黄色); 不与
不与 配位,
配位, 稀溶液接近无色。
稀溶液接近无色。
优化实验与实验结论:向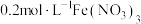 溶液(黄色)中,加入适量
溶液(黄色)中,加入适量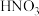 溶液酸化,溶液颜色变为无色,加热和降温过程中溶液透光率均无明显变化,对照图2,可证明酸化条件下,温度对
溶液酸化,溶液颜色变为无色,加热和降温过程中溶液透光率均无明显变化,对照图2,可证明酸化条件下,温度对 的水解平衡影响不大。
的水解平衡影响不大。
(7)上述实验中加入适量 溶液的目的是
溶液的目的是_______ ;请参考上述实验,设计实验证明 溶液颜色(透光率)随温度变化的改变与配位平衡的移动有关,简述实验方案并预测实验现象:
溶液颜色(透光率)随温度变化的改变与配位平衡的移动有关,简述实验方案并预测实验现象:___________ 。
Ⅰ.制备
 固体。
固体。
(1)仪器
 的名称是
的名称是 中的试剂是
中的试剂是(2)装置
 用浓盐酸和
用浓盐酸和 固体反应制备氯气,其反应的化学方程式为
固体反应制备氯气,其反应的化学方程式为(3)上述装置中有一处明显错误是
Ⅱ.探究影响
 水解平衡的因素。
水解平衡的因素。提出假设:外界条件改变,
 溶液水解平衡会发生移动
溶液水解平衡会发生移动设计方案并完成实验
实验1:探究稀释
 溶液对水解平衡移动的影响
溶液对水解平衡移动的影响将
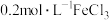 溶液分别稀释10倍和100倍,测定
溶液分别稀释10倍和100倍,测定 :
:| 实验序号 |  |  |
| ⅰ | 0.2 | 1.39 |
| ⅱ | 0.02 | 2.10 |
| ⅲ | 0.002 | 2.74 |
(4)实验证明稀释
 溶液,水解平衡正向移动,结合表中数据,给出判断理由:
溶液,水解平衡正向移动,结合表中数据,给出判断理由:(5)计算实验ⅱ中
 的水解度(转化率)为
的水解度(转化率)为实验2:探究温度对水解平衡移动的影响
已知:
 水解程度越大,其溶液颜色越深,透光率越低。
水解程度越大,其溶液颜色越深,透光率越低。分别将
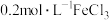 溶液和
溶液和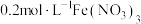 溶液持续加热,当温度上升至
溶液持续加热,当温度上升至 时停止加热,让溶液自然冷却,测定该过程中溶液透光率的变化,实验结果如下图:
时停止加热,让溶液自然冷却,测定该过程中溶液透光率的变化,实验结果如下图:
(6)结合图像分析,小组推测
 溶液颜色(透光率)随温度变化的改变并不一定是仅由水解平衡所致,理由是
溶液颜色(透光率)随温度变化的改变并不一定是仅由水解平衡所致,理由是查阅资料:溶液中存在配位平衡:
 (黄色);
(黄色); 不与
不与 配位,
配位, 稀溶液接近无色。
稀溶液接近无色。优化实验与实验结论:向
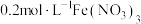 溶液(黄色)中,加入适量
溶液(黄色)中,加入适量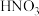 溶液酸化,溶液颜色变为无色,加热和降温过程中溶液透光率均无明显变化,对照图2,可证明酸化条件下,温度对
溶液酸化,溶液颜色变为无色,加热和降温过程中溶液透光率均无明显变化,对照图2,可证明酸化条件下,温度对 的水解平衡影响不大。
的水解平衡影响不大。(7)上述实验中加入适量
 溶液的目的是
溶液的目的是 溶液颜色(透光率)随温度变化的改变与配位平衡的移动有关,简述实验方案并预测实验现象:
溶液颜色(透光率)随温度变化的改变与配位平衡的移动有关,简述实验方案并预测实验现象:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ.磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有___________ 。
(2)磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4___________ H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,___________
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:___________ 。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:___________ 。
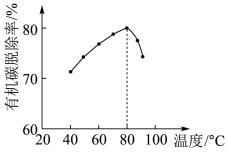
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO 残留,原因是
残留,原因是___________ ;加入BaCO3可进一步提高硫的脱除率,其离子方程式是___________ 。
(6)所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用NaOH溶液滴定至终点时生成Na2HPO4,计算精制磷酸中H3PO4的质量分数需要的实验数据有___________ 。
Ⅱ.[CuI2]-(无色)水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。查阅资料,2Cu2+ + 4I- = 2CuI↓ + I2,[Cu(NH3)2]+(无色)容易被空气氧化。
(7)用离子方程式解释该无色溶液中发生的变化:___________ ,___________ 。
Ⅲ.测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
(8)下列说法不正确 的是___________。

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有
(2)磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4
 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4①该反应体现出酸性关系:H3PO4
②结合元素周期律解释①中结论:P和S电子层数相同,
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO
 残留,原因是
残留,原因是(6)所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用NaOH溶液滴定至终点时生成Na2HPO4,计算精制磷酸中H3PO4的质量分数需要的实验数据有
Ⅱ.[CuI2]-(无色)水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。查阅资料,2Cu2+ + 4I- = 2CuI↓ + I2,[Cu(NH3)2]+(无色)容易被空气氧化。
(7)用离子方程式解释该无色溶液中发生的变化:
Ⅲ.测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
| 时刻 | ① | ② | ③ | ④ |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
(8)下列说法
| A.①与④的Kw值相等 |
B.④的pH与①不同,是由于 浓度减小造成的 浓度减小造成的 |
C.Na2SO3溶液中存在水解平衡: +H2O +H2O HSO HSO +OH− +OH− |
| D.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。
(1)常温下,几种物质的电离平衡常数如下表所示,回答下列问题:
①写出 溶液电荷守恒表达式
溶液电荷守恒表达式___________ 。
②等体积、等浓度 溶液和
溶液和 溶液中离子总数前者
溶液中离子总数前者___________ 后者(填“>”“<”或“=”)。
③ 时,
时, 溶液的
溶液的
___________ 7(填“<”“>”或“=”)。
(2)已知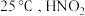 的
的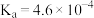 。亚硫酸电离常数为
。亚硫酸电离常数为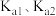 ,改变
,改变 亚硫酸溶液的
亚硫酸溶液的 ,其平衡体系中
,其平衡体系中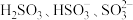 的物质的量分数
的物质的量分数 与
与 的关系如图所示。
的关系如图所示。
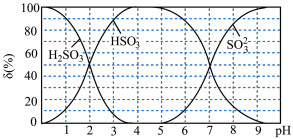
①将少量 通入
通入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为___________ 。
②下列叙述错误的是___________
A.当溶液的 时,硫元素的主要存在形式为
时,硫元素的主要存在形式为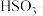
B.当溶液 时:
时: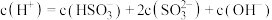
C. 的
的 溶液中存在:
溶液中存在: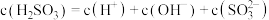
D.向 的上述溶液中滴加少量稀硫酸,
的上述溶液中滴加少量稀硫酸,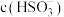 减小
减小
(3)联氨(又称肼, 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似 ,联氨第一步电离反应的平衡常数值为
,联氨第一步电离反应的平衡常数值为___________ (已知: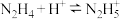 的
的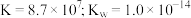 )。联氨与硫酸形成的酸式盐的化学式为
)。联氨与硫酸形成的酸式盐的化学式为___________ 。
(1)常温下,几种物质的电离平衡常数如下表所示,回答下列问题:
| 化学式 |  |  |  |
| 电离平衡常数 |  |  | 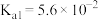 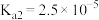 |
 溶液电荷守恒表达式
溶液电荷守恒表达式②等体积、等浓度
 溶液和
溶液和 溶液中离子总数前者
溶液中离子总数前者③
 时,
时, 溶液的
溶液的
(2)已知
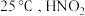 的
的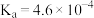 。亚硫酸电离常数为
。亚硫酸电离常数为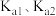 ,改变
,改变 亚硫酸溶液的
亚硫酸溶液的 ,其平衡体系中
,其平衡体系中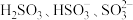 的物质的量分数
的物质的量分数 与
与 的关系如图所示。
的关系如图所示。
①将少量
 通入
通入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为②下列叙述错误的是
A.当溶液的
 时,硫元素的主要存在形式为
时,硫元素的主要存在形式为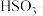
B.当溶液
 时:
时: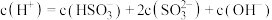
C.
 的
的 溶液中存在:
溶液中存在: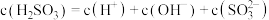
D.向
 的上述溶液中滴加少量稀硫酸,
的上述溶液中滴加少量稀硫酸,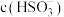 减小
减小(3)联氨(又称肼,
 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似 ,联氨第一步电离反应的平衡常数值为
,联氨第一步电离反应的平衡常数值为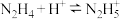 的
的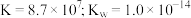 )。联氨与硫酸形成的酸式盐的化学式为
)。联氨与硫酸形成的酸式盐的化学式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
I.合成该物质的步骤如下:
步骤1: 配制200 mL 0.5 mol·L-1 MgSO4溶液和400 mL0.5 mol·L-1 NH4HCO3溶液;
步骤2: 将所配NH4HCO3溶液倒入四口烧瓶中,控制温度50℃,边搅拌边把所配MgSO4溶液于1 min内逐滴加入NH4HCO3溶液中,然后用氨水调节溶液pH至9.5;
步骤3: 放置1h后,过滤、洗涤、干燥得碳酸镁晶须产品(MgCO3•nH2O,n=1~5)。
(1)步骤1中配制400 mL 0.5 mol·L-1 NH4HCO3溶液所需玻璃仪器除烧杯、玻璃棒、胶头滴管和量筒外,还有___________ 。
(2)①步骤2中应采取的较好加热的方法为___________ ;
②根据上述实验药品的用量,四口烧瓶的最适宜规格为___________ (填标号)。
A.250 mL B.500 mL C.1000 mL D.2000 mL
③生成MgCO3•nH2O的离子方程式为___________ 。
II.测定合成的MgCO3∙nH2O中的n值:
方法1:称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被过量的NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30℃,最后,烧杯中的溶液加足量氯化钡溶液后过滤,用已知浓度的盐酸滴定过滤后溶液至中性,从而测得CO2的总量;重复上述操作2次。
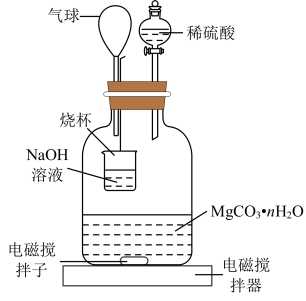
(3)图中气球的作用是___________ 。
(4)设NaOH溶液为a mol·L-1 b mL。3次实验测得消耗c mol·L-1盐酸的体积平均值为d mL,则n值为___________ (用含a、b、c、d的代数式表示)。
方法2:用热重分析法测定合成的MgCO3·nH2O中的n值。称取100 g上述晶须产品进行热重分析, 热重曲线如图。
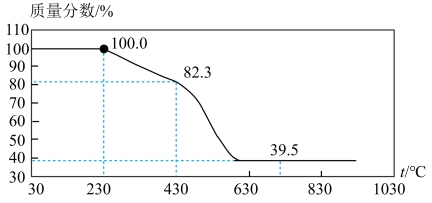
(5)如果测得n=1,则230℃~430℃发生的化学反应的方程式为___________ 。
I.合成该物质的步骤如下:
步骤1: 配制200 mL 0.5 mol·L-1 MgSO4溶液和400 mL0.5 mol·L-1 NH4HCO3溶液;
步骤2: 将所配NH4HCO3溶液倒入四口烧瓶中,控制温度50℃,边搅拌边把所配MgSO4溶液于1 min内逐滴加入NH4HCO3溶液中,然后用氨水调节溶液pH至9.5;
步骤3: 放置1h后,过滤、洗涤、干燥得碳酸镁晶须产品(MgCO3•nH2O,n=1~5)。
(1)步骤1中配制400 mL 0.5 mol·L-1 NH4HCO3溶液所需玻璃仪器除烧杯、玻璃棒、胶头滴管和量筒外,还有
(2)①步骤2中应采取的较好加热的方法为
②根据上述实验药品的用量,四口烧瓶的最适宜规格为
A.250 mL B.500 mL C.1000 mL D.2000 mL
③生成MgCO3•nH2O的离子方程式为
II.测定合成的MgCO3∙nH2O中的n值:
方法1:称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被过量的NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30℃,最后,烧杯中的溶液加足量氯化钡溶液后过滤,用已知浓度的盐酸滴定过滤后溶液至中性,从而测得CO2的总量;重复上述操作2次。

(3)图中气球的作用是
(4)设NaOH溶液为a mol·L-1 b mL。3次实验测得消耗c mol·L-1盐酸的体积平均值为d mL,则n值为
方法2:用热重分析法测定合成的MgCO3·nH2O中的n值。称取100 g上述晶须产品进行热重分析, 热重曲线如图。

(5)如果测得n=1,则230℃~430℃发生的化学反应的方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为___________ ⑧ ⑤__________ 。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有 _______________________________ 。
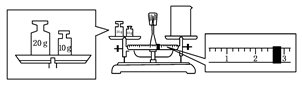
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为_________ g,要完成本实验该同学应称出_________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________ 。
(4)在配制过程中,下列操作会引起浓度偏低的是________ 。
①没有洗涤烧杯和玻璃棒且未将洗涤液注入容量瓶
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为

(3)使用容量瓶前必须进行的一步操作是
(4)在配制过程中,下列操作会引起浓度偏低的是
①没有洗涤烧杯和玻璃棒且未将洗涤液注入容量瓶
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________ 、________ 。
(2)写出Na2SO3固体氧化变质的化学方程式_____________ 。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________ ,
在过滤前,需要检验是否沉淀完全,其操作是______________ 。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________ (填“偏高”或“偏低”)。
(5)若操作正确,则m1________ m2(填“>”、“<”或“=”),原因是_______________ 。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________ (注明表达式中所用的有关符号的含义和单位)。
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、
(2)写出Na2SO3固体氧化变质的化学方程式
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是
在过滤前,需要检验是否沉淀完全,其操作是
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果
(5)若操作正确,则m1
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为
您最近一年使用:0次



