已知25℃时有关弱酸的电离平衡常数如下表所示,则下列有关说法不正确的是
| 弱酸化学式 | HA | HB | H2C |
| 电离平衡常数 |  |  |  、 、 |
| A.等物质的量浓度的各溶液pH关系为:pH(HA)<pH(H2C)<pH(HB) |
| B.0.1 mol/L的H2C溶液加水稀释,c(HC-)先增大后减小 |
| C.NaB中通入少量H2C发生的化学反应为:NaB+H2C=HB+NaHC |
D. 随温度升高而增大 随温度升高而增大 |
更新时间:2022-11-22 17:53:06
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】Al3+与F-具有很强的亲和性,当F-的浓度过大时,还会形成AlF 。AlF3在一定溶剂中存在分步电离,常温下向某浓度的AlF3溶液中加入NaF,实验测定Al3+、AlF2+、AlF
。AlF3在一定溶剂中存在分步电离,常温下向某浓度的AlF3溶液中加入NaF,实验测定Al3+、AlF2+、AlF 、AlF3在所有含铝元素微粒中的百分含量随pF[
、AlF3在所有含铝元素微粒中的百分含量随pF[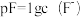 ]的变化如图所示,下列说法错误的是
]的变化如图所示,下列说法错误的是
 。AlF3在一定溶剂中存在分步电离,常温下向某浓度的AlF3溶液中加入NaF,实验测定Al3+、AlF2+、AlF
。AlF3在一定溶剂中存在分步电离,常温下向某浓度的AlF3溶液中加入NaF,实验测定Al3+、AlF2+、AlF 、AlF3在所有含铝元素微粒中的百分含量随pF[
、AlF3在所有含铝元素微粒中的百分含量随pF[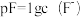 ]的变化如图所示,下列说法错误的是
]的变化如图所示,下列说法错误的是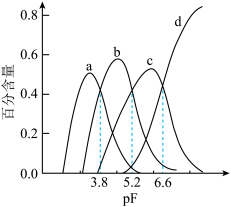
A.曲线b表示AlF |
B.pF=4时, |
C.Pf= 6.6时, 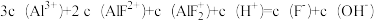 |
D.常温下, 的化学平衡常数为1015.6 的化学平衡常数为1015.6 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25 ℃时,按下表配制两份溶液。
下列说法错误的是
| 一元弱酸溶液 | 加入的NaOH溶液 | 混合后所得溶液 |
| HA10.0mL0.20mol·L-1 | 5.0mL0.20mol·L-1 | 溶液I pH=5.0 |
| HB10.0mL0.20mol·L-1 | 5.0mL0.20mol·L-1 | 溶液II pH=4.0 |
| A.溶液Ⅰ中,c(A-)>c(Na+)>c(H+)>c(OH-) |
B.Ⅰ和Ⅱ的pH相差1.0,说明 =10 =10 |
| C.混合Ⅰ和Ⅱ:c(Na+)+c(H+)=c(A-)+c(B-)+c(OH-) |
| D.混合Ⅰ和Ⅱ:c(HA)>c(HB) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列有关电解质溶液的说法正确的是
A.向 氨水中加入少量水,溶液中 氨水中加入少量水,溶液中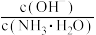 减少 减少 |
B.将 溶液从 溶液从 升温至 升温至 ,溶液中 ,溶液中 增大 增大 |
C.向氢氧化钠溶液中加入醋酸至中性,溶液中 |
D.向含有 、 、 的饱和溶液中加入少量的 的饱和溶液中加入少量的 ,溶液中的 ,溶液中的 减小 减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断不正确的是
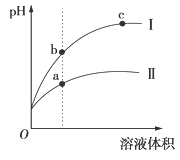

| A.I是盐酸,Ⅱ是醋酸 |
| B.溶液的导电性a>b>c |
| C.a、b、c三点KW的数值相同 |
| D.稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】pc类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液溶质的pc=3。下列说法正确的是
| A.25°C时,0.01mol/LNa2S水溶液中,pc(H+)+pc(OH-)=14 |
| B.用0.01mol/L的NaOH溶液滴定某浓度的盐酸,滴定过程中pc(OH-)逐渐增大 |
| C.某温度下,弱酸HB的Ka=1×10-5mol/L,则该溶液中pc(H+)+pc(B-)=l0 |
| D.向0.0lmol/L的Ca(HCO3)2溶液中逐渐滴加烧碱溶液,滴加过程中pc(Ca2+)逐渐减小 |
您最近一年使用:0次

 ,说明
,说明 的电离程度一定比HCN的大
的电离程度一定比HCN的大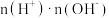 变大
变大 的盐酸和
的盐酸和 的氢氧化钠溶液等体积混合后,混合溶液的pH一定等于7
的氢氧化钠溶液等体积混合后,混合溶液的pH一定等于7

