以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下:
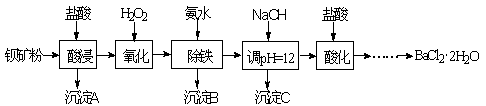
(1)氧化过程主要反应的离子方程式为______ 。
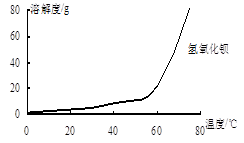
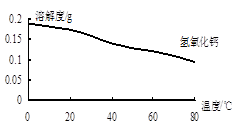
(2)沉淀C的主要成分是Ca(OH)2和______ 。由图可知,为了更好的使Ca2+沉淀,还应采取的措施为______ 。
(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后,______,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于______中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为______ 。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为______ 。
③步骤5所用瓷质仪器名称为______ 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为______ 。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因______ 。[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]

(1)氧化过程主要反应的离子方程式为
(2)沉淀C的主要成分是Ca(OH)2和


(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后,______,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于______中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为
③步骤5所用瓷质仪器名称为
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因
13-14高三上·江苏扬州·阶段练习 查看更多[2]
更新时间:2016-12-08 20:48:07
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
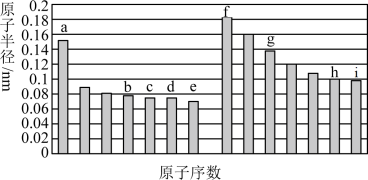
【推荐1】部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。 、
、 、
、 、
、 四种元素的最简单氢化物中,最稳定的是
四种元素的最简单氢化物中,最稳定的是________ (填化学式)。
(2) 与
与 能形成一种淡黄色的物质,其电子式为
能形成一种淡黄色的物质,其电子式为________ 。
(3) 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为________ 。
(4)由 的单质制成的电池需要注意防水,其原因为
的单质制成的电池需要注意防水,其原因为________ (用化学方程式表示)。
(5)门捷列卡在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为 的下一周期存在一种“类
的下一周期存在一种“类 ”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为________ 。预测 与
与 的最高价氧化物对应水化物的碱性较强的是
的最高价氧化物对应水化物的碱性较强的是________ (填最高价氧化物对应水化物的化学式)。
(6)使用下列装置再添加合适的药品,可以证明 和
和 两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液________ 、丁________ 。
 、
、 、
、 、
、 四种元素的最简单氢化物中,最稳定的是
四种元素的最简单氢化物中,最稳定的是(2)
 与
与 能形成一种淡黄色的物质,其电子式为
能形成一种淡黄色的物质,其电子式为(3)
 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为(4)由
 的单质制成的电池需要注意防水,其原因为
的单质制成的电池需要注意防水,其原因为(5)门捷列卡在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为
 的下一周期存在一种“类
的下一周期存在一种“类 ”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为 与
与 的最高价氧化物对应水化物的碱性较强的是
的最高价氧化物对应水化物的碱性较强的是(6)使用下列装置再添加合适的药品,可以证明
 和
和 两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液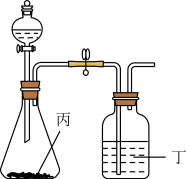
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:

(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________ , 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________ ,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____ %(保留三位有效数字)。

| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能
(3)滤渣 B 的成分是
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为供源制备碳酸镁晶须(MgCO3·nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__________ 。
(2)为提高水浸速率,可采取的措施为_________ (任写一条)。“浸渣”的主要成分为________ 。
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是_________ (填字母代号)。
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉镁”过程中反应的离子方程式为________________ 。
(5)流程中可以循环利用的物质是________ (填化学式)。

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4
 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑(1)写出焙烧产物NH3的电子式
(2)为提高水浸速率,可采取的措施为
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉镁”过程中反应的离子方程式为
(5)流程中可以循环利用的物质是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Fe、 、
、 等)可以制取黄钠铁矾【化学式为
等)可以制取黄钠铁矾【化学式为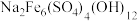 】和
】和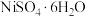 。实验流程如下:
。实验流程如下:

(1)请写出一种能提高“酸浸”速率的措施:___________ ;酸浸时要保持强制通风,目的是___________ 。
(2)制备黄钠铁矾,沉淀的成分与温度、pH的关系如图所示(阴影部分为黄钠铁矾):

①NaClO溶液的作用除调控溶液的pH外,还有___________ 。
②制备黄钠铁矾可以选择的条件为___________ (填标号)。
a.25°C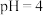 b.40°C
b.40°C 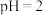 c.80°C
c.80°C 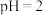 d.100°C
d.100°C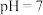
③写出若控制条件为25°C,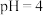 时,反应的离子方程式
时,反应的离子方程式___________ 。
(3)常温下,加入NaF溶液沉镁,控制溶液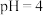 ,使
,使 恰好沉淀完全(即溶液中
恰好沉淀完全(即溶液中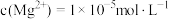 ),则此时溶液中c(HF)=
),则此时溶液中c(HF)=___________ 。[已知 ,
,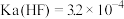 ]。
]。
(4)硫酸钠与硫酸镍晶体溶解度曲线如下图所示。由滤液制备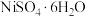 的实验步骤为:
的实验步骤为:___________ (简述用到试剂和操作),蒸发浓缩,控制温度30.8°C-53.8°C冷却结晶,趁热过滤,洗涤。(供选试剂为NaOH溶液、稀硫酸、水)

 、
、 等)可以制取黄钠铁矾【化学式为
等)可以制取黄钠铁矾【化学式为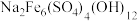 】和
】和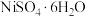 。实验流程如下:
。实验流程如下:
(1)请写出一种能提高“酸浸”速率的措施:
(2)制备黄钠铁矾,沉淀的成分与温度、pH的关系如图所示(阴影部分为黄钠铁矾):

①NaClO溶液的作用除调控溶液的pH外,还有
②制备黄钠铁矾可以选择的条件为
a.25°C
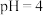 b.40°C
b.40°C 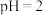 c.80°C
c.80°C 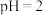 d.100°C
d.100°C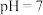
③写出若控制条件为25°C,
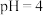 时,反应的离子方程式
时,反应的离子方程式(3)常温下,加入NaF溶液沉镁,控制溶液
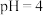 ,使
,使 恰好沉淀完全(即溶液中
恰好沉淀完全(即溶液中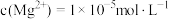 ),则此时溶液中c(HF)=
),则此时溶液中c(HF)= ,
,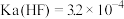 ]。
]。(4)硫酸钠与硫酸镍晶体溶解度曲线如下图所示。由滤液制备
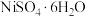 的实验步骤为:
的实验步骤为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】NiCl2是一种重要催化剂。某科研小组以废弃催化剂(含Ni2+、Cu2+、Fe3+、Ca2+、Mg2+等)为原料,按如图流程回收NiCl2·6H2O晶体,回答下列问题。

已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的成分主要是___________ 。
(2)X可以为Cl2或H2O2.若X为H2O2,试剂Y的使用量会减少,原因是___________ (用离子方程式加以说明)。
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度≤10-5mol/L),滤液3中c(F-)不小于___________ mol/L。
(4)操作A为___________ 、冷却结晶、过滤、洗涤。
(5)将所得NiCl2·6H2O与SOCl2混合加热可制备无水NiCl2并得到两种酸性气体,该反应的化学方程式为___________ 。
(6)废旧锂离子电池含LiNiO2的正极材料经预处理后,可采用如图原理富集Ni元素。
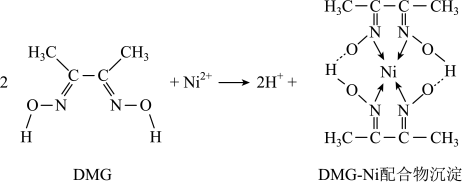
DMG-Ni配合物中存在的作用力有___________(填序号)。
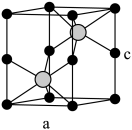
(7)红砷镍矿是一种六方晶体(底面为60°和120°的菱形),其晶胞如图所示,图中黑色小球为Ni,浅色大球为As
①晶胞中Ni周围距离最近且等距的As有___________ 个
②已知NiAs的晶胞边长分别为a pm和c pm,阿伏加德罗常数的值为NA,则红砷镍矿晶体的理论密度为ρ=___________ g·cm-3(写出表达式,需化简)

已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的成分主要是
(2)X可以为Cl2或H2O2.若X为H2O2,试剂Y的使用量会减少,原因是
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度≤10-5mol/L),滤液3中c(F-)不小于
(4)操作A为
(5)将所得NiCl2·6H2O与SOCl2混合加热可制备无水NiCl2并得到两种酸性气体,该反应的化学方程式为
(6)废旧锂离子电池含LiNiO2的正极材料经预处理后,可采用如图原理富集Ni元素。

DMG-Ni配合物中存在的作用力有___________(填序号)。
| A.极性键 | B.非极性键 | C.氢键 | D.配位键 |
①晶胞中Ni周围距离最近且等距的As有
②已知NiAs的晶胞边长分别为a pm和c pm,阿伏加德罗常数的值为NA,则红砷镍矿晶体的理论密度为ρ=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】连二次硝酸(H2N2O2)是二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为___ 。
(2)常温下,用0.01mol·L-1NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

写出H2N2O2在水溶液中电离的主要方程式:___ 。
②c点时溶液中下列离子Na+、OH-、N2O22-、HN2O2-,浓度由大到小的顺序为___ 。
③b点时溶液中的溶质为___ 。
④a点时溶液中c(Na+)___ c(HN2O2-)+c(N2O22-)(填“>”“<”或“=”)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可得到黄色的连二次硝酸银沉淀,向该体系中滴加硫酸钠溶液,白色沉淀和黄色沉淀共存时,该体系中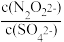 =
=___ [已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5].
(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01mol·L-1NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

写出H2N2O2在水溶液中电离的主要方程式:
②c点时溶液中下列离子Na+、OH-、N2O22-、HN2O2-,浓度由大到小的顺序为
③b点时溶液中的溶质为
④a点时溶液中c(Na+)
(3)硝酸银溶液和连二次硝酸钠溶液混合,可得到黄色的连二次硝酸银沉淀,向该体系中滴加硫酸钠溶液,白色沉淀和黄色沉淀共存时,该体系中
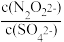 =
=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.如图所示,A、B两种常见化合物,A为淡黄色粉末,无色气体D能使澄清石灰水变浑浊。回答下列问题:
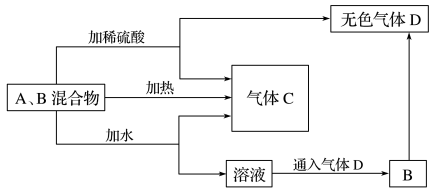
(1)A的化学式为___________ ,B的固体俗称 ___________ ,气体C的名称为___________ 。
(2)写出A中加水时的化学反应方程式的化学方程式:___________ 。
(3)写出固体B加热的化学反应方程式:___________ 。
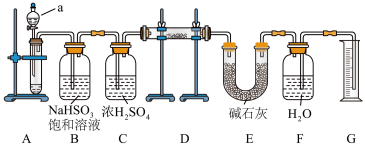
Ⅱ.现有一定量含有Na2O杂质的Na2O2试样,用如图所示实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
回答下列问题:
(4)仪器a的名称是:___________ ,装置A中液体试剂选用___________ 。
(5)装置B的作用是___________ ,装置E中碱石灰的作用是___________ 。
(6)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为___________ 。

(1)A的化学式为
(2)写出A中加水时的化学反应方程式的化学方程式:
(3)写出固体B加热的化学反应方程式:
Ⅱ.现有一定量含有Na2O杂质的Na2O2试样,用如图所示实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)

回答下列问题:
(4)仪器a的名称是:
(5)装置B的作用是
(6)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】亚氯酸钠(NaClO2)是一种高效含氯消毒剂和漂白剂。下图为制备亚氯酸钠的装置图(夹持装置省略)。

已知:NaClO2饱和溶液在低于38℃时会析出NaClO2●3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。试回答下列问题:
(1)装置A用来制取ClO2,发生反应的离子方程式为___________
(2)装置B的作用是___________
(3)研究测得C装置吸收液中c(NaOH)、 对粗产品中NaClO2含量的影响如下图所示。则最佳条件为c(NaOH)=
对粗产品中NaClO2含量的影响如下图所示。则最佳条件为c(NaOH)=_________ mol·L-1, =
=_________

(4)C装置中生成NaClO2的反应,n(氧化剂)∶n(还原剂)=___________ ;C装置采用“冰水浴"防止温度过高的目的是___________
(5)充分反应后,为从产品溶液中获取NaClO2晶体,从下列选项中选出合理的操作并排序:___________→___________→___________→干燥(填字母序号)。________
a趁热过滤 b.50℃水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.55℃恒温减压蒸发结晶

已知:NaClO2饱和溶液在低于38℃时会析出NaClO2●3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。试回答下列问题:
(1)装置A用来制取ClO2,发生反应的离子方程式为
(2)装置B的作用是
(3)研究测得C装置吸收液中c(NaOH)、
 对粗产品中NaClO2含量的影响如下图所示。则最佳条件为c(NaOH)=
对粗产品中NaClO2含量的影响如下图所示。则最佳条件为c(NaOH)= =
=
(4)C装置中生成NaClO2的反应,n(氧化剂)∶n(还原剂)=
(5)充分反应后,为从产品溶液中获取NaClO2晶体,从下列选项中选出合理的操作并排序:___________→___________→___________→干燥(填字母序号)。
a趁热过滤 b.50℃水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.55℃恒温减压蒸发结晶
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】混合物分离和提纯常用下图装置进行,按要求回答下列问题:
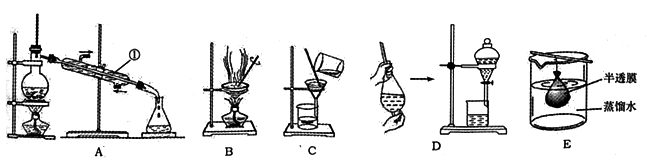
(1)仪器1的名称__________ 。
(2)除去澄清石灰水中悬浮的CaCO3颗粒应选用___ (填字母,下同)。
(3)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物应选用_______ 。
(4)明胶是水溶性蛋白质混合物,溶于水形成胶体。分离明胶的水溶液与Na2SO4溶液应选用___ ,设计实验证明SO42-已分离出来_________ 。
(5)有一混合物的水溶液,只可能含有以下离子中的若干种;K+、NH4+、Cl-、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加入AgNO3溶液有沉淀产生;②第二份加足量NaOH溶液加热后,收集到气体0.04mol;③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。请根据上述实验结果,原溶液中肯定有_____ 离子,肯定无______ 离子,可能有______ 离子。

(1)仪器1的名称
(2)除去澄清石灰水中悬浮的CaCO3颗粒应选用
(3)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物应选用
(4)明胶是水溶性蛋白质混合物,溶于水形成胶体。分离明胶的水溶液与Na2SO4溶液应选用
(5)有一混合物的水溶液,只可能含有以下离子中的若干种;K+、NH4+、Cl-、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加入AgNO3溶液有沉淀产生;②第二份加足量NaOH溶液加热后,收集到气体0.04mol;③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。请根据上述实验结果,原溶液中肯定有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某工厂排放的无色废水中可能含有 、Ba2+、Fe3+、
、Ba2+、Fe3+、 、Cl-中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:
、Cl-中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:
(1)废水中一定没有的离子是___________ (填离子符号)。
(2)向废水中滴加稀盐酸发生反应的离子方程式为___________ 。
(3)向废水中加过量浓氢氧化钠溶液,可能出现的现象是___________ 。
(4)为确定废水中还可能存在的以上离子,具体的实验方法是___________ 。
 、Ba2+、Fe3+、
、Ba2+、Fe3+、 、Cl-中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:
、Cl-中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:(1)废水中一定没有的离子是
(2)向废水中滴加稀盐酸发生反应的离子方程式为
(3)向废水中加过量浓氢氧化钠溶液,可能出现的现象是
(4)为确定废水中还可能存在的以上离子,具体的实验方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。
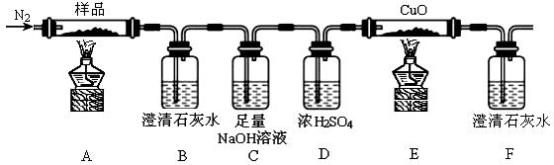
(1)连接好装置后,加入药品前,应该进行的实验操作是________________ (填操作名称)。
(2)实验开始时缓缓通入氮气,过一段时间以后,加热反应管A和E,待反应完全后,停止加热,仍继续通氮气,直到反应管冷却。停止加热前是否需要先断开A、B的连接处和E、F的连接处?为什么?_______________________________________________________________ 。
(3)实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有___________________________________________________ (写化学式)。能证明分解产物中有CO气体生成的实验现象是___________________ 。
(4)该小组同学查阅资料后得知,固体产物中不存在+3价Fe元素,而盐类物质只有K2CO3。
①验证固体产物中钾元素存在的方法是____________________ ,现象是______________ 。
②研究小组为探究铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L通过计算判断黑色粉末的成分为_________ (写化学式)。写出黑色粉末溶于足量稀硝酸发生反应的离子方程式:________________________________________________ 。

(1)连接好装置后,加入药品前,应该进行的实验操作是
(2)实验开始时缓缓通入氮气,过一段时间以后,加热反应管A和E,待反应完全后,停止加热,仍继续通氮气,直到反应管冷却。停止加热前是否需要先断开A、B的连接处和E、F的连接处?为什么?
(3)实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有
(4)该小组同学查阅资料后得知,固体产物中不存在+3价Fe元素,而盐类物质只有K2CO3。
①验证固体产物中钾元素存在的方法是
②研究小组为探究铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L通过计算判断黑色粉末的成分为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】现有A、B、C、D、E、F六种易溶于水的化合物,已知它们的阳离子有:K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、 、
、 、
、 ,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,之后沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)写出下列四种化合物的化学式:A____ 、B____ 、C____ 、D____ 。
(2)E溶液是_______ ,判断依据是______ 。
(3)实验④中生成白色絮状沉淀的反应的化学方程式是____ 。
 、
、 、
、 ,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,之后沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)写出下列四种化合物的化学式:A
(2)E溶液是
(3)实验④中生成白色絮状沉淀的反应的化学方程式是
您最近一年使用:0次



