除去烟气中的NO,能促进生态文明建设。
(1)含 和
和 的酸性吸收液可以处理烟气中NO,原理是:
的酸性吸收液可以处理烟气中NO,原理是: 催化
催化 产生
产生 ,后者将NO最终氧化成
,后者将NO最终氧化成 。
。
①写出 将NO氧化成
将NO氧化成 的离子方程式为:
的离子方程式为:_______ 。
②吸收液的初始pH和温度对 氧化NO的效果分别如图1和图2所示。
氧化NO的效果分别如图1和图2所示。

当吸收液的初始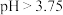 时,NO氧化率明显降低,原因可能是:
时,NO氧化率明显降低,原因可能是:
(i)pH较大时, 容易发生歧化反应,导致
容易发生歧化反应,导致 浓度降低,氧化能力减弱:
浓度降低,氧化能力减弱:
(ii)_______ 。
③当超过60℃时,NO的氧化率明显降低,原因可能是:_______ 。
(2) 可在
可在 催化下还原烟气中NO,温度对该反应的影响如图3所示。
催化下还原烟气中NO,温度对该反应的影响如图3所示。
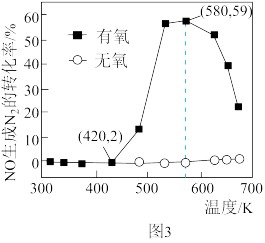
①在420~580K之间,有氧条件下NO生成 的转化率明显高于无氧条件,原因可能是
的转化率明显高于无氧条件,原因可能是_______ 。
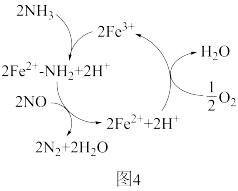
②进一步研究发现,以 为催化利时,
为催化利时, 在有氧条件下还原NO的机理如图4所示。该反应的总化学方程式为:
在有氧条件下还原NO的机理如图4所示。该反应的总化学方程式为:_______ 。
(1)含
 和
和 的酸性吸收液可以处理烟气中NO,原理是:
的酸性吸收液可以处理烟气中NO,原理是: 催化
催化 产生
产生 ,后者将NO最终氧化成
,后者将NO最终氧化成 。
。①写出
 将NO氧化成
将NO氧化成 的离子方程式为:
的离子方程式为:②吸收液的初始pH和温度对
 氧化NO的效果分别如图1和图2所示。
氧化NO的效果分别如图1和图2所示。
当吸收液的初始
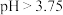 时,NO氧化率明显降低,原因可能是:
时,NO氧化率明显降低,原因可能是:(i)pH较大时,
 容易发生歧化反应,导致
容易发生歧化反应,导致 浓度降低,氧化能力减弱:
浓度降低,氧化能力减弱:(ii)
③当超过60℃时,NO的氧化率明显降低,原因可能是:
(2)
 可在
可在 催化下还原烟气中NO,温度对该反应的影响如图3所示。
催化下还原烟气中NO,温度对该反应的影响如图3所示。
①在420~580K之间,有氧条件下NO生成
 的转化率明显高于无氧条件,原因可能是
的转化率明显高于无氧条件,原因可能是②进一步研究发现,以
 为催化利时,
为催化利时, 在有氧条件下还原NO的机理如图4所示。该反应的总化学方程式为:
在有氧条件下还原NO的机理如图4所示。该反应的总化学方程式为:
更新时间:2022-12-07 13:56:45
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】地球上的金属矿物资源是有限的,应合理开发利用。
(1)金属冶炼的实质是金属离子被______ (填“氧化”或“还原”)生成金属单质。
(2)铜在自然界存在于多种矿石中,如:
请回答下列问题:
① 上表所列铜化合物中,推断铜的质量百分含量最高的是______ 。
② CuFeS2其中 Cu 为+1 价、Fe 为+3 价,高温焙烧时发生的反应是CuFeS2 + O2 SO2 +FeS +Cu,焙烧过程中被还原的元素有
SO2 +FeS +Cu,焙烧过程中被还原的元素有______ 。
③ 工业上以黄铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:Cu2S+O2 2Cu+SO2,该反应中氧化剂是
2Cu+SO2,该反应中氧化剂是______ 。
④ Cu2(OH)2 CO3 与稀硫酸反应的离子方程式为______ 。
(1)金属冶炼的实质是金属离子被
(2)铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu2S | Cu2(OH)2 CO3 |
请回答下列问题:
① 上表所列铜化合物中,推断铜的质量百分含量最高的是
② CuFeS2其中 Cu 为+1 价、Fe 为+3 价,高温焙烧时发生的反应是CuFeS2 + O2
 SO2 +FeS +Cu,焙烧过程中被还原的元素有
SO2 +FeS +Cu,焙烧过程中被还原的元素有③ 工业上以黄铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:Cu2S+O2
 2Cu+SO2,该反应中氧化剂是
2Cu+SO2,该反应中氧化剂是④ Cu2(OH)2 CO3 与稀硫酸反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)利用黄铜矿冶炼铜的反应为8CuFeS2+21O2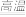 Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
①反应中被还原的元素是________ (填元素符号),
②生成1 mol Fe2O3时转移电子的物质的量为________ mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用过量稀盐酸浸取炉渣,过滤。
②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
A.①中过滤的目的是____________________ ,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________ 。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
①所选试剂为__________________
②证明炉渣中含有FeO的实验现象为__________________________________________
(1)利用黄铜矿冶炼铜的反应为8CuFeS2+21O2
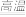 Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,①反应中被还原的元素是
②生成1 mol Fe2O3时转移电子的物质的量为
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用过量稀盐酸浸取炉渣,过滤。
②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
A.①中过滤的目的是
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
①所选试剂为
②证明炉渣中含有FeO的实验现象为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】填空。
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:

过程a中K2FeO4体现___________ (填“氧化”或“还原”)性,反应过程中转移5.418×1022个电子,需___________ molK2FeO4。
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。写出该反应的化学方程式:________ 。
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是___________ ,生产1mol的高铁酸钠,需要转移___________ mol电子。
(4)向Na2FeO4溶液中加入适量饱和的KOH溶液,有K2FeO4析出,请写出该反应的化学方程式___________ 。
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:

过程a中K2FeO4体现
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。写出该反应的化学方程式:
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是
(4)向Na2FeO4溶液中加入适量饱和的KOH溶液,有K2FeO4析出,请写出该反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】电催化还原 是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原 的装置示意图如图-1所示。控制其他条件相同,将一定量的
的装置示意图如图-1所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
①电解前需向电解质溶液中持续通入过量 的原因是
的原因是___________ 。
②控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
③科研小组利用 代替原有的
代替原有的 进行研究,其目的是
进行研究,其目的是___________ 。
(2)一种铜基复合电极材料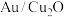 的制备方法:将一定量
的制备方法:将一定量 分散至水与乙醇的混合溶液中,向溶液中逐滴滴加
分散至水与乙醇的混合溶液中,向溶液中逐滴滴加 (一种强酸)溶液,搅拌一段时间后离心分离,得
(一种强酸)溶液,搅拌一段时间后离心分离,得 ,溶液呈蓝色。写出
,溶液呈蓝色。写出 还原
还原 的离子方程式:
的离子方程式:___________ 。
(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。
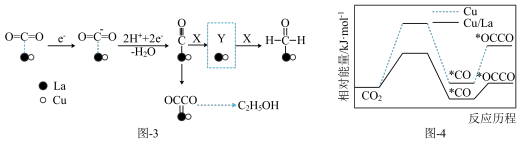
①X为___________ 。在答题卡上相应位置补充完整虚线框内Y的结构。_________
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原 的优点是
的优点是___________ 。
 是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原
 的装置示意图如图-1所示。控制其他条件相同,将一定量的
的装置示意图如图-1所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
①电解前需向电解质溶液中持续通入过量
 的原因是
的原因是②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用
 代替原有的
代替原有的 进行研究,其目的是
进行研究,其目的是(2)一种铜基复合电极材料
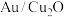 的制备方法:将一定量
的制备方法:将一定量 分散至水与乙醇的混合溶液中,向溶液中逐滴滴加
分散至水与乙醇的混合溶液中,向溶液中逐滴滴加 (一种强酸)溶液,搅拌一段时间后离心分离,得
(一种强酸)溶液,搅拌一段时间后离心分离,得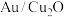 ,溶液呈蓝色。写出
,溶液呈蓝色。写出 还原
还原 的离子方程式:
的离子方程式:(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。

①X为
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原
 的优点是
的优点是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:_________ 。
(2)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。NH3与NO2生成N2的反应中,当生成1分子N2时,转移____________ 个电子。
(2)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。NH3与NO2生成N2的反应中,当生成1分子N2时,转移
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们完成一些判断.将5.4g铝片投入500mL 0.5mol•L﹣1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图

(1)关于图像的描述不正确的是______ .
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
③a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
(2)书写O→a段所对应的离子方程式___________________ .
(3)若其他条件相同,现换用500mL1mol•L﹣1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L﹣1硫酸的快,可能的原因是______
①盐酸中c(H+)的浓度更大②Cl﹣有催化作用③ 有催化作用④Al3+有催化作用
有催化作用④Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3固体;
其中,你认为不合理的方案有______ ,并请你再补充一种合理方案是___________________ .

(1)关于图像的描述不正确的是
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
③a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
(2)书写O→a段所对应的离子方程式
(3)若其他条件相同,现换用500mL1mol•L﹣1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L﹣1硫酸的快,可能的原因是
①盐酸中c(H+)的浓度更大②Cl﹣有催化作用③
 有催化作用④Al3+有催化作用
有催化作用④Al3+有催化作用(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3固体;
其中,你认为不合理的方案有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】有人利用碳还原法将氮氧化物(以NO为例)转化为无毒无害的气体。回答下列问题:
(1)碳还原法发生反应的化学方程式为C(s)+2NO(g) N2(g)+CO2(g)。能使化学反应速率加快的措施有
N2(g)+CO2(g)。能使化学反应速率加快的措施有___ (填序号,下同),其中属于增大活化分子百分含量的是___ 。
①增加C的物质的量②定容密闭容器中继续充入NO③在反应器中加入NaOH溶液④升高反应温度⑤缩小容器体积
(2)向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如表所示:
①10~20min内,N2的平均反应速率v(N2)=___ 。
②在30min时向容器中加入合适催化剂,v(正)___ ,v(逆)___ 。(填“增大”“减小”或“不变”)
(1)碳还原法发生反应的化学方程式为C(s)+2NO(g)
 N2(g)+CO2(g)。能使化学反应速率加快的措施有
N2(g)+CO2(g)。能使化学反应速率加快的措施有①增加C的物质的量②定容密闭容器中继续充入NO③在反应器中加入NaOH溶液④升高反应温度⑤缩小容器体积
(2)向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如表所示:
| 时间/min 浓度/(mol•L-1) 物质 | 0 | 10 | 20 | 30 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 |
| N2 | 0 | 0.16 | 0.25 | 0.25 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 |
②在30min时向容器中加入合适催化剂,v(正)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】已知: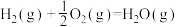 ,反应过程中能量变化如图所示,请回答下列问题。
,反应过程中能量变化如图所示,请回答下列问题。
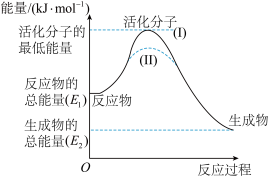
(1)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能__________ ,单位体积内活化分子百分数__________ ,因此反应速率__________ ,(前三空均填“增大”“减小”或“不变”),你认为最可能的原因是_______ 。
(2)在一固定容积的密闭容器中进行反应: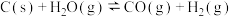 。若容器容积为2L,反应10s后,
。若容器容积为2L,反应10s后, 的质量增加0.4g,则该时间段内CO的反应速率为
的质量增加0.4g,则该时间段内CO的反应速率为________ 。若增加碳的量,则正反应速率__________ (填“增大”“减小”或“不变”)。
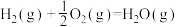 ,反应过程中能量变化如图所示,请回答下列问题。
,反应过程中能量变化如图所示,请回答下列问题。
(1)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能
(2)在一固定容积的密闭容器中进行反应:
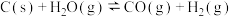 。若容器容积为2L,反应10s后,
。若容器容积为2L,反应10s后, 的质量增加0.4g,则该时间段内CO的反应速率为
的质量增加0.4g,则该时间段内CO的反应速率为
您最近一年使用:0次



