温室气体的利用是当前环境和能源领域的研究热点。 与
与 重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①
反应②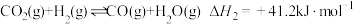
反应③
(1)已知: ,则
,则 =
=______  。
。
(2)一定条件下,向体积为VL的密闭容器中通入 、
、 各1mol及少量
各1mol及少量 ,测得不同温度下反应达到平衡时各产物的产量如图1所示。
,测得不同温度下反应达到平衡时各产物的产量如图1所示。

①图1中a和b分别代表产物______ 和______ ;当温度高于900K, 的产量随温度升高而下降的主要原因是
的产量随温度升高而下降的主要原因是__________ 。
②写出反应①的平衡常数K=___________ (写表达式)。
 与
与 重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:反应①

反应②
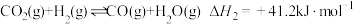
反应③

(1)已知:
 ,则
,则 =
= 。
。(2)一定条件下,向体积为VL的密闭容器中通入
 、
、 各1mol及少量
各1mol及少量 ,测得不同温度下反应达到平衡时各产物的产量如图1所示。
,测得不同温度下反应达到平衡时各产物的产量如图1所示。
①图1中a和b分别代表产物
 的产量随温度升高而下降的主要原因是
的产量随温度升高而下降的主要原因是②写出反应①的平衡常数K=
更新时间:2022-12-06 00:22:00
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】二氧化碳的一种资源化利用发生的反应有:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H1<0
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H2=+41.2kJ•mol-1
(1)若已知H2和CH4的燃烧热分别为akJ•mol-1、bkJ•mol-1,水的汽化热为ckJ•mol-1,则∆H1=__ kJ•mol-1。(注:以含a、b、c的代数式表示)
(2)按n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应,当不同压强时,CO2的平衡转化率如图甲所示;气体总压强为0.1MPa时,平衡时各物质的物质的量分数如图乙所示:
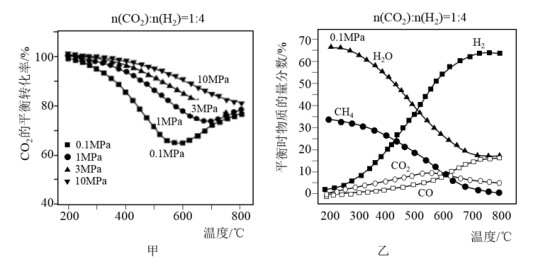
①0.1MPa时,CO2的转化率在600℃之后,随温度升高而增大的主要原因是__ 。
②据图示可知,密闭容器中的温度最好为__ 。
③在一定温度条件下,为了提高CO2的平衡转化率,可以采取的措施有__ 。(任意合理的两条)
(3)二氧化碳的资源化利用反应III为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H3=-49kJ•mol-1。
CH3OH(g)+H2O(g) ∆H3=-49kJ•mol-1。
①反应III的△S__ (填“>”或“<")0。
②在初始压强为P0的某恒温、恒容密闭容器中,按n(CO2):n(H2)=1:3投料比进行反应III,达到平衡时测得体系中CO2的物质的量分数为 ,则H2的平衡转化率α=
,则H2的平衡转化率α=__ %,该温度下反应平衡常数KP为__ (用含P0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H1<0
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H2=+41.2kJ•mol-1
(1)若已知H2和CH4的燃烧热分别为akJ•mol-1、bkJ•mol-1,水的汽化热为ckJ•mol-1,则∆H1=
(2)按n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应,当不同压强时,CO2的平衡转化率如图甲所示;气体总压强为0.1MPa时,平衡时各物质的物质的量分数如图乙所示:

①0.1MPa时,CO2的转化率在600℃之后,随温度升高而增大的主要原因是
②据图示可知,密闭容器中的温度最好为
③在一定温度条件下,为了提高CO2的平衡转化率,可以采取的措施有
(3)二氧化碳的资源化利用反应III为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H3=-49kJ•mol-1。
CH3OH(g)+H2O(g) ∆H3=-49kJ•mol-1。①反应III的△S
②在初始压强为P0的某恒温、恒容密闭容器中,按n(CO2):n(H2)=1:3投料比进行反应III,达到平衡时测得体系中CO2的物质的量分数为
 ,则H2的平衡转化率α=
,则H2的平衡转化率α=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知: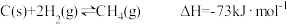
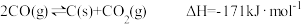
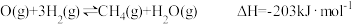
写出CO与H2O(g)反应生成H2和CO2的热化学方程式___________ 。
(2)工业上常用 与水蒸气在一定条件下来制取H2,其原理为:
与水蒸气在一定条件下来制取H2,其原理为: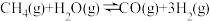 。
。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1 molCH4和1.4 mol水蒸气发生上述反应,5 min后达平衡,生成0.2 mol CO,用H2表示该反应的速率为___________ ,此反应的平衡常数为___________  (结果保留到小数点后三位)
(结果保留到小数点后三位)
②下列说法中能说明此反应达到平衡状态的是___________ 。
A.体系的压强不再发生变化 B.生成1 molCH4的同时消耗3 mol H2
C.体系的平均相对分子质量不再发生变化 D.体系的密度不再发生变化
E.反应速率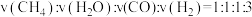
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),发生反应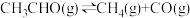 ,经过相同时间测得CH3CHO的转化率与压强的关系如图所示。
,经过相同时间测得CH3CHO的转化率与压强的关系如图所示。
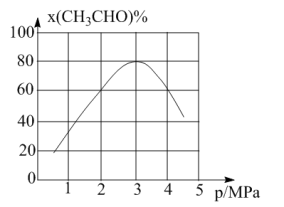
①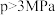 时,增大压强,CH3CHO的转化率降低,其原因是
时,增大压强,CH3CHO的转化率降低,其原因是___________ 。
②当压强为4MPa时,该反应的平衡常数Kp=___________ MPa(用各物质分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:
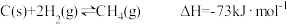
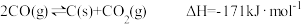
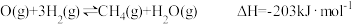
写出CO与H2O(g)反应生成H2和CO2的热化学方程式
(2)工业上常用
 与水蒸气在一定条件下来制取H2,其原理为:
与水蒸气在一定条件下来制取H2,其原理为: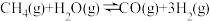 。
。①一定温度时,在一个体积为2L的恒容密闭容器中,加入1 molCH4和1.4 mol水蒸气发生上述反应,5 min后达平衡,生成0.2 mol CO,用H2表示该反应的速率为
 (结果保留到小数点后三位)
(结果保留到小数点后三位)②下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化 B.生成1 molCH4的同时消耗3 mol H2
C.体系的平均相对分子质量不再发生变化 D.体系的密度不再发生变化
E.反应速率
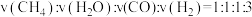
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),发生反应
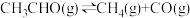 ,经过相同时间测得CH3CHO的转化率与压强的关系如图所示。
,经过相同时间测得CH3CHO的转化率与压强的关系如图所示。
①
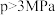 时,增大压强,CH3CHO的转化率降低,其原因是
时,增大压强,CH3CHO的转化率降低,其原因是②当压强为4MPa时,该反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】烟气中的H2S及SO2可采用绿色的化学方法处理。
(1)利用CaCO3吸收烟气中H2S包括:CaCO3的分解、H2S的吸收与CaS的生成以及CaS的氧化。
①高温下反应CaCO3(s)=CaO(s)+CO2(g)能自发进行,则△H____ 0,△S____ 0(填“大于”或“小于”)。
②恒温恒容密闭容器中进行吸收H2S反应为CaO(s)+H2S(g)=CaS(s)+H2O(g),能说明该反应已达到平衡状态的是____ (填字母编号)。
A.气体的总压强不再随时间变化 B.单位时间内断裂H—S与生成H—O键数相等
C.气体的密度不再随时间变化 D.气体的分压 不再随时间变化
不再随时间变化
③CaS的氧化涉及如下反应:
(Ⅰ) CaS(s)+O2(g)
CaS(s)+O2(g)
 CaSO4(s) ∆H1
CaSO4(s) ∆H1
(Ⅱ) CaS(s)+O2(g)
CaS(s)+O2(g)
 CaO(s)+
CaO(s)+ SO2(g) ∆H2
SO2(g) ∆H2
(Ⅲ)CaSO4(s)+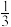 CaS(s)
CaS(s)
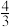 CaO(s)+
CaO(s)+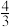 SO2(g) ∆H3
SO2(g) ∆H3
在恒压(总压为akPa)密闭容器中反应时,各反应的lgKp(Kp为以分压表示的平衡常数)与温度的关系如图1所示,由图可知:∆H>0的反应是____ (填标号);∆H3=____ (用∆H1、∆H2表示);N点时,分压p(SO2)=____ kPa,M点时,分压p(O2)=____ kPa。
(2)CO还原法处理SO2:2CO(g)+SO2(g)=S(l)+2CO2(g) △H=-37kJ/mol。向两个密闭容器中分别充入4molCO和2molSO2,在不同温度和压强下(物质状态未发生改变)发生上述反应,SO2的平衡转化率如表1所示,其中α1>α2,则T1____ T2(填“大于”、“小于”或“等于”),判断的理由是____ 。
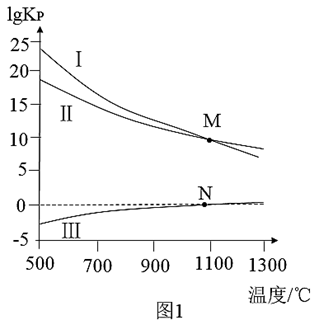
(3)FeSx催化水煤气(CO、H2)还原SO2的反应过程如图2所示。下列说法合理的是____ (填字母编号)。
(1)利用CaCO3吸收烟气中H2S包括:CaCO3的分解、H2S的吸收与CaS的生成以及CaS的氧化。
①高温下反应CaCO3(s)=CaO(s)+CO2(g)能自发进行,则△H
②恒温恒容密闭容器中进行吸收H2S反应为CaO(s)+H2S(g)=CaS(s)+H2O(g),能说明该反应已达到平衡状态的是
A.气体的总压强不再随时间变化 B.单位时间内断裂H—S与生成H—O键数相等
C.气体的密度不再随时间变化 D.气体的分压
 不再随时间变化
不再随时间变化③CaS的氧化涉及如下反应:
(Ⅰ)
 CaS(s)+O2(g)
CaS(s)+O2(g)
 CaSO4(s) ∆H1
CaSO4(s) ∆H1(Ⅱ)
 CaS(s)+O2(g)
CaS(s)+O2(g)
 CaO(s)+
CaO(s)+ SO2(g) ∆H2
SO2(g) ∆H2(Ⅲ)CaSO4(s)+
 CaS(s)
CaS(s)
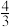 CaO(s)+
CaO(s)+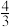 SO2(g) ∆H3
SO2(g) ∆H3在恒压(总压为akPa)密闭容器中反应时,各反应的lgKp(Kp为以分压表示的平衡常数)与温度的关系如图1所示,由图可知:∆H>0的反应是

(2)CO还原法处理SO2:2CO(g)+SO2(g)=S(l)+2CO2(g) △H=-37kJ/mol。向两个密闭容器中分别充入4molCO和2molSO2,在不同温度和压强下(物质状态未发生改变)发生上述反应,SO2的平衡转化率如表1所示,其中α1>α2,则T1
| 压强 | p | 2p |
| 温度 | T1 | T2 |
| SO2的平衡转化率α | α1 | α2 |

| A.COS和H2S为中间产物 | B.生成S的反应中,S均为还原产物 |
| C.可能存在反应FeSx-1+S=FeSx | D.寻找更高效的催化剂可以提高S单质的平衡转化率 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】由H、C、N、O、S等元素形成的多种化合物在生产生活中有着重要应用。
Ⅰ.研究表明,在催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:反应①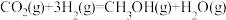
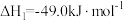
反应②
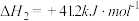
(1)关于上述反应①说法正确的是___________。
(2)恒容条件下,能说明反应②已经达到平衡状态的是___________。
(3)在恒容密闭容器中发生反应①,有利于提高CO2平衡转化率的措施有___________。
Ⅱ.T1时,将1.00 mol CO2和3.00molH2充入体积为1.00L的恒容密闭容器中发生反应①,已知容器起始压强为p0,经过3h反应达到平衡,平衡后混合气体的物质的量为3.00mol。
(4)达到平衡时,CO2的转化率为___________ 。
(5)该过程中H2的平均反应速率为___________ mol·L-1·h-1;
(6)写出反应①的平衡常数表达式K=___________ 。K可用反应体系中气体物质分压表示,即用平衡分压代替平衡浓度,分压=总压×物质的量分数。则上述反应的平衡常数KP=___________ (用含p0的代数式表示)。
Ⅰ.研究表明,在催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:反应①
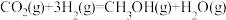
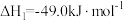
反应②

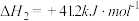
(1)关于上述反应①说法正确的是___________。
| A.△S>0 | B.△S<0 | C.低温自发 | D.高温自发 |
| A.混合气体的平均相对分子质量不变 | B.混合气体的密度不变 |
| C.v (H2)正=v (CO)正 | D.n(CO)/n(H2)不变 |
| A.降低反应温度 | B.增大压强(物质状态不变) |
| C.增大CO2的物质的量 | D.混合气体中掺入一定量惰性气体(不参与反应) |
Ⅱ.T1时,将1.00 mol CO2和3.00molH2充入体积为1.00L的恒容密闭容器中发生反应①,已知容器起始压强为p0,经过3h反应达到平衡,平衡后混合气体的物质的量为3.00mol。
(4)达到平衡时,CO2的转化率为
(5)该过程中H2的平均反应速率为
(6)写出反应①的平衡常数表达式K=
您最近一年使用:0次
【推荐2】目前研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。二氧化碳催化加氢制 甲醇,有利于减少温室气体二氧化碳,其总反应可表示为:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ∆H= - 49kJ/mol
CH3OH(g)+H2O(g) ∆H= - 49kJ/mol
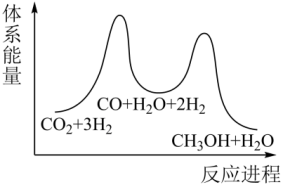
(1)利于该反应自发的温度条件是_______ 。
(2)该反应的历程及能量变化如图所示,过程_______ (填①或②)为决速步。
(3)二氧化碳催化加氢制甲醇合成总反应在起始物 = 3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 x(CH3OH),在 t=250℃时 x(CH3OH)随压强(p)的变化及在p=5×103Pa时x(CH3OH)随温度(t)的变化,如图所示。
= 3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 x(CH3OH),在 t=250℃时 x(CH3OH)随压强(p)的变化及在p=5×103Pa时x(CH3OH)随温度(t)的变化,如图所示。
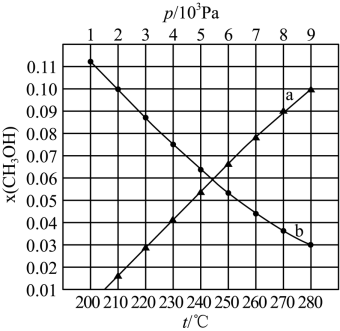
①图中对应等温过程的曲线是_______ (填“a”或“b"”),判断的理由是_______ ;
②t=250℃时,当 x(CH3OH)=0.10 时,CO2的平衡转化率 α =_______ %(保留三位有效数字),此条件下,用各物质的平衡分压表示总反应的平衡常数 Kp , 则该反应的Kp=_______ (各物质平衡分压=平衡总压强×各物质的物质的量分数,只需用具体数据列出计算式)。
(4)CO2也可用于制作Li- CO2电池,在Li- CO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下 4个步骤进行,写出步骤Ⅱ和Ⅳ的离子方程式(已知仅步骤Ⅰ得电子)。
Ⅰ.2CO2 +2e -=C2O ,Ⅱ.
,Ⅱ._______ ,Ⅲ.2CO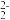 +CO2=2CO
+CO2=2CO +C, Ⅳ.
+C, Ⅳ._______ 。
 CH3OH(g)+H2O(g) ∆H= - 49kJ/mol
CH3OH(g)+H2O(g) ∆H= - 49kJ/mol(1)利于该反应自发的温度条件是
(2)该反应的历程及能量变化如图所示,过程

(3)二氧化碳催化加氢制甲醇合成总反应在起始物
 = 3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 x(CH3OH),在 t=250℃时 x(CH3OH)随压强(p)的变化及在p=5×103Pa时x(CH3OH)随温度(t)的变化,如图所示。
= 3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 x(CH3OH),在 t=250℃时 x(CH3OH)随压强(p)的变化及在p=5×103Pa时x(CH3OH)随温度(t)的变化,如图所示。
①图中对应等温过程的曲线是
②t=250℃时,当 x(CH3OH)=0.10 时,CO2的平衡转化率 α =
(4)CO2也可用于制作Li- CO2电池,在Li- CO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下 4个步骤进行,写出步骤Ⅱ和Ⅳ的离子方程式(已知仅步骤Ⅰ得电子)。
Ⅰ.2CO2 +2e -=C2O
 ,Ⅱ.
,Ⅱ.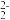 +CO2=2CO
+CO2=2CO +C, Ⅳ.
+C, Ⅳ.
您最近一年使用:0次
【推荐3】乙烷是天然气和页岩气中最常见的成分之一,工业上可以采用多种方法将乙烷转化为更有工业价值的乙烯。回答下列问题:
Ⅰ. 乙烷蒸汽裂解法
已知:
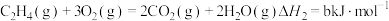
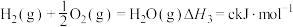
乙烷在一定条件可发生反应: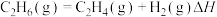
(1)
___________  (用含
(用含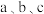 的表达式表示)。已知该反应高温时为自发反应,则该反应的反应热
的表达式表示)。已知该反应高温时为自发反应,则该反应的反应热
___________ 0(选填“ ”“
”“ ”或“
”或“ ”)。
”)。
(2)提高该反应平衡转化率的方法有___________ 、___________ 。
(3)一定温度下,在某恒容密闭容器内充入一定量的乙烷,若平衡时容器中总压为 、乙烷的平衡转化率为
、乙烷的平衡转化率为 。用含
。用含 、
、 的代数式表示该反应的平衡常数
的代数式表示该反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)一定条件下,该反应的速率方程为: ,其中k为反应速率常数,升高温度,该反应的速率常数
,其中k为反应速率常数,升高温度,该反应的速率常数___________ (选填“增大”“减小”或“不变”)。
Ⅱ. 乙烷氧化脱氢法
乙烷氧化脱氢制乙烯的产物中除C2H4外,还存在CO、CO2等副产物。我国学者结合实验与计算机模拟结果,研究了不同催化剂下乙烷的转化率和乙烯的选择性关系如图甲所示(乙烯的选择性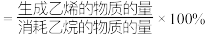 ),脱氢阶段反应进程如图乙所示(吸附在催化剂表面的粒子用
),脱氢阶段反应进程如图乙所示(吸附在催化剂表面的粒子用 标注,
标注, 表示过渡态)。
表示过渡态)。___________ (选填“a”或“b”),结合图甲解释理由是___________ 。
(6)图乙中代表催化性能较好的催化剂的反应历程是___________ (选填“c”或“d”),其判断依据是___________ 。
Ⅰ. 乙烷蒸汽裂解法
已知:

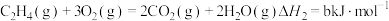
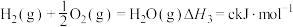
乙烷在一定条件可发生反应:
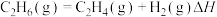
(1)

 (用含
(用含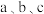 的表达式表示)。已知该反应高温时为自发反应,则该反应的反应热
的表达式表示)。已知该反应高温时为自发反应,则该反应的反应热
 ”“
”“ ”或“
”或“ ”)。
”)。(2)提高该反应平衡转化率的方法有
(3)一定温度下,在某恒容密闭容器内充入一定量的乙烷,若平衡时容器中总压为
 、乙烷的平衡转化率为
、乙烷的平衡转化率为 。用含
。用含 、
、 的代数式表示该反应的平衡常数
的代数式表示该反应的平衡常数
 总压
总压 物质的量分数)。
物质的量分数)。(4)一定条件下,该反应的速率方程为:
 ,其中k为反应速率常数,升高温度,该反应的速率常数
,其中k为反应速率常数,升高温度,该反应的速率常数Ⅱ. 乙烷氧化脱氢法
乙烷氧化脱氢制乙烯的产物中除C2H4外,还存在CO、CO2等副产物。我国学者结合实验与计算机模拟结果,研究了不同催化剂下乙烷的转化率和乙烯的选择性关系如图甲所示(乙烯的选择性
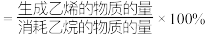 ),脱氢阶段反应进程如图乙所示(吸附在催化剂表面的粒子用
),脱氢阶段反应进程如图乙所示(吸附在催化剂表面的粒子用 标注,
标注, 表示过渡态)。
表示过渡态)。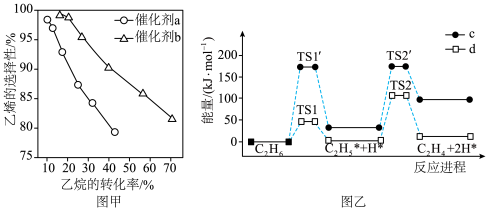
(6)图乙中代表催化性能较好的催化剂的反应历程是
您最近一年使用:0次



