铁是人体必需的微量元素之一,菠菜、黑木耳等食品中富含铁元素,其中菠菜中的铁元素至要以草酸亚铁 的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。
的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。
(1)草酸亚铁溶于稀硫酸的化学方程式是_______ 。
(2)菠菜的预处理

上述预处理流程中需要用到的仪器有烧杯、玻璃棒、酒精灯、_______ (从下图中选择,写出名称)。
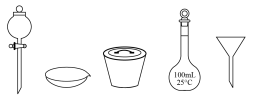
(3)检验待测液中是否含有 、
、
(4)利用 标准溶液测定菠菜中铁元素的含量
标准溶液测定菠菜中铁元素的含量
步骤I:取10.00mL待测液于锥形瓶中,滴加 溶液至溶液显紫色。
溶液至溶液显紫色。
步骤II:向步骤I得到的混合液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤III:向步骤II所得待测液中加入适量稀 溶液,用
溶液,用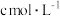 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液VmL。
溶液VmL。
①步骤I滴加 溶液的目的是
溶液的目的是_______ 。
②步骤III滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_______ 。
③菠菜中铁的含量为_______ mg/100g(即每100g菠菜中含铁元素的质量)。
 的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。
的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。(1)草酸亚铁溶于稀硫酸的化学方程式是
(2)菠菜的预处理

上述预处理流程中需要用到的仪器有烧杯、玻璃棒、酒精灯、

(3)检验待测液中是否含有
 、
、
| 检验试剂 | 现象 | 结论 |
| ① | 溶液变为红色 | 滤液中含有 |
| ② | ③ | 滤液中含有 |
 标准溶液测定菠菜中铁元素的含量
标准溶液测定菠菜中铁元素的含量步骤I:取10.00mL待测液于锥形瓶中,滴加
 溶液至溶液显紫色。
溶液至溶液显紫色。步骤II:向步骤I得到的混合液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤III:向步骤II所得待测液中加入适量稀
 溶液,用
溶液,用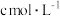 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液VmL。
溶液VmL。①步骤I滴加
 溶液的目的是
溶液的目的是②步骤III滴加
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为③菠菜中铁的含量为
更新时间:2022-12-22 10:57:14
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】某兴趣小组设计实验制取Cl2并验证Cl2的氧化性。回答下列问题:
(1)用K2MnO4与浓盐酸反应制取Cl2,装置如图甲:
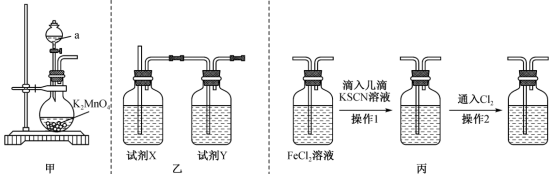
①反应的化学方程式为K2MnO4+8HCl(浓)=MnCl2+2Cl2↑+2KCl+4H2O,该反应中氧化剂为__________ (填化学式),若生成5.6 L Cl2(标准状况),则被氧化的盐酸为__________ mol。
②制取的Cl2中含有的杂质有__________ (填化学式),通过乙装置除去该杂质,则试剂X、试剂Y依次为__________ (填字母)。
A.饱和食盐水、碱石灰 B.饱和食盐水、浓硫酸 C.浓硫酸、饱和食盐水
(2)用图丙所示装置验证Cl2的氧化性。操作1后观察到现象为_________________________ ,操作2后观察到现象为________________________________________ ,产生操作2后现象的原因是__________________________________________ (用必要的语言和离子方程式说明)。
(3)KMnO4、K2MnO4均能与浓盐酸反应制取Cl2,充分反应后Mn元素的化合价均降为+2,消耗等物质的量的KMnO4、K2MnO4产生Cl2的体积(标准状况)更大的是__________ (填“KMnO4”或“K2MnO4”)。
(1)用K2MnO4与浓盐酸反应制取Cl2,装置如图甲:

①反应的化学方程式为K2MnO4+8HCl(浓)=MnCl2+2Cl2↑+2KCl+4H2O,该反应中氧化剂为
②制取的Cl2中含有的杂质有
A.饱和食盐水、碱石灰 B.饱和食盐水、浓硫酸 C.浓硫酸、饱和食盐水
(2)用图丙所示装置验证Cl2的氧化性。操作1后观察到现象为
(3)KMnO4、K2MnO4均能与浓盐酸反应制取Cl2,充分反应后Mn元素的化合价均降为+2,消耗等物质的量的KMnO4、K2MnO4产生Cl2的体积(标准状况)更大的是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
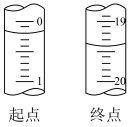
【推荐2】草酸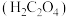 是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性
是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性 溶液发生反应:
溶液发生反应: 。某兴趣小组设计了测定硬水中钙离子的浓度的转化流程,如图所示,回答下列问题:
。某兴趣小组设计了测定硬水中钙离子的浓度的转化流程,如图所示,回答下列问题:

(1)盛装酸性 标准溶液应用
标准溶液应用_______ (填“酸式”或“碱式”)滴定管,注入酸性 标准溶液之前,滴定管需要
标准溶液之前,滴定管需要_______ 、洗涤和润洗。
(2)若用25.00mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处时,管内液体的体积_______(填标号)。
(3)写出“沉淀”反应的离子方程式:_______ 。
(4)“滴定”时判断滴定终点的依据是_______ 。
(5)本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的酸性 标准溶液为
标准溶液为_______ mL。该硬水样品中 的物质的量浓度为
的物质的量浓度为_______  。
。
(6)下列操作会使测得的硬水样品中 浓度偏高的是_______(填标号)。
浓度偏高的是_______(填标号)。
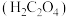 是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性
是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性 溶液发生反应:
溶液发生反应: 。某兴趣小组设计了测定硬水中钙离子的浓度的转化流程,如图所示,回答下列问题:
。某兴趣小组设计了测定硬水中钙离子的浓度的转化流程,如图所示,回答下列问题:
(1)盛装酸性
 标准溶液应用
标准溶液应用 标准溶液之前,滴定管需要
标准溶液之前,滴定管需要(2)若用25.00mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处时,管内液体的体积_______(填标号)。
| A.等于10.00mL | B.等于15.00mL | C.小于15.00mL | D.大于15.00mL |
(3)写出“沉淀”反应的离子方程式:
(4)“滴定”时判断滴定终点的依据是
(5)本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的酸性
 标准溶液为
标准溶液为 的物质的量浓度为
的物质的量浓度为 。
。
(6)下列操作会使测得的硬水样品中
 浓度偏高的是_______(填标号)。
浓度偏高的是_______(填标号)。| A.滴定管未用标准溶液润洗 | B.盛放草酸溶液的锥形瓶没有干燥 |
| C.滴定前仰视读数并记录数据 | D.草酸钙沉淀洗涤不充分 |
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】已知:单质 为目前人类使用最广泛的金属,氧化物
为目前人类使用最广泛的金属,氧化物 为具有磁性的黑色晶体,根据下列转化关系填空。
为具有磁性的黑色晶体,根据下列转化关系填空。

(1)试判断: 的
的名称 为______________ ,写出 的化学反应方程式
的化学反应方程式______________ 。
(2)实验室检验 溶液中的阳离子时,可加入氢氧化钠溶液,若先产生
溶液中的阳离子时,可加入氢氧化钠溶液,若先产生__________ 色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为________ 色,则含该离子。
(3)实验室检验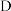 溶液中的阳离子时,通常可滴加
溶液中的阳离子时,通常可滴加________ (填写化学式),若溶液变为红色,则含该离子。
(4)写出固体 与过量盐酸反应的
与过量盐酸反应的离子方程式 ________________ 。
(5)写出 的
的离子方程式 __________________________________ 。
 为目前人类使用最广泛的金属,氧化物
为目前人类使用最广泛的金属,氧化物 为具有磁性的黑色晶体,根据下列转化关系填空。
为具有磁性的黑色晶体,根据下列转化关系填空。 
(1)试判断:
 的
的 的化学反应方程式
的化学反应方程式(2)实验室检验
 溶液中的阳离子时,可加入氢氧化钠溶液,若先产生
溶液中的阳离子时,可加入氢氧化钠溶液,若先产生(3)实验室检验
 溶液中的阳离子时,通常可滴加
溶液中的阳离子时,通常可滴加(4)写出固体
 与过量盐酸反应的
与过量盐酸反应的(5)写出
 的
的
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】已知A、B、C三种物质之间的转化关系:

(1)若B的溶液中加入KSCN溶液变红色,则A物质为____________ (用化学式表示).
向沸水中逐滴加入饱和B溶液,继续煮沸至溶液呈红褐色,所得分散系中粒子直径大小区间为__________ .B溶液可用于腐蚀铜线路板,其反应的离子方程式为____________ .C→A的化学方程式为____________ .
(2)若A、C均为既能溶于盐酸又能溶于NaOH溶液的白色物质,则C物质是____________ (用化学式表示).向B溶液中逐滴加入NaOH溶液至过量,则此过程中可观察到现象是____________ ,涉及的离子方程式为____________ ,B→C的离子方程式为____________ .

(1)若B的溶液中加入KSCN溶液变红色,则A物质为
向沸水中逐滴加入饱和B溶液,继续煮沸至溶液呈红褐色,所得分散系中粒子直径大小区间为
(2)若A、C均为既能溶于盐酸又能溶于NaOH溶液的白色物质,则C物质是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】已知 受热分解的化学方程式为:
受热分解的化学方程式为: ,请回答:
,请回答:

(1)将 受热产生的气体按图示装置进行实验,证实含有
受热产生的气体按图示装置进行实验,证实含有 和
和 ,能说明
,能说明 存在的实验现象是
存在的实验现象是_______________________ 。
(2)为测定 沉淀的质量,后续的操作步骤依次为
沉淀的质量,后续的操作步骤依次为_________ 、洗涤、干燥、称重。
(3)设计一个实验方案,用化学方法验证产物中有 生成(限选试剂:稀盐酸、KSCN溶液、
生成(限选试剂:稀盐酸、KSCN溶液、 溶液、10%
溶液、10% )
)___________________________________________ 。
 受热分解的化学方程式为:
受热分解的化学方程式为: ,请回答:
,请回答:
(1)将
 受热产生的气体按图示装置进行实验,证实含有
受热产生的气体按图示装置进行实验,证实含有 和
和 ,能说明
,能说明 存在的实验现象是
存在的实验现象是(2)为测定
 沉淀的质量,后续的操作步骤依次为
沉淀的质量,后续的操作步骤依次为(3)设计一个实验方案,用化学方法验证产物中有
 生成(限选试剂:稀盐酸、KSCN溶液、
生成(限选试剂:稀盐酸、KSCN溶液、 溶液、10%
溶液、10% )
)
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】醋酸是生活中最常见的调味剂和化工原料,国家标准规定酿造食醋中醋酸含量不得低于3.5g/100mL,某实验小组拟用酸碱中和滴定法测定某食醋的总酸含量。测定过程如图所示:
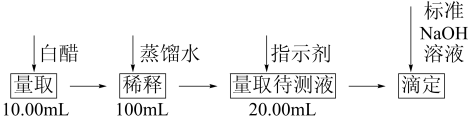
实验数据记录如下:
请回答:
(1)滴定时的指示剂应为___________ 。
(2)下列关于滴定分析的操作,不正确的是___________。

(3)标准NaOH溶液的浓度需用邻苯二甲酸氢钾(HOOCC6H4COOK)溶液准确测定而不能直接配制的原因是___________ 。
(4)用NaOH标准溶液滴定时,滴定管中滴定前有气泡,滴定后无气泡会导致测定结果___________ 。(选填“偏高”“偏低”或“无影响”)
(5)按正确数据计算,该食醋总酸含量为___________ g/100mL。

实验数据记录如下:
| 实验次数 | NaOH溶液的浓度/ mol•L-1 | NaOH滴定前读数/ mL | NaOH滴定后读数/ mL |
| 第1次 | 0.1010 | 0.00 | 21.40 |
| 第2次 | 0.1010 | 0.40 | 20.30 |
| 第3次 | 0.1010 | 0.10 | 20.20 |
(1)滴定时的指示剂应为
(2)下列关于滴定分析的操作,不正确的是___________。

| A.用酸式滴定管量取20.00 mL待测液转移至锥形瓶 |
| B.滴定时应一直观察滴定管中溶液体积的变化 |
| C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转 |
| D.如图中显示滴定终点时的读数是21.40mL |
(4)用NaOH标准溶液滴定时,滴定管中滴定前有气泡,滴定后无气泡会导致测定结果
(5)按正确数据计算,该食醋总酸含量为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。
(1)田老师利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
Ⅰ.分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用。
Ⅱ.用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
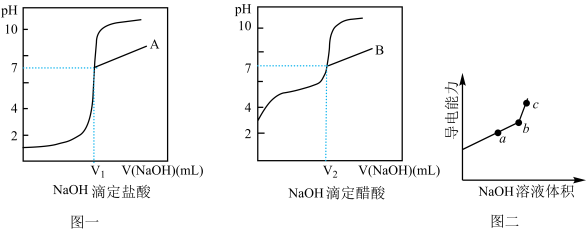
Ⅲ.由计算机绘制的滴定曲线如图一:
①A是_____ ;
②两曲线图中V1_____ V2(填“>”、“=”或“<”),A点和B点,水的电离程度相比_________ (填“A大”、“B大”、“一样大”或“无法判断”)。
(2)程老师利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:用_____ (填仪器名称)量取20.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_____ (填“是”、“否”或“不能确定”),向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见图二)。
①图中b点时,
_______ mol/L
②若图中某一点pH等于8,则c(Na+)﹣c(CH3COO﹣)的精确值为_____ mol/L。

(1)田老师利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
Ⅰ.分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用。
Ⅱ.用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
Ⅲ.由计算机绘制的滴定曲线如图一:
①A是
②两曲线图中V1
(2)程老师利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:用
①图中b点时,

②若图中某一点pH等于8,则c(Na+)﹣c(CH3COO﹣)的精确值为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】Ⅰ.某同学欲用0.10000 的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
A.移取20.00mL待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加2~3滴酚酞溶液。
B.用标准溶液润洗滴定管2~3次。
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D.取标准溶液注入酸式滴定管至“0”刻度以上2~3cm处。
E.调节液面至“0”或“0”以下刻度,记下读数。
F.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点,并记下滴定管液面的刻度。请填写下列空白:
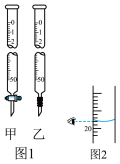
(1)正确的操作步骤顺序是______ (用字母表示)。
(2)步骤B中应选择图1中的滴定管______ (填“甲”或“乙”),该步操作的目的是______ 。
(3)若某次滴定结束时,酸式滴定管中的液面如图2所示,则读数为______ mL。若仰视,会使读数偏______ (填“大”或“小”)。
(4)结合下表数据,计算被测氢氧化钠溶液的物质的量浓度为______  (保留两位有效数字)。
(保留两位有效数字)。
Ⅱ.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。硫代硫酸钠( )又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,某兴趣小组设计如下实验方案,回答下列问题:
)又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,某兴趣小组设计如下实验方案,回答下列问题:
(5)现在称取10.00g硫代硫酸钠固体样品,配成100mL溶液;
滴定:取0.10 的
的 (硫酸酸化)标准溶液20.00mL,加入过量KI,发生反应:
(硫酸酸化)标准溶液20.00mL,加入过量KI,发生反应: ,然后加入
,然后加入______ 溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应: ,到达滴定终点时的现象为
,到达滴定终点时的现象为______ 。重复实验2-3次,平均消耗 样品溶液的体积为20.0mL。
样品溶液的体积为20.0mL。
(6)样品纯度的计算:根据上述有关数据,该样品中 的质量分数为
的质量分数为______ 。
 的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:A.移取20.00mL待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加2~3滴酚酞溶液。
B.用标准溶液润洗滴定管2~3次。
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D.取标准溶液注入酸式滴定管至“0”刻度以上2~3cm处。
E.调节液面至“0”或“0”以下刻度,记下读数。
F.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点,并记下滴定管液面的刻度。请填写下列空白:

(1)正确的操作步骤顺序是
(2)步骤B中应选择图1中的滴定管
(3)若某次滴定结束时,酸式滴定管中的液面如图2所示,则读数为
(4)结合下表数据,计算被测氢氧化钠溶液的物质的量浓度为
 (保留两位有效数字)。
(保留两位有效数字)。| 滴定次数 | 待测溶液体积/mL | 标准盐酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 20.00 | 2.34 | 20.39 |
| 第二次 | 20.00 | 3.20 | 20.30 |
| 第三次 | 20.00 | 0.60 | 17.50 |
Ⅱ.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。硫代硫酸钠(
 )又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,某兴趣小组设计如下实验方案,回答下列问题:
)又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,某兴趣小组设计如下实验方案,回答下列问题:(5)现在称取10.00g硫代硫酸钠固体样品,配成100mL溶液;
滴定:取0.10
 的
的 (硫酸酸化)标准溶液20.00mL,加入过量KI,发生反应:
(硫酸酸化)标准溶液20.00mL,加入过量KI,发生反应: ,然后加入
,然后加入 ,到达滴定终点时的现象为
,到达滴定终点时的现象为 样品溶液的体积为20.0mL。
样品溶液的体积为20.0mL。(6)样品纯度的计算:根据上述有关数据,该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】肼(N2H4)有较强的还原性,与N2O4等可组成火箭推进剂。
(1)已知:I.N2(g)+2O2(g)=2NO2(g) ΔH1=-67.7kJ·mol-1
Ⅱ.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.0kJ·mol-1
Ⅲ.NO2(g)
 N2O4(g) ΔH3=-26.4kJ·mol-1
N2O4(g) ΔH3=-26.4kJ·mol-1
火箭发射时N2H4与N2O4反应生成N2和H2O。该反应的热化学方程式是___________ 。
(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.NH3+NaClO=NH2Cl+NaOH (快)
ii.NH2Cl+NH3+NaOH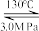 N2H4·H2O+NaCl (慢)
N2H4·H2O+NaCl (慢)
已知电负性N>Cl。下列说法正确的是___________ (填序号)。
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内N2H4·H2O的产量
c.采用3.0MPa压强可以增大NH3的溶解度,提高反应ii中NH2Cl的利用率
(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。蒸馏过程中首先馏出的物质是___________ (填序号)。
a.NH3 b.N2H4·H2O c.NaCl
(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用0.500mol·L-1 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00 mL。
溶液20.00 mL。
已知:N2H4+2 =4HI+N2。
=4HI+N2。
①样品中肼(以N2H4计)的质量分数为___________ 。
②若滴定过程中操作过于缓慢,则测定结果___________ (填“偏大”“偏小”“不受影响”)。
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如图所示。
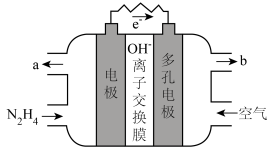
① 负极的电极反应式是___________ 。
② 电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因___________ 。
(1)已知:I.N2(g)+2O2(g)=2NO2(g) ΔH1=-67.7kJ·mol-1
Ⅱ.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.0kJ·mol-1
Ⅲ.NO2(g)

 N2O4(g) ΔH3=-26.4kJ·mol-1
N2O4(g) ΔH3=-26.4kJ·mol-1火箭发射时N2H4与N2O4反应生成N2和H2O。该反应的热化学方程式是
(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.NH3+NaClO=NH2Cl+NaOH (快)
ii.NH2Cl+NH3+NaOH
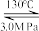 N2H4·H2O+NaCl (慢)
N2H4·H2O+NaCl (慢)已知电负性N>Cl。下列说法正确的是
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内N2H4·H2O的产量
c.采用3.0MPa压强可以增大NH3的溶解度,提高反应ii中NH2Cl的利用率
(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。蒸馏过程中首先馏出的物质是
a.NH3 b.N2H4·H2O c.NaCl
(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用0.500mol·L-1
 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00 mL。
溶液20.00 mL。已知:N2H4+2
 =4HI+N2。
=4HI+N2。①样品中肼(以N2H4计)的质量分数为
②若滴定过程中操作过于缓慢,则测定结果
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如图所示。

① 负极的电极反应式是
② 电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐2】Ⅰ.高铁电池也是研究较多的电动车的动力电池之一,高铁电池的充放电反应如下: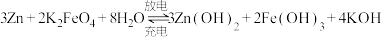
(1)放电时,负极反应式为___________ ,正极附近溶液的pH变___________ (填大或小)。
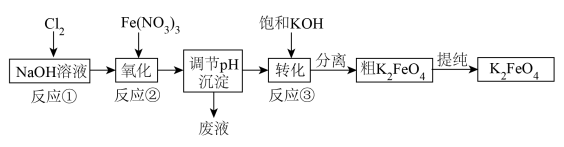
Ⅱ.工业上用湿法制备K2FeO4的流程如下图所示:___________ 。
(3)反应③加入饱和KOH溶液可析出K2FeO4的原因是___________ ,粗K2FeO4提纯得到K2FeO4的方法为___________ 。
Ⅲ.工业上常用滴定法测定高铁酸钾样品的纯度,其方法是:称取2.000 g K2FeO4样品溶于 KOH溶液中,加入足量KCrO2,充分反应后过滤,滤液在250 mL容量瓶中定容。定容后取25.00 mL加入稀硫酸酸化,用
KOH溶液中,加入足量KCrO2,充分反应后过滤,滤液在250 mL容量瓶中定容。定容后取25.00 mL加入稀硫酸酸化,用
 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00 mL。
溶液的体积为24.00 mL。
已知:a.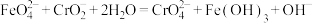
b.
c.
(4)实验过程中需要的玻璃仪器除烧杯、胶头滴管、滴定管之外,还需要___________ 。
(5)该K2FeO4样品的纯度为___________ (保留三位小数)。
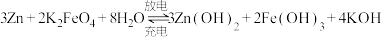
(1)放电时,负极反应式为
Ⅱ.工业上用湿法制备K2FeO4的流程如下图所示:
(3)反应③加入饱和KOH溶液可析出K2FeO4的原因是
Ⅲ.工业上常用滴定法测定高铁酸钾样品的纯度,其方法是:称取2.000 g K2FeO4样品溶于
 KOH溶液中,加入足量KCrO2,充分反应后过滤,滤液在250 mL容量瓶中定容。定容后取25.00 mL加入稀硫酸酸化,用
KOH溶液中,加入足量KCrO2,充分反应后过滤,滤液在250 mL容量瓶中定容。定容后取25.00 mL加入稀硫酸酸化,用
 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00 mL。
溶液的体积为24.00 mL。已知:a.
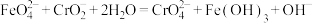
b.

c.

(4)实验过程中需要的玻璃仪器除烧杯、胶头滴管、滴定管之外,还需要
(5)该K2FeO4样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐3】硫酸亚铁铵晶体[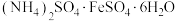 ]为浅蓝绿色,能溶于水、不溶于乙醇。在实验室中用铁屑来制备硫酸亚铁铵晶体的具体流程如下:
]为浅蓝绿色,能溶于水、不溶于乙醇。在实验室中用铁屑来制备硫酸亚铁铵晶体的具体流程如下:

回答下列问题:
(1)步骤①需要的玻璃仪器有烧杯、___________ 、___________ (填仪器名称)。
(2)制备硫酸亚铁过程加入炭黑的目的为___________ 。
(3)步骤②的具体操作为___________ 、___________ 、___________ 。
(4)“洗涤”包含水洗、醇洗,其中用乙醇洗涤的目的是___________ 。
(5)写出基态Fe原子的核外电子排布式:___________ 。
(6)称取16.0g制得的粗产品于100mL烧杯中,加入2mL3
 ,用少量水溶解,定容在100mL容量瓶中。准确移取20.00mL上述溶液于150mL锥形瓶中,加入5mL3
,用少量水溶解,定容在100mL容量瓶中。准确移取20.00mL上述溶液于150mL锥形瓶中,加入5mL3
 ,再用0.1
,再用0.1
 标准溶液滴定。平行滴定三次,平均消耗12.00mL
标准溶液滴定。平行滴定三次,平均消耗12.00mL 标准溶液,产品纯度为
标准溶液,产品纯度为___________ 。(写出计算过程,已知M[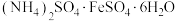 ]为392g/mol)
]为392g/mol)
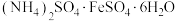 ]为浅蓝绿色,能溶于水、不溶于乙醇。在实验室中用铁屑来制备硫酸亚铁铵晶体的具体流程如下:
]为浅蓝绿色,能溶于水、不溶于乙醇。在实验室中用铁屑来制备硫酸亚铁铵晶体的具体流程如下:
回答下列问题:
(1)步骤①需要的玻璃仪器有烧杯、
(2)制备硫酸亚铁过程加入炭黑的目的为
(3)步骤②的具体操作为
(4)“洗涤”包含水洗、醇洗,其中用乙醇洗涤的目的是
(5)写出基态Fe原子的核外电子排布式:
(6)称取16.0g制得的粗产品于100mL烧杯中,加入2mL3

 ,用少量水溶解,定容在100mL容量瓶中。准确移取20.00mL上述溶液于150mL锥形瓶中,加入5mL3
,用少量水溶解,定容在100mL容量瓶中。准确移取20.00mL上述溶液于150mL锥形瓶中,加入5mL3
 ,再用0.1
,再用0.1
 标准溶液滴定。平行滴定三次,平均消耗12.00mL
标准溶液滴定。平行滴定三次,平均消耗12.00mL 标准溶液,产品纯度为
标准溶液,产品纯度为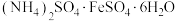 ]为392g/mol)
]为392g/mol)
您最近一年使用:0次




