硅材料在生活中占有重要地位。请回答:
(1) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为________ ,分子中氮原子的杂化轨道类型是_______ 。 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②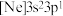 、③
、③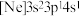 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________ ,该化合物的化学式为___________ 。

(1)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是(2)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、②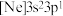 、③
、③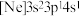 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |

2023·浙江·高考真题 查看更多[8]
2023年1月浙江省普通高校招生选考化学试题(已下线)2023年1月浙江省普通高校招生选考变式题(结构与性质)(已下线)专题20 结构与性质(已下线)2023年高考化学真题完全解读(浙江1月)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)
更新时间:2023-01-11 15:37:08
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】随着原子序数的递增,8种短周期元素(用英文字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
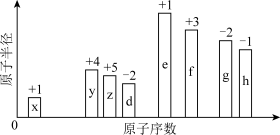
(1)这8种元素中,金属性最强的元素在周期表中的位置是___________ 。
(2)元素x分别与y、z、d形成的10电子气态分子中,热稳定性由强到弱的顺序为___________ (填化学式)。元素z、d、e、f形成的简单离子,半径较大的离子是___________ (填离子符号)。
(3)将化合物eh由固态加热至熔融态,吸收的能量主要用于断裂___________ 键(填“离子”或“共价”)。x与d可形成多种共价分子,其中三原子共价分子的电子式为___________ ;四原子共价分子的结构式为___________ 。
(4)不能作为比较g与h的非金属性强弱的依据是___________。
(5)f的单质与盐酸发生反应的离子方程式为___________ 。

(1)这8种元素中,金属性最强的元素在周期表中的位置是
(2)元素x分别与y、z、d形成的10电子气态分子中,热稳定性由强到弱的顺序为
(3)将化合物eh由固态加热至熔融态,吸收的能量主要用于断裂
(4)不能作为比较g与h的非金属性强弱的依据是___________。
| A.氢化物酸性h强于g |
B.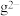 的还原性强于 的还原性强于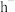 |
| C.与x单质反应,g单质比h单质更困难 |
| D.常温下g单质呈固态,h单质呈气态 |
(5)f的单质与盐酸发生反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
(1)③④⑦的原子半径由大到小的顺序为____ (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为____ (用酸的化学式表示)。
(3)②④两种元素按原子个数之比为1:1组成的化合物的电子式____ 。
(4)①②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式___ 。
(5)表中⑤的单质和④的最高价氧化物水化物反应的化学方程式为____ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③④⑦的原子半径由大到小的顺序为
(2)⑥和⑦的最高价含氧酸的酸性强弱为
(3)②④两种元素按原子个数之比为1:1组成的化合物的电子式
(4)①②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式
(5)表中⑤的单质和④的最高价氧化物水化物反应的化学方程式为
您最近一年使用:0次
【推荐3】前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)A元素在周期表中的位置为_______ ,其基态原子的价电子排布图为_______ 。
(2)A、B、D三种元素第一电离能由大到小的顺序为_______ (用元素符号表示)。B、C、D三种元素的简单离子的半径由大到小的顺序为_______ (用离子符号表示)。
(3)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式_______ 。
(4)E元素基态原子核外有_______ 种运动状态不同的电子,该元素的简化电子排布式为_______ 。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布式为 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
(1)A元素在周期表中的位置为
(2)A、B、D三种元素第一电离能由大到小的顺序为
(3)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式
(4)E元素基态原子核外有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】前四周期元素结构信息见表,回答下列问题。
(1)A、B、C、E四种元素,第一电离能由大到小的顺序为_______ (用元素符号表示)。A、B、C三种元素最高价氧化物的水化物酸性由弱到强的顺序为_______ (用氧化物的水化物化学式表示)
(2)D在元素周期表中的位置_______ ,其基态原子的核外电子排布式为_______ 。
(3)写出B基态原子价电子的轨道表示式_______ 。
(4)E位于元素周期表的_______ 区,基态原子填有电子的轨道数为_______ 。
(5)与E同周期且未成对电子数最多的元素是_______ ,其基态原子占据最高能级的电子云轮廓图为_______ 形。
| 元素 | 结构信息 |
| A | 基态原子有6个原子轨道填充满电子,有3个未成对电子 |
| B | M层电子数比L层电子数少两个 |
| C | 基态原子有17个不同运动状态的电子 |
| D | 基态原子的价电子排布为 ,在常见化合物中其最高正价为+7 ,在常见化合物中其最高正价为+7 |
| E | 基态原子的M层全充满,N层没有成对电子,只有1个未成对电子 |
(2)D在元素周期表中的位置
(3)写出B基态原子价电子的轨道表示式
(4)E位于元素周期表的
(5)与E同周期且未成对电子数最多的元素是
您最近一年使用:0次
【推荐2】回答下列问题
(1)N原子的轨道排布式___________ Fe2+的电子排布式为___________ 。
(2)请写出33号元素符号名称___________ ,并写出该原子的外围电子排布式为___________ 。
(3)钒在元素周期表中的位置为___________ ,其价层电子排布图为___________ 。
(4)基态原子的N层有一个未成对电子,M层未成对电子最多的元素,其电子排布式为___________ 。
(1)N原子的轨道排布式
(2)请写出33号元素符号名称
(3)钒在元素周期表中的位置为
(4)基态原子的N层有一个未成对电子,M层未成对电子最多的元素,其电子排布式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】镁铝尖晶石作为一种有前途的绿色环保型无机功能材料,向其中参入Cr、Mn、Ti等过渡元素,可使镁铝尖晶石发光材料实现发光颜色的转变和发光效率的提高,适应其在发光二极管、显示器及固态照明等领域的应用。
(1)钛元素属于元素周期表_______ 区,基态钛原子核外有_______ 种运动状态不同的电子。下列Al原子的核外电子排布式中,能量最低的是_______ (填字母)。
a.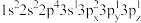 b.
b.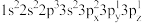
c.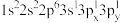 d.
d.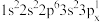
(2)镁铝尖晶石由Mg、Al、O元素组成,按第一电离能由大到小的排列顺序为_______ 。
(3)一种烷基铝配合物的结构如图,该物质中碳的杂化类型为_______ ,氮与其成键的3原子共同构成的空间构型为_______ ,氮与铝形成的是_______ 键(填编号,双选)
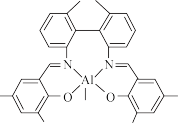
a.配位键 b.金属键 d.σ键 d.π键
(4)氯化铬(CrCl3)熔点为83℃,氯化镍(NiCl2)的熔点为1001℃,氯化铬的熔点远低于氯化镍的熔点,原因是_______ 。
(5)某种镁铝尖晶石的立方晶胞结构如图所示,晶胞中含有A型和B型两种结构单元。

与O2-最邻近的Al3+离子数为_______ ,若晶胞边长为apm,阿伏加德罗常数为NA,则该尖晶石的密度为_______ g/cm3(用含a、NA的代数式表示)。
(1)钛元素属于元素周期表
a.
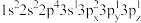 b.
b.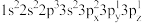
c.
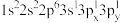 d.
d.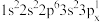
(2)镁铝尖晶石由Mg、Al、O元素组成,按第一电离能由大到小的排列顺序为
(3)一种烷基铝配合物的结构如图,该物质中碳的杂化类型为

a.配位键 b.金属键 d.σ键 d.π键
(4)氯化铬(CrCl3)熔点为83℃,氯化镍(NiCl2)的熔点为1001℃,氯化铬的熔点远低于氯化镍的熔点,原因是
(5)某种镁铝尖晶石的立方晶胞结构如图所示,晶胞中含有A型和B型两种结构单元。

与O2-最邻近的Al3+离子数为
您最近一年使用:0次
【推荐1】Ⅰ.金属镍在工业上应用广泛,请回答下列问题。
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是____ (用元素符号表示)。
(2)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。与CO互为等电子体的阴离子是____ (只写一种),CO分子内σ键与π键个数之比为____ 。1mol Ni(CO)n中含σ键为____ mol。
(3)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C原子的杂化方式为____ ,甲醇分子内的O-C-H键角____ (填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角。
Ⅱ.(1)已知NH3易溶于水,主要原因是____ 。
(2)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6____ (填“>”“<”或“=”)HIO4。
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
(2)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
(3)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C原子的杂化方式为
Ⅱ.(1)已知NH3易溶于水,主要原因是
(2)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
您最近一年使用:0次
【推荐2】原子序数小于36的X、Y、Z、W、Q、R六种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,Y原子核外电子占据3个轨道,Z是形成化合物种类最多的元素,R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同。
Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为_________________ ,比较NH3和[Cu(NH3)2]+中H-N-H键角的大小:NH3___ [Cu(NH3)2]+(填“大于”或“小于”),并说明理由_________________
(2)Z2X2与XZW反应可得丙烯腈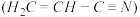 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是_____________
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式____________________________________
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为__________ 。
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为___________ (用化学式表示),其理由为_______________ 。
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为____________ , RZ2的密度___________ g/cm3(用a、b表示)。

Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为
(2)Z2X2与XZW反应可得丙烯腈
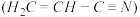 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为_________ ;B和N相比,电负性较大的是_________ ,BN中B元素的化合价为_________ ;
(2)在BF3分子中,F-B-F的键角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______ ;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________ ,层间作用力为________ ;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______ 各氮原子、________ 各硼原子,立方氮化硼的密度是_______ g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
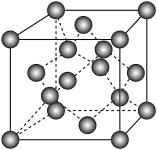
(1)基态B原子的电子排布式为
(2)在BF3分子中,F-B-F的键角是
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
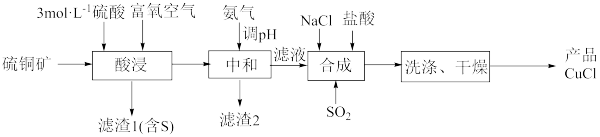
【推荐1】一种用硫铜矿(主要含CuS、 及少量FeO、
及少量FeO、 等)为原料制备CuCl的工艺流程如下:
等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成 ;
;
②CuCl在潮湿的空气中易被氧化,生成的碱式盐为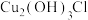 ;
;
③已知 、
、 、
、 开始生成沉淀和沉淀完全时的pH如下表:
开始生成沉淀和沉淀完全时的pH如下表:
回答下列问题:
(1)“酸浸”时,富氧空气的作用_______ 。
(2)“酸浸”时,CuS反应的化学方程式为_______ 。
(3)用氨水调pH时,应将溶液的范围调整为_______ 。
(4)“合成”时, 生成CuCl发生反应的离子方程式为
生成CuCl发生反应的离子方程式为_______ 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L
溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L 的
的 溶液滴定到终点,发生反应为
溶液滴定到终点,发生反应为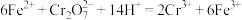
 ,消耗
,消耗 溶液V mL,样品中CuCl的质量分数为
溶液V mL,样品中CuCl的质量分数为_______ (杂质不参与反应,列出计算式即可)。
(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。
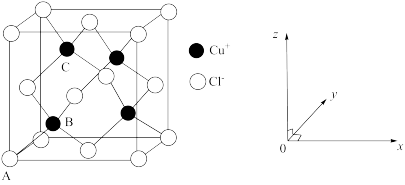
①图中原子的坐标参数:A为 ,B为
,B为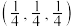 ,则C的坐标参数为
,则C的坐标参数为_______ 。
② 与
与 最短的距离是
最短的距离是_______ nm。
 及少量FeO、
及少量FeO、 等)为原料制备CuCl的工艺流程如下:
等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成
 ;
;②CuCl在潮湿的空气中易被氧化,生成的碱式盐为
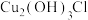 ;
;③已知
 、
、 、
、 开始生成沉淀和沉淀完全时的pH如下表:
开始生成沉淀和沉淀完全时的pH如下表:| 金属离子 |  |  |  |
| 开始沉淀pH | 4.7 | 8.1 | 1.2 |
| 完全沉淀pH | 6.7 | 9.6 | 3.2 |
(1)“酸浸”时,富氧空气的作用
(2)“酸浸”时,CuS反应的化学方程式为
(3)用氨水调pH时,应将溶液的范围调整为
(4)“合成”时,
 生成CuCl发生反应的离子方程式为
生成CuCl发生反应的离子方程式为(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L
溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L 的
的 溶液滴定到终点,发生反应为
溶液滴定到终点,发生反应为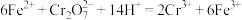
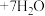 ,消耗
,消耗 溶液V mL,样品中CuCl的质量分数为
溶液V mL,样品中CuCl的质量分数为(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。

①图中原子的坐标参数:A为
 ,B为
,B为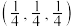 ,则C的坐标参数为
,则C的坐标参数为②
 与
与 最短的距离是
最短的距离是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】研究表明TiO2-aNb、Cu(In1-xGaxSe2)是光学活性物质,请回答下列问题:
(1)基态Ti原子核外电子占据的最高能级符号为____ ,Ga、In、Se,第一电离能从大到小顺序为____ 。
(2)SeO 的立体构型为
的立体构型为____ ;SeO2中硒原子采取的杂化类型是____ 。
(3)31Ga可以形成GaCl3•xNH3(x=3,4,5,6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,生成沉淀;过滤后,充分加热滤液有氨气逸出,又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶质的化学式为____ 。
(4)Cu2+与NH3形成的配离子为[Cu(NH3)4]2+,在该配离子中,氮氢键的键角比独立的氨气分子中键角略大,其原因是____ 。
(5)TiO2通过氮掺杂反应生成TiO2-aNb,可表示如图,则TiO2-aNb晶体中a=____ ,b=____ 。

(1)基态Ti原子核外电子占据的最高能级符号为
(2)SeO
 的立体构型为
的立体构型为(3)31Ga可以形成GaCl3•xNH3(x=3,4,5,6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,生成沉淀;过滤后,充分加热滤液有氨气逸出,又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶质的化学式为
(4)Cu2+与NH3形成的配离子为[Cu(NH3)4]2+,在该配离子中,氮氢键的键角比独立的氨气分子中键角略大,其原因是
(5)TiO2通过氮掺杂反应生成TiO2-aNb,可表示如图,则TiO2-aNb晶体中a=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为_______ 。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______ Ⅰ1(Cu)(填“大于”或“小于”)。原因是_________ 。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________ ;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是_________ 。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为_________ ,C原子的杂化形式为________ 。
(5)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为_________ g·cm-3(列出计算式)。

(1)Zn原子核外电子排布式为
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为
(5)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为

您最近一年使用:0次



