根据所学的知识回答以下问题。
(1)在常温下,有下列4种溶液:
①取这四种溶液各 稀释至
稀释至 ,所得溶液的
,所得溶液的 由大到小的顺序是
由大到小的顺序是_______ (用编号表示)
②恰好中和一定量的B溶液,消耗的C溶液和D溶液的体积的大小关系是C_______ D(填“ ”,“
”,“ ”或“
”或“ ”)
”)
③将A溶液和D溶液等体积混合,混合后溶液中离子浓度的大小关系是_______ ;
④将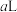 溶液B与
溶液B与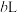 溶液D混合后,若所得溶液的
溶液D混合后,若所得溶液的 ,则
,则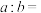
_______ (忽略混合后溶液体积的变化)
(2)已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。
A是宇宙中含量最多的元素;
B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
C元素原子的价层电子排布是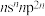 ;
;
D元素是金属性最强的短周期元素;
E与D的最高能层数相同,但其价层电子数等于其电子层数;
F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
请根据以上信息回答以下问题。
①写出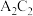 的电子式
的电子式_______
②写出元素F的核外电子排布式_______
③B、C、D、E四种元素第一电离能由小到大的顺序是_______ (用元素符号表示)
(1)在常温下,有下列4种溶液:
| 编号 | A | B | C | D |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
 | 11 | 11 | 3 | 3 |
①取这四种溶液各
 稀释至
稀释至 ,所得溶液的
,所得溶液的 由大到小的顺序是
由大到小的顺序是②恰好中和一定量的B溶液,消耗的C溶液和D溶液的体积的大小关系是C
 ”,“
”,“ ”或“
”或“ ”)
”)③将A溶液和D溶液等体积混合,混合后溶液中离子浓度的大小关系是
④将
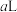 溶液B与
溶液B与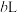 溶液D混合后,若所得溶液的
溶液D混合后,若所得溶液的 ,则
,则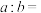
(2)已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。
A是宇宙中含量最多的元素;
B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
C元素原子的价层电子排布是
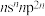 ;
;D元素是金属性最强的短周期元素;
E与D的最高能层数相同,但其价层电子数等于其电子层数;
F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
请根据以上信息回答以下问题。
①写出
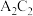 的电子式
的电子式②写出元素F的核外电子排布式
③B、C、D、E四种元素第一电离能由小到大的顺序是
更新时间:2023/02/02 09:59:41
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100 mL 3 mol·L-1的NaOH溶液吸收标准状况下6.72 L SO2时,所得溶液显酸性,溶液中各离子浓度由大到小的顺序为_______________________________________________ 。
(2)常温下,向一定体积的0.1 mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是________ 。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
(3)在T ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
假设溶液混合前后的体积变化忽略不计,则c为________ 。
A.3 B.4 C.5 D.6
(4)常温下,浓度均为0.1 mol·L-1的下列三种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01 mol·L-1的下列三种酸的溶液分别稀释100倍,pH变化最小的是________ 。
A.HCN B.HClO C.CH3COOH
②根据以上数据,判断下列反应可以成立的是________ 。
A.CH3COOH+NaClO=HClO+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.HCN+NaClO=NaCN+HClO
(5)几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,________ (填离子符号)先沉淀,Ksp[Fe(OH)2]________ (填“>”“=”或“<”)Ksp[Mg(OH)2]。
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100 mL 3 mol·L-1的NaOH溶液吸收标准状况下6.72 L SO2时,所得溶液显酸性,溶液中各离子浓度由大到小的顺序为
(2)常温下,向一定体积的0.1 mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中
 不变
不变(3)在T ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
(4)常温下,浓度均为0.1 mol·L-1的下列三种溶液的pH如表所示:
溶质 | CH3COONa | NaClO | NaCN |
pH | 8.8 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01 mol·L-1的下列三种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+NaClO=HClO+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.HCN+NaClO=NaCN+HClO
(5)几种离子开始沉淀时的pH如表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】按要求填空:
(1)下列物质中,属于电解质的是___________ ,属于强电解质的是___________ ,属于弱电解质的是___________ (填序号)。
①H2SO4;②盐酸;③硫酸钡;④乙醇;⑤铜;⑥H2S;⑦蔗糖;⑧氨气;⑨NH4HSO3
(2)已知水的电离平衡曲线如图所示,试回答下列问题:

①图中A、B、C、D、E五点的Kw间的大小关系是___________ 。(用A、B、C、D、E表示)
②若从A点到D点,可采用的措施是___________ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH固体
③点B对应温度条件下,某溶液pH=7,此时,溶液呈___________ (酸性、碱性、中性)。
④25 ℃时,若pH=a的100体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该a+b=___________ 。
(1)下列物质中,属于电解质的是
①H2SO4;②盐酸;③硫酸钡;④乙醇;⑤铜;⑥H2S;⑦蔗糖;⑧氨气;⑨NH4HSO3
(2)已知水的电离平衡曲线如图所示,试回答下列问题:

①图中A、B、C、D、E五点的Kw间的大小关系是
②若从A点到D点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH固体
③点B对应温度条件下,某溶液pH=7,此时,溶液呈
④25 ℃时,若pH=a的100体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该a+b=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】水溶液中的离子平衡是中学学习的一个重要内容。请回答下列有关问题。
(1)常温下,用0.1000 mol/L氨水滴定盐酸,当达到滴定终点时,溶液pH___________ 7(填“>”、“<”或“=”),溶液中各离子浓度从大到小的顺序为___________ ;为了减小滴定误差,在滴定实验中使用的酸碱指示剂最好是___________ 。(填字母)
A.甲基橙 B.酚酞 C.石蕊 D.以上均可
(2)常温下,将1 mL pH=12的NaOH溶液加水稀释到100 mL,稀释后溶液中 =
=___________ 。
(3)某温度下,测得0.1 mol/L NaOH溶液pH为11,则该温度下水的离子积常数Kw=___________ 。
(4)浓度相等的盐酸和醋酸各100 mL,分别与过量的Zn反应,相同条件下生成H2的体积分别为V1和V2,则V1___________ V2(填“>”、“<”或“=”)
(5)已知:Kw=1.0×10-14,Al(OH)3 AlO
AlO + H+ + H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于
+ H+ + H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于___________ 。
(1)常温下,用0.1000 mol/L氨水滴定盐酸,当达到滴定终点时,溶液pH
A.甲基橙 B.酚酞 C.石蕊 D.以上均可
(2)常温下,将1 mL pH=12的NaOH溶液加水稀释到100 mL,稀释后溶液中
 =
=(3)某温度下,测得0.1 mol/L NaOH溶液pH为11,则该温度下水的离子积常数Kw=
(4)浓度相等的盐酸和醋酸各100 mL,分别与过量的Zn反应,相同条件下生成H2的体积分别为V1和V2,则V1
(5)已知:Kw=1.0×10-14,Al(OH)3
 AlO
AlO + H+ + H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于
+ H+ + H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】亚硝酸(HNO2)是一种比醋酸略强的一元弱酸。
(1)设计一种实验方案,证明亚硝酸是弱酸:___________ 。
(2)某化学小组设计以下方法测定亚硝酸溶液浓度。298K时,用0.1000mol/L的NaOH溶液滴定未知浓度的20.00ml HNO2溶液,滴定过程中溶液pH与NaOH溶液体积的关系如图所示:
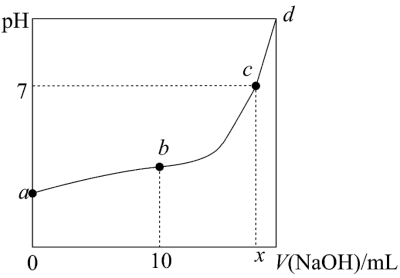
①图中a、b两点水的电离程度;b___________ a(填“>”或者“<”),图中b点离子浓度大小关系:___________ 。
②此滴定实验中选用___________ 为指示剂误差最小。
A.紫色石蕊 B.酚酞 C.甲基橙
③依据以下实验数据,计算c(HNO2)=___________ 。
④以下操作会引起所测溶液浓度偏小的是___________
A.未润洗酸式滴定管
B.碱式滴定管开始时有气泡,滴定终点时无气泡
C.碱式滴定管滴定前平视读数,滴定后俯视读数
(3)HNO2有很强的还原性,也可以用酸性KMnO4滴定HNO2浓度。滴定时,将HNO2溶液装入锥形瓶,用___________ (填“酸式”或“碱式”)滴定管盛装KMnO4标准液进行操作。达到滴定终点的现象是___________ 。
(1)设计一种实验方案,证明亚硝酸是弱酸:
(2)某化学小组设计以下方法测定亚硝酸溶液浓度。298K时,用0.1000mol/L的NaOH溶液滴定未知浓度的20.00ml HNO2溶液,滴定过程中溶液pH与NaOH溶液体积的关系如图所示:

①图中a、b两点水的电离程度;b
②此滴定实验中选用
A.紫色石蕊 B.酚酞 C.甲基橙
③依据以下实验数据,计算c(HNO2)=
| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.00 | 19.98 |
| 2 | 1.26 | 23.40 |
| 3 | 1.54 | 21.56 |
A.未润洗酸式滴定管
B.碱式滴定管开始时有气泡,滴定终点时无气泡
C.碱式滴定管滴定前平视读数,滴定后俯视读数
(3)HNO2有很强的还原性,也可以用酸性KMnO4滴定HNO2浓度。滴定时,将HNO2溶液装入锥形瓶,用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图。该实验的主要操作步骤如下:
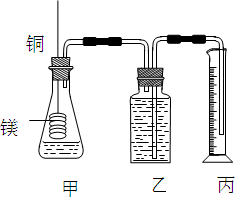
(1)a.配制浓度均为1 mol·L-1盐酸和醋酸溶液;
b.用______ 量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
c.分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为______ g;
d.在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
e.将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录______ ;
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应______ ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
(2)用文字表述d检查该装置气密性的操作与观察方法:______ 。
(3)本实验中应选用______(填序号)的量筒。
(4)简述速率不等的原因______ ,铜丝不与酸接触的原因是______ 。

(1)a.配制浓度均为1 mol·L-1盐酸和醋酸溶液;
b.用
c.分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为
d.在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
e.将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应
请将上述步骤补充完整并回答下列问题:
(2)用文字表述d检查该装置气密性的操作与观察方法:
(3)本实验中应选用______(填序号)的量筒。
| A.100 mL | B.200 mL | C.500 mL |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】硫酸、盐酸、醋酸、碳酸、氨水及其盐是生活中常见的物质。
(1)等浓度的五种溶液①(NH4)2CO3、②NH4Cl、③NH4HSO4、④CH3COONH4、⑤NH3·H2O,则c( )由大到小排列的顺序为
)由大到小排列的顺序为_________ (用序号比较)。
(2)25°C时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是 。
(3)25°C时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的H+浓度与氯化铵溶液中水电离出的H+浓度之比是_________ 。
(4)①常温下,pH=5的NaHSO4溶液中水的电离程度______ pH=9的NH3·H2O中水的电离程度(填“>”“=”或“<”);
②等体积等物质的量浓度的NaHSO4与氨水混合后溶液呈____ 性 (填“酸、中、碱”),针对该混合溶液下列说法正确的是_________ (填选项代号)。
A.c( )+c(H+)=c(
)+c(H+)=c( )+c(OH- )
)+c(OH- )
B. c(Na+)=c(H+)+c( )
)
C. c( )=c(
)=c( )+c(NH3·H2O)
)+c(NH3·H2O)
③常温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+ )+c( )
)______ 2c( ) (填“>”“=”或“<”);
) (填“>”“=”或“<”);
④常温下,向100mL0.2mol·L-1NaHSO4溶液加入0.2mol·L-1Ba(OH)2溶液,则 恰好完全沉淀时溶液的pH=
恰好完全沉淀时溶液的pH=________ 。
(1)等浓度的五种溶液①(NH4)2CO3、②NH4Cl、③NH4HSO4、④CH3COONH4、⑤NH3·H2O,则c(
 )由大到小排列的顺序为
)由大到小排列的顺序为(2)25°C时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是 。
| A.两溶液的pH相同 |
| B.两溶液的导电能力相同 |
| C.两溶液中由水电离出的c(OH-)相同 |
| D.中和等物质的量的NaOH,消耗两溶液的体积相同 |
(4)①常温下,pH=5的NaHSO4溶液中水的电离程度
②等体积等物质的量浓度的NaHSO4与氨水混合后溶液呈
A.c(
 )+c(H+)=c(
)+c(H+)=c( )+c(OH- )
)+c(OH- )B. c(Na+)=c(H+)+c(
 )
)C. c(
 )=c(
)=c( )+c(NH3·H2O)
)+c(NH3·H2O)③常温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+ )+c(
 )
) ) (填“>”“=”或“<”);
) (填“>”“=”或“<”);④常温下,向100mL0.2mol·L-1NaHSO4溶液加入0.2mol·L-1Ba(OH)2溶液,则
 恰好完全沉淀时溶液的pH=
恰好完全沉淀时溶液的pH=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知几种元素的性质或原子结构的相关叙述如表所示。
回答下列问题:
(1)写出工业上用X的单质来制备粗硅的化学方程式_________________________ 。
(2)Y形成的另一种单质主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是________ 。
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是__________ (写化学式)。
(4)画出T原子的结构示意图:____________ 。
(5)T元素组成的单质在Y元素组成的常见单质中燃烧,得到的产物的化学式是________ ,电子式是____________ 。
| 元素 | 元素性质或原子结构的相关叙述 |
| T | 失去1个电子后,形成与Ne相同的核外电子排布 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
| Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
(1)写出工业上用X的单质来制备粗硅的化学方程式
(2)Y形成的另一种单质主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是
(4)画出T原子的结构示意图:
(5)T元素组成的单质在Y元素组成的常见单质中燃烧,得到的产物的化学式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D、E均为短周期元素,非金属元素A的最外层电子数与其周期数相等,B的成对电子与未成对电子所占据的原子轨道数相等。单质B在单质C中充分燃烧生成BC2。D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水会得到一种强酸。回答下列问题:
(1)A在元素周期表中的位置是_______ ,E的元素符号是_______ 。
(2)由B、C组成的化合物中,共用电子对偏向_______ (填元素名称)。
(3)元素D的原子由激发态跃迁到基态时会释放_______ 色的光。
(4)由这些元素组成的某些物质的组成和结构信息如下表:
a的电子式为_______ ;b的化学式为_______ ;c的空间构型为_______ 。
(1)A在元素周期表中的位置是
(2)由B、C组成的化合物中,共用电子对偏向
(3)元素D的原子由激发态跃迁到基态时会释放
(4)由这些元素组成的某些物质的组成和结构信息如下表:
| 物质 | 组成和结构 |
| a | A、D两元素组成的离子化合物 |
| b | 由C、D两元素组成的含有非极性键的离子化合物 |
| c | 化学组成为BCE2 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】有A、B、C、D四种元素,A元素的氢氧化物水溶液通常用于CO2气体的检验; A和C形成离子化合物AC2,其中C离子与A离子的核外电子数相等; B元素的单质是密度最小的一种气体; D是地壳中含量最高的元素。
(1)试写出下列字符代表的元素符号。A___________ ,B___________ , C___________ , D___________ 。
(2)试写出B和D形成化合物的分子式:___________ 。
(3)试写出在反应物中包含这四种元素的反应方程式:___________ (任写一个)。
(4)铁元素有四种稳定的核素,分别是54Fe、56Fe、57Fe 和58Fe,在自然界中丰度分别是5.8%、91.72%、 2.1%和0.28%。Fe原子共有4个电子层,最外层电子数等于最内层电子数,次外层电子数是最外层的7倍。
①试写出铁—58 的核素符号:___________ ;
②铁元素的相对原子质量为___________ (保留 2位小数);
③铁和氯气反应生成氯化铁(三价铁),铁和稀硫酸反应生成硫酸亚铁(二价铁)。甲同学说,根据以上事实说明氯气的氧化性强于稀硫酸。乙同学说,反应的温度不同,故不能说明氯气的氧化性强于稀硫酸。你赞同___________ (填 “甲”或“乙”)同学的观点,原因是___________ 。
(1)试写出下列字符代表的元素符号。A
(2)试写出B和D形成化合物的分子式:
(3)试写出在反应物中包含这四种元素的反应方程式:
(4)铁元素有四种稳定的核素,分别是54Fe、56Fe、57Fe 和58Fe,在自然界中丰度分别是5.8%、91.72%、 2.1%和0.28%。Fe原子共有4个电子层,最外层电子数等于最内层电子数,次外层电子数是最外层的7倍。
①试写出铁—58 的核素符号:
②铁元素的相对原子质量为
③铁和氯气反应生成氯化铁(三价铁),铁和稀硫酸反应生成硫酸亚铁(二价铁)。甲同学说,根据以上事实说明氯气的氧化性强于稀硫酸。乙同学说,反应的温度不同,故不能说明氯气的氧化性强于稀硫酸。你赞同
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是___________ , 的核外电子排布式为
的核外电子排布式为___________ 。
(2)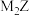 的熔点比
的熔点比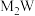 的
的________ (填“高”或“低”),请解释原因:_________ 。
(3)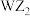 的VSEPR模型名称为
的VSEPR模型名称为_________ ;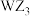 的三聚体环状结构如图所示,该结构的一个分子中含有
的三聚体环状结构如图所示,该结构的一个分子中含有________ 个 键;写出一种与
键;写出一种与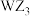 互为等电子体的分子的化学式
互为等电子体的分子的化学式________ 。___________ ;其硫酸盐结晶水合物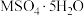 可写成
可写成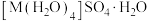 ,结构示意图如图2:
,结构示意图如图2:___________ (填字母)。
A.在上述结构示意图中,所有氧原子都采用 杂化
杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.该硫酸盐结晶水合物晶体属于分子晶体,分子间存在氢键
D.该硫酸盐结晶水合物中的水在不同温度下会分步失去
往M的硫酸盐溶液中加入过量氨水,可生成 配离子。已知
配离子。已知 与
与 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是___________ 。
| 元素 | 相关信息 |
| Y | 原子核外有6个不同运动状态的电子 |
| Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
| W | 主族元素,与Z原子的价电子数相同 |
| R | 价层电子排布式为 |
| M | 位于第IB族,其被称作“电器工业的主角” |
(1)Z、W元素相比,第一电离能较大的是
 的核外电子排布式为
的核外电子排布式为(2)
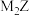 的熔点比
的熔点比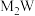 的
的(3)
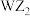 的VSEPR模型名称为
的VSEPR模型名称为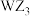 的三聚体环状结构如图所示,该结构的一个分子中含有
的三聚体环状结构如图所示,该结构的一个分子中含有 键;写出一种与
键;写出一种与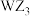 互为等电子体的分子的化学式
互为等电子体的分子的化学式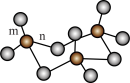
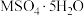 可写成
可写成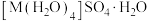 ,结构示意图如图2:
,结构示意图如图2: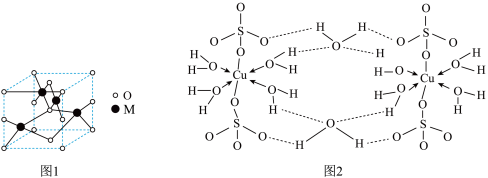
A.在上述结构示意图中,所有氧原子都采用
 杂化
杂化B.在上述结构示意图中,存在配位键、共价键和离子键
C.该硫酸盐结晶水合物晶体属于分子晶体,分子间存在氢键
D.该硫酸盐结晶水合物中的水在不同温度下会分步失去
往M的硫酸盐溶液中加入过量氨水,可生成
 配离子。已知
配离子。已知 与
与 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯 与四氟乙烯
与四氟乙烯 的共聚物
的共聚物 制成。
制成。
(1)2015年2月,科学家首次观测到化学键的形成。化学键不存在于_______。
(2)第三周期元素的原子中,未成对电子不可能有_______。
(3)基态F原子的轨道表示式为_______ ,四氟乙烯的电子式为_______ 。
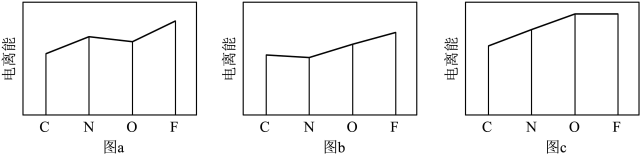
(4)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填字母),第三电离能的变化图是_______ (填字母)。
(5) 和
和 分子中C的杂化轨道类型分别为
分子中C的杂化轨道类型分别为_______ 和_______ ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______ 。
(6)比较甲醚和乙醇的沸点高低,并说明理由_______ 。
 与四氟乙烯
与四氟乙烯 的共聚物
的共聚物 制成。
制成。(1)2015年2月,科学家首次观测到化学键的形成。化学键不存在于_______。
| A.原子与原子之间 | B.分子与分子之间 | C.离子与离子之间 | D.离子与电子之间 |
(2)第三周期元素的原子中,未成对电子不可能有_______。
| A.4个 | B.3个 | C.2个 | D.1个 |
(3)基态F原子的轨道表示式为
(4)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(5)
 和
和 分子中C的杂化轨道类型分别为
分子中C的杂化轨道类型分别为(6)比较甲醚和乙醇的沸点高低,并说明理由
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D为短周期元素且它们的原子序数依次增大,A的核外电子总数与其周期数相同;其中D原子的L电子层中,成对电子与未成对电子占据的轨道数相同,并且无空轨道;B原子的L电子层中未成对电子数与D相同,但还有空轨道。请回答下列问题:
(1)A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的化学式为____ ,其中心原子的杂化方式为____ ,根据电子云重叠方式的不同,该分子中共价键的类型为____ 。
(2)B、C、D的第一电离能由大到小的顺序为____ (用元素符号作答,下同),电负性从大到小的顺序为____ 。
(3)已知H—H、Cl—Cl、H—Cl键的键能分别为436kJ·mol-1、243kJ·mol-1、431kJ·mol-1。试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)反应的△H=____ 。
(1)A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的化学式为
(2)B、C、D的第一电离能由大到小的顺序为
(3)已知H—H、Cl—Cl、H—Cl键的键能分别为436kJ·mol-1、243kJ·mol-1、431kJ·mol-1。试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)反应的△H=
您最近一年使用:0次



