室温下,通过下列实验探究 溶液的性质(
溶液的性质( 为
为 水解平衡常数、
水解平衡常数、 为
为 电离平衡常数)。
电离平衡常数)。
下列有关说法正确的是
 溶液的性质(
溶液的性质( 为
为 水解平衡常数、
水解平衡常数、 为
为 电离平衡常数)。
电离平衡常数)。| 实验 | 实验操作和现象 |
| ① | 用试纸测定 溶液的pH,测得约为5.5 溶液的pH,测得约为5.5 |
| ② | 向1L含 稀溶液中加入0.1mol 稀溶液中加入0.1mol ,产生沉淀 ,产生沉淀 |
| ③ | 向 溶液中通入过量HCl,无现象 溶液中通入过量HCl,无现象 |
| ④ | 向 溶液中通入一定量 溶液中通入一定量 ,测得溶液pH=7 ,测得溶液pH=7 |
A.实验①的溶液中: |
B.实验③得到的溶液中: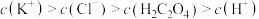 |
C.实验④所得的溶液中: |
D.实验②反应静置后的上层清液中: |
更新时间:2023-02-13 23:10:03
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.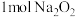 固体中含离子总数为 固体中含离子总数为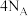 |
B. 醋酸钠溶液含有的 醋酸钠溶液含有的 数目等于 数目等于 |
C.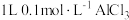 溶液水解生成的 溶液水解生成的 胶体粒子数等于 胶体粒子数等于 |
D.粗铜精炼中阴极质量增加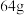 时,转移电子数目为 时,转移电子数目为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
真题
名校
【推荐2】下列离子在稳定人体血液的pH中起作用的是
| A.HCO3- | B.Na+ | C.Fe2+ | D.Cl- |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是


| A.HA为一元弱酸 |
| B.a点所示溶液中c(A-)+c(HA)=0.1mol/L |
| C.pH=7时,c(Na+)=c(A-)+c(HA) |
| D.b点所示溶液中c(HA)>c(A-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】 ,用
,用 溶液逐滴加入
溶液逐滴加入 溶液中,
溶液中, 随
随 溶液体积的变化如图。下列说法正确的是
溶液体积的变化如图。下列说法正确的是

 ,用
,用 溶液逐滴加入
溶液逐滴加入 溶液中,
溶液中, 随
随 溶液体积的变化如图。下列说法正确的是
溶液体积的变化如图。下列说法正确的是
A. 为弱酸,电离常数 为弱酸,电离常数 | B.水电离的 |
C. 点溶液中: 点溶液中: | D. 点溶液中,共有6种微粒 点溶液中,共有6种微粒 |
您最近一年使用:0次

 。下列说法正确的是
。下列说法正确的是
 溶液中,
溶液中, 的数量为0.1
的数量为0.1 与
与 完全反应,转移的电子数为0.3
完全反应,转移的电子数为0.3 和
和 的混合气体中分子数为0.2
的混合气体中分子数为0.2
 和0.1
和0.1 于密闭容器中充分反应后,其分子总数为0.2
于密闭容器中充分反应后,其分子总数为0.2

