氨气是现代工业、农业生产最基础的化工原料之一、
Ⅰ.传统的“哈伯法”反应原理为:
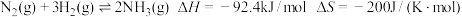
(1)上述反应在常温下___________ (填“能”或“不能”)自发进行。
(2)“哈伯法”合成氨的工业条件为400~500℃、10~30MPa,是综合考虑了___________ 因素(至少写两点)。
(3)t℃时向2L的某刚性容器中充入 和
和 。已知平衡时体系中
。已知平衡时体系中 的体积占比为
的体积占比为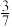 ,则该反应的平衡常数
,则该反应的平衡常数
___________ 。
Ⅱ.“哈伯法”的原料 来自于化石燃料,该过程会产生大量温室气体
来自于化石燃料,该过程会产生大量温室气体 。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
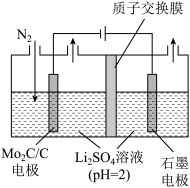
(4)一种常温常压下NRR反应的装置如图所示,请写出阴极的电极反应方程式:___________ 。
(5)下表为不同电压下进行电解时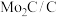 电极表面的气体产生情况(以
电极表面的气体产生情况(以 为计算值)
为计算值)
①表中 的最大产率=
的最大产率=___________ (产率=实际产量/理论产量×100%,常温常压下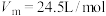 ,结果保留3位有效数值)
,结果保留3位有效数值)
②较高电压下 的生成速率下降的原因是:
的生成速率下降的原因是:___________ 。
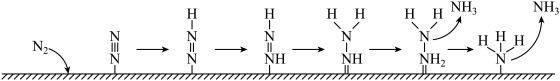
(6)如图为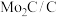 电极表面“
电极表面“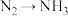 ”的可能路径(
”的可能路径( 表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:___________ (填化学式)。
Ⅰ.传统的“哈伯法”反应原理为:
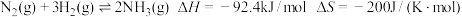
(1)上述反应在常温下
(2)“哈伯法”合成氨的工业条件为400~500℃、10~30MPa,是综合考虑了
(3)t℃时向2L的某刚性容器中充入
 和
和 。已知平衡时体系中
。已知平衡时体系中 的体积占比为
的体积占比为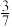 ,则该反应的平衡常数
,则该反应的平衡常数
Ⅱ.“哈伯法”的原料
 来自于化石燃料,该过程会产生大量温室气体
来自于化石燃料,该过程会产生大量温室气体 。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。(4)一种常温常压下NRR反应的装置如图所示,请写出阴极的电极反应方程式:
(5)下表为不同电压下进行电解时
 电极表面的气体产生情况(以
电极表面的气体产生情况(以 为计算值)
为计算值)①表中
 的最大产率=
的最大产率=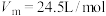 ,结果保留3位有效数值)
,结果保留3位有效数值) ②较高电压下
 的生成速率下降的原因是:
的生成速率下降的原因是:| 电压V |  通入速率mL/min 通入速率mL/min |  生成速率mL/min 生成速率mL/min |  生成速率mg/min 生成速率mg/min |
| 0.2 | 25 | 0.015 | 0.51 |
| 0.3 | 25 | 0.038 | 0.68 |
| 0.4 | 25 | 0.095 | 0.65 |
| 0.5 | 25 | 0.11 | 0.52 |
(6)如图为
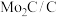 电极表面“
电极表面“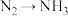 ”的可能路径(
”的可能路径( 表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
2023·湖北·二模 查看更多[1]
更新时间:2023-03-09 21:30:01
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等。工业上可用H2与重晶石(BaSO4)在高温下反应制备BaS,热化学方程式为BaSO4(s)+4H2(g) BaS(s)+4H2O(g)
BaS(s)+4H2O(g) 。回答下列问题:
。回答下列问题:
(1)在温度和容积不变的条件下,能说明该反应已达到平衡状态的是_____ (填字母序号)。
a.n(H2)=n(H2O)
b.容器内压强保持不变
c.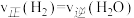
d.水蒸气的浓度保持不变
(2)平衡后下列措施既可提高反应速率,又可提高H2的转化率的是____ (填字母序号)。
a.使用催化剂
b.升高反应体系的温度
c.增大反应容器的体积
d.及时从反应体系中分离出水蒸气
(3)将温度恒定为T℃,向体积为2L的密闭容器中加入一定量的重晶石和H2。在不同时间测得H2的物质的量如下表:
①2t时,n____ 1.20(填“>”、“<”或“=”)
②若氢气的平衡转化率为a,则该温度下反应的化学平衡常数K=_____ (用含a的
代数式表示);若测得该反应达到平衡时吸热Q kJ ,则x=______ (用含a、Q的代数式表示)。
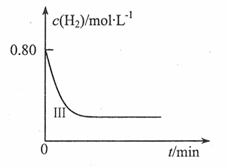
(4)为了探究温度、固体反应物的表面积对化学反应速率的影响,某同学在一固定容积的密闭容器中加入一定量的重晶石和H2,设计了下表中的三组实验:
①填写上表中的实验条件:T1=______ ,c1=______
②在直角坐标系中画出I, II两组实验氢气的浓度随时间变化趋势图,并在每条曲线上标明对应的实验编号。____________
 BaS(s)+4H2O(g)
BaS(s)+4H2O(g) 。回答下列问题:
。回答下列问题:(1)在温度和容积不变的条件下,能说明该反应已达到平衡状态的是
a.n(H2)=n(H2O)
b.容器内压强保持不变
c.
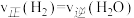
d.水蒸气的浓度保持不变
(2)平衡后下列措施既可提高反应速率,又可提高H2的转化率的是
a.使用催化剂
b.升高反应体系的温度
c.增大反应容器的体积
d.及时从反应体系中分离出水蒸气
(3)将温度恒定为T℃,向体积为2L的密闭容器中加入一定量的重晶石和H2。在不同时间测得H2的物质的量如下表:
| 时间/min | 0 | t | 2t | 3t | 4t |
| n(H2)/mol | 2.00 | 1.50 | n | 0.90 | 0.80 |
①2t时,n
②若氢气的平衡转化率为a,则该温度下反应的化学平衡常数K=
代数式表示);若测得该反应达到平衡时吸热Q kJ ,则x=
(4)为了探究温度、固体反应物的表面积对化学反应速率的影响,某同学在一固定容积的密闭容器中加入一定量的重晶石和H2,设计了下表中的三组实验:
| 实验编号 | T/ ℃ | C起始(H2)/mol L-1 L-1 | 重晶石的比表面积/m2 g-1 g-1 |
| I | 850 | C1 | 3.4 |
| II | T1 | 0.80 | 7.6 |
| Ⅲ | 900 | 0.80 | 7.6 |
①填写上表中的实验条件:T1=
②在直角坐标系中画出I, II两组实验氢气的浓度随时间变化趋势图,并在每条曲线上标明对应的实验编号。

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】氧化钪( )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以钪锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以钪锰矿石(含 、
、 、
、 、
、 、CaO、FeO)为原料制备氧化钪的一种工艺流程如图所示。
、CaO、FeO)为原料制备氧化钪的一种工艺流程如图所示。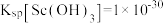 ;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有_______ (写出一种)。
(2)“浸取”时铁屑被 氧化为Fe3+,该反应的离子方程式是
氧化为Fe3+,该反应的离子方程式是_______ 。
(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为_______ 。_______ 。
(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中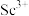 的浓度为
的浓度为_______ 。
(6)已知 ,
, ,
,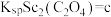 。“沉钪”时,发生反应
。“沉钪”时,发生反应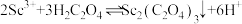 ,此反应的平衡常数
,此反应的平衡常数
_______ (用含a、b、c的代数式表示)。反应过程中,草酸用量过多时,钪的沉淀率下降,原因可能是_______ 。
(7)草酸钪晶体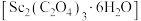 ;在空气中加热,
;在空气中加热, 随温度的变化情况如图所示。250℃时,晶体的主要成分是
随温度的变化情况如图所示。250℃时,晶体的主要成分是_______ (填化学式)。550~850℃发生反应的化学方程式为_______ 。
 )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以钪锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以钪锰矿石(含 、
、 、
、 、
、 、CaO、FeO)为原料制备氧化钪的一种工艺流程如图所示。
、CaO、FeO)为原料制备氧化钪的一种工艺流程如图所示。
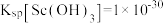 ;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:(1)为了提高“浸取”效果,可采取的措施有
(2)“浸取”时铁屑被
 氧化为Fe3+,该反应的离子方程式是
氧化为Fe3+,该反应的离子方程式是(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为

(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中
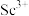 的浓度为
的浓度为(6)已知
 ,
, ,
,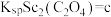 。“沉钪”时,发生反应
。“沉钪”时,发生反应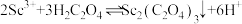 ,此反应的平衡常数
,此反应的平衡常数
(7)草酸钪晶体
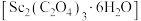 ;在空气中加热,
;在空气中加热, 随温度的变化情况如图所示。250℃时,晶体的主要成分是
随温度的变化情况如图所示。250℃时,晶体的主要成分是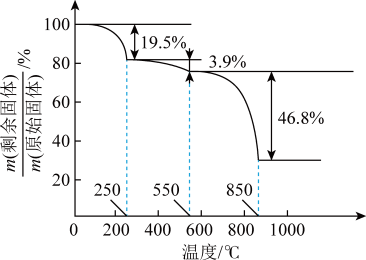
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
①2AgNO3(s)=2Ag(s)+2NO2(g)+O2(g) △H1>0
②2NO2(g) N2O4(g) △H2<0
N2O4(g) △H2<0
(1)温度T1时,在0.5L的恒容密闭容器中投入0.04molAgNO3(s)并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图1所示:

①下列情况能说明体系达到平衡状态的是____ (填字母)。
a.混合气体的平均相对分子质量不再改变
b.O2的浓度不再改变
c.NO2的体积分数不再改变
d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0.8MPa,反应开始到10min内N2O4的平均反应速率为____ MPa·min-1。在该温度下2NO2(g) N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=____ (MPa)-1(结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
③实验测得 正=
正= (NO2)消耗=k正c2(NO2),
(NO2)消耗=k正c2(NO2), 逆=2
逆=2 (N2O4)消耗=k逆c(N2O4),k正、k逆为速率常数且只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=
(N2O4)消耗=k逆c(N2O4),k正、k逆为速率常数且只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=____ 。若将容器的温度改变为T2时,其k正=10k逆,则T1____ T2(填“>”“<”或“=”)。
(2)用活性炭还原法可将氮氧化物转化为无毒气体,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应
N2(g)+CO2(g)。向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应 正
正____  逆(填“>”“<”或“=”)。
逆(填“>”“<”或“=”)。
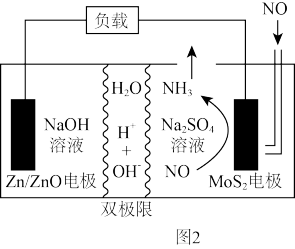
(3)氮氧化物排放到空气中会造成空气污染。2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn—NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图2所示(双极膜可将水解离为H+和OH-,并实现其定向通过)。在该电池工作过程中,MoS2电极上发生的电极反应式为____ ,若有4.48LNO(标准状况下)参加反应,Zn/ZnO电极质量增加____ g。
①2AgNO3(s)=2Ag(s)+2NO2(g)+O2(g) △H1>0
②2NO2(g)
 N2O4(g) △H2<0
N2O4(g) △H2<0(1)温度T1时,在0.5L的恒容密闭容器中投入0.04molAgNO3(s)并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图1所示:

①下列情况能说明体系达到平衡状态的是
a.混合气体的平均相对分子质量不再改变
b.O2的浓度不再改变
c.NO2的体积分数不再改变
d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0.8MPa,反应开始到10min内N2O4的平均反应速率为
 N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=③实验测得
 正=
正= (NO2)消耗=k正c2(NO2),
(NO2)消耗=k正c2(NO2), 逆=2
逆=2 (N2O4)消耗=k逆c(N2O4),k正、k逆为速率常数且只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=
(N2O4)消耗=k逆c(N2O4),k正、k逆为速率常数且只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=(2)用活性炭还原法可将氮氧化物转化为无毒气体,有关反应为C(s)+2NO(g)
 N2(g)+CO2(g)。向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应
N2(g)+CO2(g)。向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应 正
正 逆(填“>”“<”或“=”)。
逆(填“>”“<”或“=”)。(3)氮氧化物排放到空气中会造成空气污染。2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn—NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图2所示(双极膜可将水解离为H+和OH-,并实现其定向通过)。在该电池工作过程中,MoS2电极上发生的电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
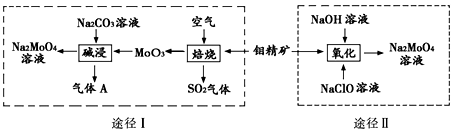
【推荐1】钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
(1)Na2MoO4·2H2O中钼元素的化合价是___________ 。
(2)在途径Ⅰ中:
①为了提高焙烧效率,除增大空气量外还可以采用的措施有___________ ;焙烧后的尾气中含有SO2,需要处理,下列不能用作吸收剂的是___________ (填字母);
a.Ca(OH)2 b.HNO3 c.Na2CO3
②焙烧生成MoO3也可以利用铝热反应回收金属钼,写出该反应的化学方程式___________ ;
③碱浸时生成Na2MoO4和另一种气体A,该气体A的电子式为___________ ;碱浸后的钼酸钠溶液中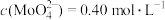 ,
,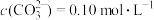 ,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去
,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去 ,当BaMoO4开始沉淀时,
,当BaMoO4开始沉淀时, 的去除率是
的去除率是___________ (已知Ksp(BaCO3)=1.0×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化);
④Na2MoO4溶液重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是___________ ,“分析纯”的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径Ⅰ所产生的气体一起通入水中,得到正盐的化学式是___________ 。
(3)在途径Ⅱ中:氧化时还有Na2SO4生成,则反应的离子方程式为___________ 。

(1)Na2MoO4·2H2O中钼元素的化合价是
(2)在途径Ⅰ中:
①为了提高焙烧效率,除增大空气量外还可以采用的措施有
a.Ca(OH)2 b.HNO3 c.Na2CO3
②焙烧生成MoO3也可以利用铝热反应回收金属钼,写出该反应的化学方程式
③碱浸时生成Na2MoO4和另一种气体A,该气体A的电子式为
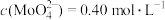 ,
,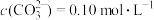 ,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去
,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去 ,当BaMoO4开始沉淀时,
,当BaMoO4开始沉淀时, 的去除率是
的去除率是④Na2MoO4溶液重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是
(3)在途径Ⅱ中:氧化时还有Na2SO4生成,则反应的离子方程式为
您最近一年使用:0次
【推荐2】锗是一种重要的战略资源,在半导体、航空航天测控等领域都有着广泛的应用。下图是以一种锗矿 主要成分为
主要成分为 、
、 、
、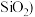 为原料制备锗的工艺流程:
为原料制备锗的工艺流程:
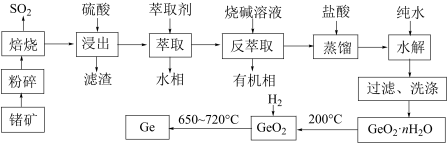
已知:
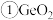 为两性氧化物。
为两性氧化物。
 “萃取”时用的萃取剂在本实验条件下对
“萃取”时用的萃取剂在本实验条件下对 有很好的选择性。
有很好的选择性。
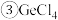 的熔、沸点分别为
的熔、沸点分别为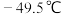 、
、 ,极易水解放热。
,极易水解放热。
 “蒸馏”过程中发生的反应为
“蒸馏”过程中发生的反应为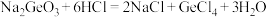 。
。
(1)锗在元素周期表中的位置为第_________ 周期第________ 族。
(2)“粉碎”的目的是_______________________ 。
(3)“焙烧”过程中 发生反应的化学方程式为
发生反应的化学方程式为________________ 。
(4)“滤渣”的成分为________________  填化学式
填化学式 ,“水相”中的阳离子除了
,“水相”中的阳离子除了 和
和 外,还有
外,还有__________________  填离子符号
填离子符号 。
。
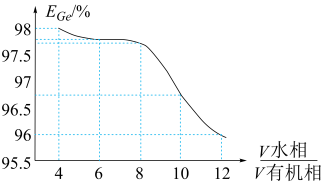
(5)“萃取”时,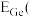 锗的萃取率
锗的萃取率 与
与 水相与有机相的体积比
水相与有机相的体积比 的关系如图所示,从生产成本的角度考虑,最适宜的
的关系如图所示,从生产成本的角度考虑,最适宜的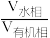 为
为______________  填序号
填序号 。
。
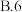

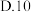
(6)“水解”时反应的化学方程式为_________________ ,该步实验操作必须在冰盐浴中进行的原因除了有利于水解反应正向进行外,还有______________ 。
(7)假设流程中每步都没有锗元素损失,若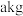 锗
锗  含锗
含锗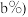 经提纯得到
经提纯得到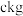 的锗,则杂质元素的脱除率为
的锗,则杂质元素的脱除率为_____________  用含a、b、c的式子表示
用含a、b、c的式子表示 。
。 已知:杂质元素的脱除率
已知:杂质元素的脱除率
 主要成分为
主要成分为 、
、 、
、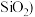 为原料制备锗的工艺流程:
为原料制备锗的工艺流程:
已知:
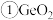 为两性氧化物。
为两性氧化物。 “萃取”时用的萃取剂在本实验条件下对
“萃取”时用的萃取剂在本实验条件下对 有很好的选择性。
有很好的选择性。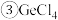 的熔、沸点分别为
的熔、沸点分别为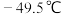 、
、 ,极易水解放热。
,极易水解放热。 “蒸馏”过程中发生的反应为
“蒸馏”过程中发生的反应为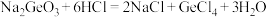 。
。(1)锗在元素周期表中的位置为第
(2)“粉碎”的目的是
(3)“焙烧”过程中
 发生反应的化学方程式为
发生反应的化学方程式为(4)“滤渣”的成分为
 填化学式
填化学式 ,“水相”中的阳离子除了
,“水相”中的阳离子除了 和
和 外,还有
外,还有 填离子符号
填离子符号 。
。(5)“萃取”时,
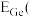 锗的萃取率
锗的萃取率 与
与 水相与有机相的体积比
水相与有机相的体积比 的关系如图所示,从生产成本的角度考虑,最适宜的
的关系如图所示,从生产成本的角度考虑,最适宜的 为
为 填序号
填序号 。
。
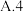
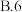

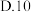
(6)“水解”时反应的化学方程式为
(7)假设流程中每步都没有锗元素损失,若
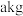 锗
锗  含锗
含锗 经提纯得到
经提纯得到 的锗,则杂质元素的脱除率为
的锗,则杂质元素的脱除率为 用含a、b、c的式子表示
用含a、b、c的式子表示 。
。 已知:杂质元素的脱除率
已知:杂质元素的脱除率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】研究汽车尾气的产生、转化对环境保护有重要意义。汽车尾气管中的三元催化剂能同时实现CO、CxHy、NOn三种成分的净化。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____ kJ·mol-1。
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是____ 。
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是____ 。
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。
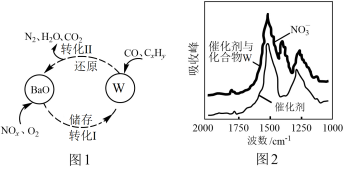
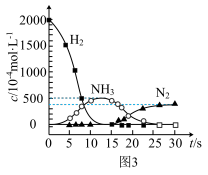
①在图1所示转化中,W的化学式为____ 。若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,则被CxHy还原的W的物质的量为____ 。
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是____ 。
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:____ 。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)
 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。


①在图1所示转化中,W的化学式为
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】大气环境中NOx的减量化排放受到国内外的广泛关注。利用碳还原NO的反应为:C(S)+2NO(g)⇌N2(g)+CO2(g),△S较小。回答下列问题:
(1)该反应在常温下可以自发进行,则反应的△H_______ 0(填“>”“=”或“<”),有利于提高NO平衡转化率的条件是_______ (任写一条)。平衡后,若保持温度和容积不变,向体系中加入少量NO,NO的平衡转化率_______ (填“增大”、“减小”或“不变”)。
(2)以上反应可分为如下四步反应历程,写出其中第三步的反应:
第一步:2NO=(NO)2
第二步:C+(NO)2=C(O)+N2O
第三步:_______
第四步:2C(O)=CO2+C
(3)对比研究活性炭负载铜、镧的反应活性。在三个反应容器中分别加入La/C、Cu/C、C,通入NO使其浓度达到相同浓度。不同温度下,测得第3小时末(未到达平衡)NO去除率如图所示:
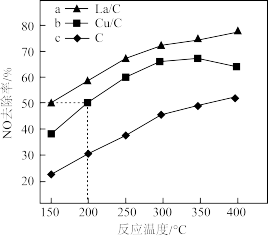
①恒温恒容下C(s)+2NO(g)⇌N2(g)+CO2(g)下列能说明反应达平衡状态的是_______ 。
A.总压强恒定不变。
B.气体的平均相对分子质量不再改变
C.气体的平均密度不再改变
D.Cu/C催化、200°C时NO去除率达50%
②据图分析,相同温度下La/C、Cu/C去除NO效果比C更好,可能的原因是_______ (写一条)。
③上述实验中,200℃时,若测得NO的去除率为80%,则可能采取的措施是_______ 。
A.及时分离出CO2 B.压缩体积
C.恒容下,向体系中通入氮气 D.寻找更好的催化剂
(1)该反应在常温下可以自发进行,则反应的△H
(2)以上反应可分为如下四步反应历程,写出其中第三步的反应:
第一步:2NO=(NO)2
第二步:C+(NO)2=C(O)+N2O
第三步:
第四步:2C(O)=CO2+C
(3)对比研究活性炭负载铜、镧的反应活性。在三个反应容器中分别加入La/C、Cu/C、C,通入NO使其浓度达到相同浓度。不同温度下,测得第3小时末(未到达平衡)NO去除率如图所示:

①恒温恒容下C(s)+2NO(g)⇌N2(g)+CO2(g)下列能说明反应达平衡状态的是
A.总压强恒定不变。
B.气体的平均相对分子质量不再改变
C.气体的平均密度不再改变
D.Cu/C催化、200°C时NO去除率达50%
②据图分析,相同温度下La/C、Cu/C去除NO效果比C更好,可能的原因是
③上述实验中,200℃时,若测得NO的去除率为80%,则可能采取的措施是
A.及时分离出CO2 B.压缩体积
C.恒容下,向体系中通入氮气 D.寻找更好的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,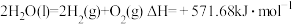 ,
,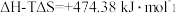 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是_______ 。
(2)已知反应: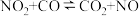
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为_______ (用含K的式子表示)。
②下图是该反应中能量变化示意图。
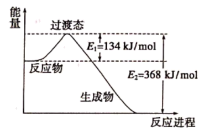
则 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为_______ , 和
和 反应的热化学方程式为
反应的热化学方程式为_______ 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①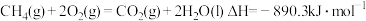
②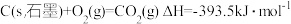
③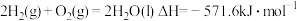
则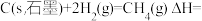
_______ 。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据写出 和
和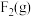 反应生成
反应生成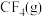 和
和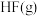 的热化学方程式:
的热化学方程式:_______ 。
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,
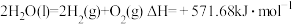 ,
,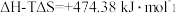 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是(2)已知反应:
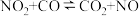
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为
②下图是该反应中能量变化示意图。

则
 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为 和
和 反应的热化学方程式为
反应的热化学方程式为(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①
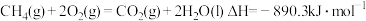
②
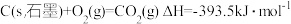
③
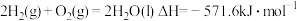
则
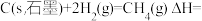
(4)已知一些化学键的键能数据如表所示:
| 化学键 |  |  |  |  |
键能/ | 414 | 489 | 565 | 155 |
请根据键能数据写出
 和
和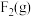 反应生成
反应生成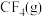 和
和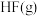 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业合成氨是人类科技的一项重大突破,其反应为:3H2(g)+N2(g)  2NH3(g) ΔH= -92.4 kJ/mol。
2NH3(g) ΔH= -92.4 kJ/mol。
(1)判断该反应的自发性并说明理由_______ 。
(2)在一定温度下,NH3溶于水的过程及其平衡常数为:
NH3(g) NH3(aq) K1=
NH3(aq) K1=
NH3(aq)+H2O(l) NH3·H2O(aq) K2
NH3·H2O(aq) K2
NH3·H2O (aq)
 (aq)+OH-(aq) K3
(aq)+OH-(aq) K3
忽略H2O的电离,NH3 在水中的溶解度(以物质的量浓度表示)为c,用平衡压强p和上述平衡常数表示,则c=_______ 。
(3)工业合成氨流程示意图如图1:
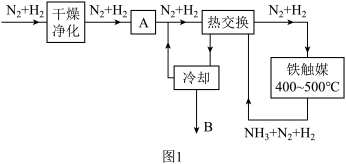
①工业上通常在400~500℃下进行合成氨反应,用碰撞理论解释为什么不在常温下进行反应_______ 。
②干燥净化的目的是_______ ,装置 A的作用为_______ ,B处的物质主要是_______ (写出物质并注明状态)。
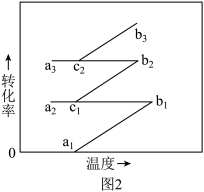
③工业上N2和H2混合气反应后经过图1中的过程再及时补充N2和H2进入合成塔反应,以一定量的N2和H2为研究对象,计算转化率时不考虑新补充进入的N2和H2,循环过程中转化率随温度变化曲线如图2所示,图2所示进程中表示热交换过程的是_______ 。
A. a1→b1 B. b1→c1 C. c1→a2 D. a2→c1 E. c1→b2 F. b2→c2 G. c2→a3 H.a3→c2
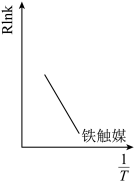
(4)已知Arrhenius经验公式为Rlnk=- +C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与
+C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与 的关系图。
的关系图。______
 2NH3(g) ΔH= -92.4 kJ/mol。
2NH3(g) ΔH= -92.4 kJ/mol。(1)判断该反应的自发性并说明理由
(2)在一定温度下,NH3溶于水的过程及其平衡常数为:
NH3(g)
 NH3(aq) K1=
NH3(aq) K1=
NH3(aq)+H2O(l)
 NH3·H2O(aq) K2
NH3·H2O(aq) K2NH3·H2O (aq)

 (aq)+OH-(aq) K3
(aq)+OH-(aq) K3忽略H2O的电离,NH3 在水中的溶解度(以物质的量浓度表示)为c,用平衡压强p和上述平衡常数表示,则c=
(3)工业合成氨流程示意图如图1:

①工业上通常在400~500℃下进行合成氨反应,用碰撞理论解释为什么不在常温下进行反应
②干燥净化的目的是
③工业上N2和H2混合气反应后经过图1中的过程再及时补充N2和H2进入合成塔反应,以一定量的N2和H2为研究对象,计算转化率时不考虑新补充进入的N2和H2,循环过程中转化率随温度变化曲线如图2所示,图2所示进程中表示热交换过程的是

A. a1→b1 B. b1→c1 C. c1→a2 D. a2→c1 E. c1→b2 F. b2→c2 G. c2→a3 H.a3→c2
(4)已知Arrhenius经验公式为Rlnk=-
 +C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与
+C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与 的关系图。
的关系图。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】如图所示是某实验小组电解氯化钠溶液(含酚酞)的装置。有毒气体收集的装置省略没有画出,两电极均是石墨电极。
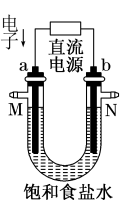
(1)a电极的名称___________ 。
(2)电解过程中a极区域观察到的现象___________ 。
(3)电解的总反应离子方程式为___________ 。
(4)某实验小组用1.6 A电流电解6.02 min,在阴极可以生成___________ mL(标准状况)气体(一个电子的电量为1.6×10−19C)。
(5)若将b电极换成铁作电极,电解一段时间后U形管底部出现红褐色沉淀,请用化学方程式解释这一现象,写出总反应的化学方程式___________ 。

(1)a电极的名称
(2)电解过程中a极区域观察到的现象
(3)电解的总反应离子方程式为
(4)某实验小组用1.6 A电流电解6.02 min,在阴极可以生成
(5)若将b电极换成铁作电极,电解一段时间后U形管底部出现红褐色沉淀,请用化学方程式解释这一现象,写出总反应的化学方程式
您最近一年使用:0次
【推荐2】CO2的资源化利用和转化已成为当今科学研究的热点。回答下列问题:
(1)325℃时,水在锰粉表面产生的H2可将CO2转化成甲酸,同时生成MnO。
①由H2O、Mn、CO2制备甲酸的化学方程式为___________ 。
②直接将H2和CO2混合,在325℃条件下难以生成甲酸,而在锰粉表面可以较快生成甲酸的原因是___________ 。
(2)由CO2和H2制备甲醇(CH3OH)的反应原理如下:
反应I.
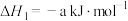 (a>0)
(a>0)
反应I.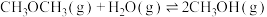
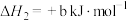 (b>0)
(b>0)
反应Ⅲ. △H3
△H3
恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图所示。其中:CH3OH的选择性=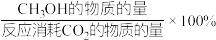 。
。
①△H3=_________ kJ∙mol-1,据此判断反应Ⅲ在_________ (填“低温”“高温”或“任意温度”)条件下有利于自发进行。
②在上述条件下,结合图像分析,合成甲醇的最佳温度是________ ,最佳催化剂是________ 。
③温度高于230℃,使用CZT催化剂时CH3OH产率随温度升高而下降的原因是___________ 。
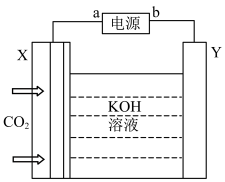
(3)模拟在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应)装置如图所示,装置中b电极为___________ (填“正”或“负”)极,X极上发生反应的电极反应式为___________ 。
(1)325℃时,水在锰粉表面产生的H2可将CO2转化成甲酸,同时生成MnO。
①由H2O、Mn、CO2制备甲酸的化学方程式为
②直接将H2和CO2混合,在325℃条件下难以生成甲酸,而在锰粉表面可以较快生成甲酸的原因是
(2)由CO2和H2制备甲醇(CH3OH)的反应原理如下:
反应I.

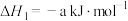 (a>0)
(a>0)反应I.
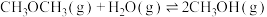
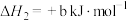 (b>0)
(b>0)反应Ⅲ.
 △H3
△H3恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图所示。其中:CH3OH的选择性=
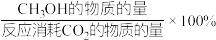 。
。
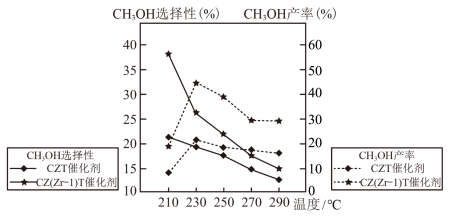
①△H3=
②在上述条件下,结合图像分析,合成甲醇的最佳温度是
③温度高于230℃,使用CZT催化剂时CH3OH产率随温度升高而下降的原因是
(3)模拟在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应)装置如图所示,装置中b电极为

您最近一年使用:0次
【推荐3】硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示:
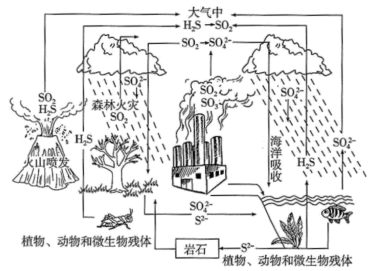
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝( CuS), 请用化学用语表示 ZnS 转变为 CuS 的过程__________ 。
(2) 火山喷发产生 H2S 在大气当中发生如下反应:
①2H2S(g)+O2(g) =2S(g) +2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △ H=﹣297.04kJ/mol。
H2S(g)与 O2(g)反应产生 SO2(g)和 H2O(g)的热化学方程式是__________ 。
(3) 降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是__________ 。
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:
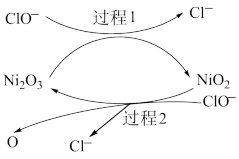
ii.过程 1 的离子方程式是__________ 。
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是__________ 。
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。
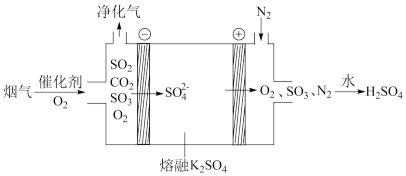
i.在阴极放电的物质是______ 。
ii.在阳极生成 SO3的电极反应式是______ 。

(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝( CuS), 请用化学用语表示 ZnS 转变为 CuS 的过程
(2) 火山喷发产生 H2S 在大气当中发生如下反应:
①2H2S(g)+O2(g) =2S(g) +2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △ H=﹣297.04kJ/mol。
H2S(g)与 O2(g)反应产生 SO2(g)和 H2O(g)的热化学方程式是
(3) 降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:

ii.过程 1 的离子方程式是
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。

i.在阴极放电的物质是
ii.在阳极生成 SO3的电极反应式是
您最近一年使用:0次



