生产、生活和科技发展离不开化学。请回答下列问题:
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
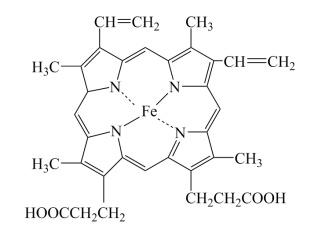
①基态Fe原子的价电子排布图为___________ ,Fe2+核外电子有___________ 种空间运动状态。
②血红素中各非金属元素的电负性由小到大的顺序为___________ 。
③Fe2+与邻二氮菲(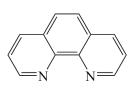 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:___________ ;若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
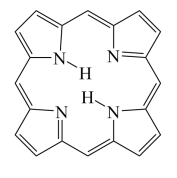
④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取___________ 杂化。
(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的___________ 区,找出距离As(0.25,0.25,0.25)最近的As___________ (用分数坐标表示)。
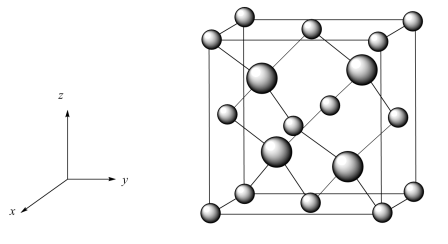
②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为___________ pm(列出计算式)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①基态Fe原子的价电子排布图为
②血红素中各非金属元素的电负性由小到大的顺序为
③Fe2+与邻二氮菲(
 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取

(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的

②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为
更新时间:2023-03-14 09:06:03
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】X、Y、Z、Q、E五种元素中,X原子的M层中只有两对成对电子,Y原子的L层上的电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与E的核电荷数之和,E在元素周期表中电负性最大。回答下列问题:
(1)Y、Z、Q三种元素可形成一种分子式为QYZ3的化合物。
①基态Q原子核外有___________ 种空间运动状态不同的电子。
②QYZ3分子中的阴离子的空间构型为_______________ 。
③X、Y两种元素的最高价氧化物对应水化物的酸性较强的是___________ (填化学式)。
(2)将足量的XZ2充入含有 的溶液中,发生反应的离子方程式为
的溶液中,发生反应的离子方程式为________ 。
(3)X的单质的常见形式为X8,其环状结构如图所示,则X的原子采用的轨道杂化方式是_______ 。
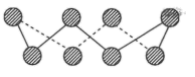
(4)YX2分子中,共价键的成键形式有_____ ,属于______ (填“极性分子”或“非极性分子”),写出与YX2具有相同空间构型和键合形式的分子:_______ (写一条即可)。
(1)Y、Z、Q三种元素可形成一种分子式为QYZ3的化合物。
①基态Q原子核外有
②QYZ3分子中的阴离子的空间构型为
③X、Y两种元素的最高价氧化物对应水化物的酸性较强的是
(2)将足量的XZ2充入含有
 的溶液中,发生反应的离子方程式为
的溶液中,发生反应的离子方程式为(3)X的单质的常见形式为X8,其环状结构如图所示,则X的原子采用的轨道杂化方式是

(4)YX2分子中,共价键的成键形式有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】硼与氮、氢能形成多种具有优良性能的化合物,受到人们的广泛关注。
Ⅰ.氨硼烷( )具有良好的储氢能力。
)具有良好的储氢能力。
(1) 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(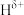 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(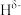 ),三种元素电负性大小顺序是
),三种元素电负性大小顺序是_______ 。
(2)其在催化剂作用下水解释放氢气: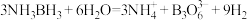 ,
, 的结构为
的结构为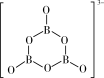 。在该反应中,B原子的杂化轨道类型的变化是
。在该反应中,B原子的杂化轨道类型的变化是_______ 。
(3)无机苯(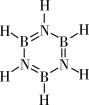 )不能形成像苯一样的离域π键,原因是
)不能形成像苯一样的离域π键,原因是_______ 。
Ⅱ.氮化硼(BN)是一种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法为:

(4) 被认为是有机化学上的“万能还原剂”,其中H的化合价为
被认为是有机化学上的“万能还原剂”,其中H的化合价为_______ 。
(5)硼酸的化学式为 ,硼酸产生
,硼酸产生 过程为:
过程为: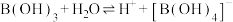 ,下列说法正确的是_______。
,下列说法正确的是_______。
(6)氮化硼(BN)晶体存在如图所示的两种结构,六方氮化硼的结构与石墨类似,立方氮化硼的结构与金刚石类似,可作研磨剂。
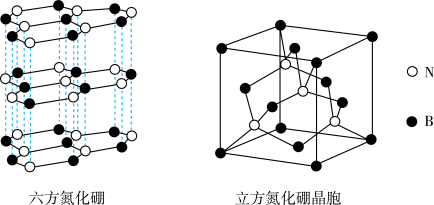
①立方氮化硼的熔点和硬度均高于SiC的原因是_______ ,已知该晶胞的密度为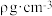 ,晶胞的边长为a cm,则阿伏加德罗常数的表达式为
,晶胞的边长为a cm,则阿伏加德罗常数的表达式为_______ 。
②六方氮化硼可做润滑剂,不导电。则六方氮化硼的晶体类型是_______ ,其中含有的微粒间作用力有_______ 。
Ⅰ.氨硼烷(
 )具有良好的储氢能力。
)具有良好的储氢能力。(1)
 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(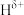 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(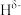 ),三种元素电负性大小顺序是
),三种元素电负性大小顺序是(2)其在催化剂作用下水解释放氢气:
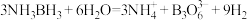 ,
, 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型的变化是
。在该反应中,B原子的杂化轨道类型的变化是(3)无机苯(
 )不能形成像苯一样的离域π键,原因是
)不能形成像苯一样的离域π键,原因是Ⅱ.氮化硼(BN)是一种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法为:

(4)
 被认为是有机化学上的“万能还原剂”,其中H的化合价为
被认为是有机化学上的“万能还原剂”,其中H的化合价为(5)硼酸的化学式为
 ,硼酸产生
,硼酸产生 过程为:
过程为: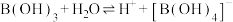 ,下列说法正确的是_______。
,下列说法正确的是_______。| A.是一元弱酸 | B.硼酸体现酸性与配位键有关 |
| C.B位于三个O构成的三角形的中心 | D.与 的反应是氧化还原反应 的反应是氧化还原反应 |

①立方氮化硼的熔点和硬度均高于SiC的原因是
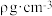 ,晶胞的边长为a cm,则阿伏加德罗常数的表达式为
,晶胞的边长为a cm,则阿伏加德罗常数的表达式为②六方氮化硼可做润滑剂,不导电。则六方氮化硼的晶体类型是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】铁和硒都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。乙烷硒啉(Ethaselen)是一种抗癌新药,其结构如下:
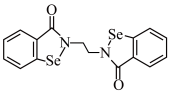
(1)基态Se原子的核外电子排布式为[Ar]_______ ,其核外有_______ 种不同能量的电子;该新药分子中的H被1个Cl取代,其可能的产物有_______ 种。
(2)在对电子运动状态的描述中,确定1个“轨道”的方面包括_______。
①电子层 ②电子云形状 ③电子云的伸展方向 ④电子的自旋
(3)比较键角大小:气态SeO3分子_______  离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。
(4)过渡元素离子一般能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子或离子是_______ 。
(5)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如下图所示:

富马酸分子中σ键与π键的数目比为___ ,富马酸亚铁中各元素的电负性由大到小的顺序为___

(1)基态Se原子的核外电子排布式为[Ar]
(2)在对电子运动状态的描述中,确定1个“轨道”的方面包括_______。
①电子层 ②电子云形状 ③电子云的伸展方向 ④电子的自旋
| A.①②③④ | B.①②③ | C.①② | D.① |
 离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。(4)过渡元素离子一般能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子或离子是
(5)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如下图所示:

富马酸分子中σ键与π键的数目比为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】钛酸铅在光催化领域有很好的应用前景。以氨水、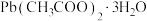 和二羟基双(乳酸铵)钛为原料可制得钛酸铅晶体。其晶体结构如下图,高于490℃时,结构以图(a)形式存在;低于490℃时,
和二羟基双(乳酸铵)钛为原料可制得钛酸铅晶体。其晶体结构如下图,高于490℃时,结构以图(a)形式存在;低于490℃时, 和
和 构成的正八面体会沿着c轴被拉伸,结构以图(b)形式存在。
构成的正八面体会沿着c轴被拉伸,结构以图(b)形式存在。
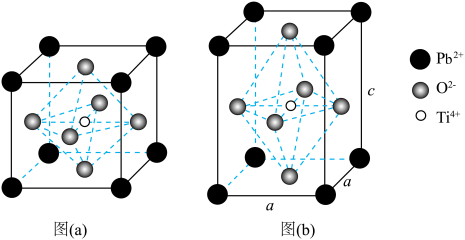
(1)Ti原子有___________ 种运动状态不同的电子,其价电子排布式为___________ 。该元素位于___________ 区。
A.s B.p C.d D.f
(2)制备钛酸铅的原料[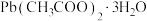 ]中,非金属元素的电负性由大到小的顺序为___________。
]中,非金属元素的电负性由大到小的顺序为___________。
(3)结合图(a)分析,立方钛酸铅的化学式为___________ 。
(4)四方钛酸铅[图(b)]中 周围最近的
周围最近的 数目为___________。
数目为___________。
(5)四方钛酸铅[图(b)]晶胞边长分别为 ,
, ,则该晶体的密度为
,则该晶体的密度为___________  。(计算结果保留2位小数,
。(计算结果保留2位小数, )
)
(6)二羟基双(乳酸铵)钛中负离子的结构为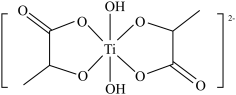 。
。
①二羟基双(乳酸铵)钛晶体中C原子杂化轨道类型为___________ 。
②二羟基双(乳酸铵)钛晶体类型为___________ 。
A.分子晶体 B.离子晶体 C.共价晶体 D.混合晶体
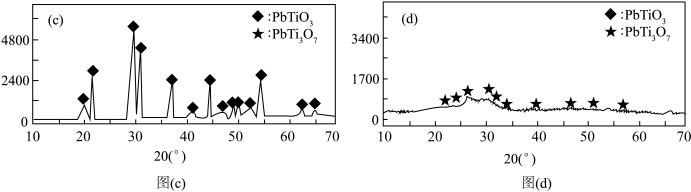
(7)晶体X射线衍射实验图谱会出现尖锐的峰。在制备钛酸铅时,分别向其中加入5 mL和20 mL二乙二醇X射线衍射实验图谱分别为图(c)和图(d),该图组说明在二乙二醇含量为20 mL时,___________ 形成晶态PbTiO3。
A.能 B.不能
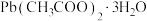 和二羟基双(乳酸铵)钛为原料可制得钛酸铅晶体。其晶体结构如下图,高于490℃时,结构以图(a)形式存在;低于490℃时,
和二羟基双(乳酸铵)钛为原料可制得钛酸铅晶体。其晶体结构如下图,高于490℃时,结构以图(a)形式存在;低于490℃时, 和
和 构成的正八面体会沿着c轴被拉伸,结构以图(b)形式存在。
构成的正八面体会沿着c轴被拉伸,结构以图(b)形式存在。
(1)Ti原子有
A.s B.p C.d D.f
(2)制备钛酸铅的原料[
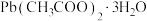 ]中,非金属元素的电负性由大到小的顺序为___________。
]中,非金属元素的电负性由大到小的顺序为___________。| A.C>H>O | B.O>H>C | C.O>C>H | D.H>O>C |
(3)结合图(a)分析,立方钛酸铅的化学式为
(4)四方钛酸铅[图(b)]中
 周围最近的
周围最近的 数目为___________。
数目为___________。| A.2 | B.4 | C.6 | D.8 |
(5)四方钛酸铅[图(b)]晶胞边长分别为
 ,
, ,则该晶体的密度为
,则该晶体的密度为 。(计算结果保留2位小数,
。(计算结果保留2位小数, )
)(6)二羟基双(乳酸铵)钛中负离子的结构为
 。
。①二羟基双(乳酸铵)钛晶体中C原子杂化轨道类型为
②二羟基双(乳酸铵)钛晶体类型为
A.分子晶体 B.离子晶体 C.共价晶体 D.混合晶体
(7)晶体X射线衍射实验图谱会出现尖锐的峰。在制备钛酸铅时,分别向其中加入5 mL和20 mL二乙二醇X射线衍射实验图谱分别为图(c)和图(d),该图组说明在二乙二醇含量为20 mL时,
A.能 B.不能

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。

(1)基态硫原子价电子排布式为_______ 。
(2) 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为_______ 。
(3)汞的原子序数为80,位于元素周期表第_______ 周期ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的有_______ 。
A.在Ⅰ中S原子采取 杂化
杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比水溶性较好的是_______ 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
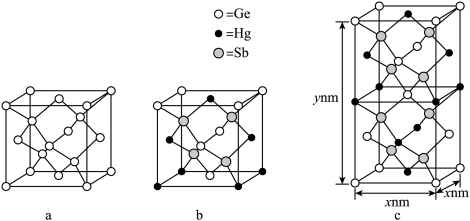
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是_______ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;该晶胞中粒子个数比Hg∶Ge∶Sb=_______ 。

(1)基态硫原子价电子排布式为
(2)
 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为(3)汞的原子序数为80,位于元素周期表第
(4)化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的有
A.在Ⅰ中S原子采取
 杂化
杂化B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比水溶性较好的是
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】电池在人类生产生活中具有十分重要的作用,其中锂离子电池与太阳能电池占有很大比重。太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)基态亚铜离子中电子占据的原子轨道数目为____________ 。
(2)若基态硒原子价层电子排布式写成4s24px24py2,则其违背了____________ 。
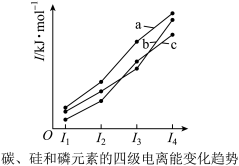
(3)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是_______ (填标号)。
(4)元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为_____ ,该分子其中心原子的杂化类型为_____ 。写出一种与Q互为等电子体的离子______ 。
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O.其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是__________ (填选项字母)。
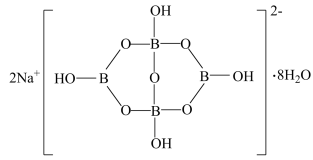
A 离子键 B 共价键 C 金属键 D 范德华力 E 氢键
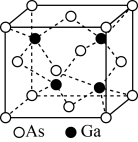
(6)GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为____ ,GaAs的熔点____ (填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGa g•mol−1和MAs g•mol−1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______ 。
(1)基态亚铜离子中电子占据的原子轨道数目为
(2)若基态硒原子价层电子排布式写成4s24px24py2,则其违背了
(3)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是

(4)元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O.其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是

A 离子键 B 共价键 C 金属键 D 范德华力 E 氢键
(6)GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
(1)与NF3分子互为等电子体的分子为________ 。
(2)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图甲。
写出Fe3+的基态电子排布式________ 。
写出该反应的化学方程式:______________ 。
(3)维生素B4结构如图乙,则1mol维生素B4分子中含有σ键的数目为______ mol。
(4)配合物丙的结构见图,丙中含有__________ (填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
丙中碳原子的杂化方式有______________ 。
(1)与NF3分子互为等电子体的分子为
(2)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图甲。
写出Fe3+的基态电子排布式
写出该反应的化学方程式:
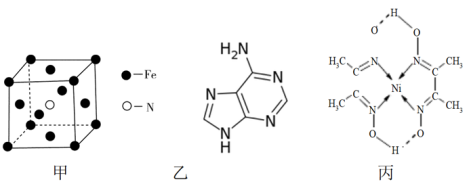
(3)维生素B4结构如图乙,则1mol维生素B4分子中含有σ键的数目为
(4)配合物丙的结构见图,丙中含有
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
丙中碳原子的杂化方式有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、P、Ni、Fe 等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。___________ 。
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。___________ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为___________ 。
③立方相氮化硼晶胞边长为apm, NA代表阿伏加德罗常数的值,则该晶体的密度为___________ g·cm-3。
(4)FeSO4·7H2O的结构如图所示,FeSO4·7H2O中∠1、∠2、∠3由大到小的顺序是___________ 。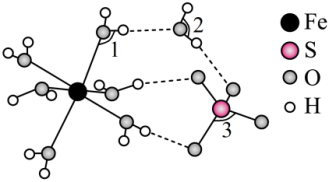
(5)镍的某种氧化物常用作催化剂,其晶胞有如图结构特征:镍离子形成面心立方结构,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。
①从该晶胞中能分割出来的结构图有___________ (填标号)。___________ 个,该距离为___________ pm(用含ρ和NA的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.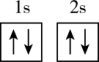 B.
B.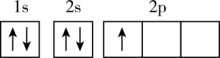 C.
C.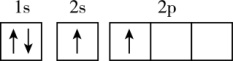 D.
D.
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
③立方相氮化硼晶胞边长为apm, NA代表阿伏加德罗常数的值,则该晶体的密度为
(4)FeSO4·7H2O的结构如图所示,FeSO4·7H2O中∠1、∠2、∠3由大到小的顺序是

(5)镍的某种氧化物常用作催化剂,其晶胞有如图结构特征:镍离子形成面心立方结构,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。
①从该晶胞中能分割出来的结构图有
a.  b.
b.  c.
c. d.
d. 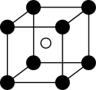 e.
e.
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___ 。
(2)在[Fe(CN)6]3-中不存在的化学键有__ 。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__ 。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__ ;分子中σ键和π键数目之比为__ 。
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。
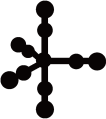
关于Fe(CO)5,下列说法正确的是__ 。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
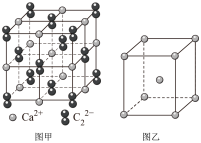
(5)与C22-互为等电子体的微粒__ (写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__ 。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__ nm(用含有d、NA的代数式表示)。
(1)基态Fe2+核外电子排布式为
(2)在[Fe(CN)6]3-中不存在的化学键有
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
(5)与C22-互为等电子体的微粒
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
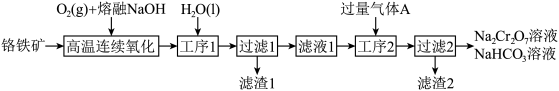
【推荐1】某科研团队设计了一种熔盐液相氧化法对铬铁矿(主要成分 ,含
,含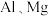 氧化物杂质)进行处理制备高价铬盐的工艺流程如图。
氧化物杂质)进行处理制备高价铬盐的工艺流程如图。
已知:①最高价铬酸根在酸性介质中以 存在,在碱性介质中以
存在,在碱性介质中以 存在:
存在:
② 在水溶液中以
在水溶液中以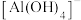 的形式存在。
的形式存在。
回答下列问题:
(1)铬铁矿在高温反应前需要进行的处理是
(2)“高温连续氧化”工序中
 发生反应的化学方程式为
发生反应的化学方程式为(3)下列物质可以替代
 的是
的是a. b.
b. c.
c.
(4)工序1的名称为
(5)该工艺可以利用滤渣1提取
 ,下图是
,下图是 晶胞,已知晶胞密度是
晶胞,已知晶胞密度是 ,用
,用 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则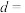
 (写出计算表达式即可)。
(写出计算表达式即可)。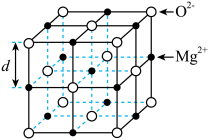
(6)气体
 是
是(7)若工序2中的铝元素恰好完全转化为沉淀,此时溶液中的

 ,(通常认为溶液中离子浓度小于
,(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全;


 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
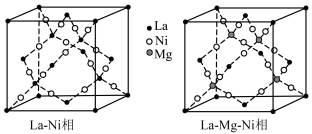
【推荐2】La-Ni相及La-Mg-Ni相均用作贮氢合金材料,以下为二者晶胞结构:
(1)金属镧La位于周期表的____________ 区; 的价电子排布图为
的价电子排布图为____________ ; 与同周期且相邻的元素第一电离能从大到小的顺序为
与同周期且相邻的元素第一电离能从大到小的顺序为____________ .
(2)La-Mg-Ni相的化学式为____________ ,其晶体中与 等距且最近的
等距且最近的 有
有____________ 个;La-Ni相中原子空间利用率为____________ (已知: 原子半径分别为
原子半径分别为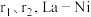 相晶胞参数为a)。
相晶胞参数为a)。
(3)镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,图(1)和图(2)是晶胞的不同切面。 和
和 的最短距离为
的最短距离为____________ .
②若原子1的分数坐标为 ,则
,则 的分数坐标为
的分数坐标为____________ 。
(1)金属镧La位于周期表的
 的价电子排布图为
的价电子排布图为 与同周期且相邻的元素第一电离能从大到小的顺序为
与同周期且相邻的元素第一电离能从大到小的顺序为(2)La-Mg-Ni相的化学式为
 等距且最近的
等距且最近的 有
有 原子半径分别为
原子半径分别为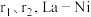 相晶胞参数为a)。
相晶胞参数为a)。(3)镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,图(1)和图(2)是晶胞的不同切面。
 和
和 的最短距离为
的最短距离为②若原子1的分数坐标为
 ,则
,则 的分数坐标为
的分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】C、Si、Pb是第ⅥA族元素。在生产、生活或科研中有重要的应用。
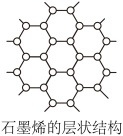
(1)不锈钢属于铁碳合金,碳的价电子排布式为___________ ,碳的一种单质石墨是单层二维蜂窝状品格结构的新材料(如图),其中碳原子采取___________ 杂化。
(2)已知 可以和EDTA(乙二胺四乙酸
可以和EDTA(乙二胺四乙酸 )形成无色的1∶1的稳定络合物,结构是
)形成无色的1∶1的稳定络合物,结构是 。其中提供空轨道的微粒是
。其中提供空轨道的微粒是___________ ,配合物的配位数是___________ 。
(3)瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。苯酚(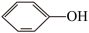 )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是___________ ,苯酚与甲苯(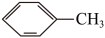 ,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是
,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是___________ 。
(4)我国科研人员在钙钛矿薄膜制备和光伏电池研究方面取得重大突破。如图为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
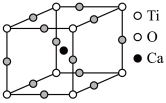
①该物质的晶体结构中,每个钛离子周围与它距离最近且相等的钙离子数是___________ ;
②设 为阿伏加德罗常数的值,晶体密度为
为阿伏加德罗常数的值,晶体密度为 ,晶体的摩尔体积为
,晶体的摩尔体积为___________ 。
(1)不锈钢属于铁碳合金,碳的价电子排布式为

(2)已知
 可以和EDTA(乙二胺四乙酸
可以和EDTA(乙二胺四乙酸 )形成无色的1∶1的稳定络合物,结构是
)形成无色的1∶1的稳定络合物,结构是 。其中提供空轨道的微粒是
。其中提供空轨道的微粒是(3)瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。苯酚(
 )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是 ,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是
,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是(4)我国科研人员在钙钛矿薄膜制备和光伏电池研究方面取得重大突破。如图为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。

①该物质的晶体结构中,每个钛离子周围与它距离最近且相等的钙离子数是
②设
 为阿伏加德罗常数的值,晶体密度为
为阿伏加德罗常数的值,晶体密度为 ,晶体的摩尔体积为
,晶体的摩尔体积为
您最近一年使用:0次



