亚氯酸钠( )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白,过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白,过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示:
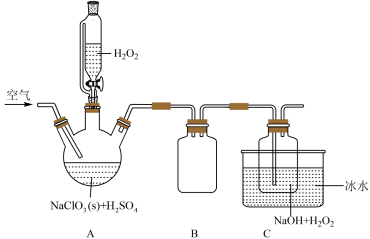
已知:
① 的熔点为
的熔点为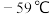 、沸点为
、沸点为 ,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、
,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。
②
请回答:
(1)A中盛放 的仪器名称为
的仪器名称为_________ ;按图组装好仪器后,首先应该进行的操作是_________ 。
(2)装置B的作用是_________ ;C装置使用冰水浴的目的_________ 。
(3) 是合成
是合成 的重要原料,写出三颈烧瓶中由
的重要原料,写出三颈烧瓶中由 生成
生成 的化学方程式:
的化学方程式:__________ 。
(4)装置C中加入 溶液的目的除了作反应物外,还因为
溶液的目的除了作反应物外,还因为__________________ 。
空气的流速过慢或过快都会影响 的产率,试分析原因:
的产率,试分析原因:_________ 。
(5)该套装置存在的明显缺陷是__________________ 。
(6)若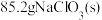 最终制得纯净的
最终制得纯净的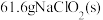 ,则
,则 的产率是
的产率是_________ (保留两位有效数字)。
 )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白,过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白,过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示:
已知:
①
 的熔点为
的熔点为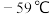 、沸点为
、沸点为 ,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、
,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。②

请回答:
(1)A中盛放
 的仪器名称为
的仪器名称为(2)装置B的作用是
(3)
 是合成
是合成 的重要原料,写出三颈烧瓶中由
的重要原料,写出三颈烧瓶中由 生成
生成 的化学方程式:
的化学方程式:(4)装置C中加入
 溶液的目的除了作反应物外,还因为
溶液的目的除了作反应物外,还因为空气的流速过慢或过快都会影响
 的产率,试分析原因:
的产率,试分析原因:(5)该套装置存在的明显缺陷是
(6)若
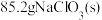 最终制得纯净的
最终制得纯净的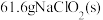 ,则
,则 的产率是
的产率是
更新时间:2023-03-31 22:21:50
|
相似题推荐
【推荐1】钢铁工业是国民经济的重要基础产业,目前比较先进的天然气竖炉冶铁工艺流程如下图所示:

(1)催化反应室发生的反应为:
ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206kJ/mol
CO(g)+3H2(g) △H=+206kJ/mol
ⅱ.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247kJ/mol。
2CO(g)+2H2(g) △H=+247kJ/mol。
① 催化反应室可能发生的副反应有CH4(g)+2H2O(g) CO2(g)+4H2(g),则该反应的△H=
CO2(g)+4H2(g),则该反应的△H=____ 。
② 催化反应室的温度通常需维持在550~750℃之间,从化学反应速率角度考虑,其主要目的是________ 。
③ 在催化反应室中,若两反应达到平衡时,容器中n(CH4)=0.2mol,n(CO)=0.3mol,n(H2)=0.5mol,则通入催化反应室CH4的起始物质的量为______ mol(不考虑副反应)。
(2)还原反应室发生的反应为:
ⅰ.Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-25kJ/mol
2Fe(s)+3CO2(g) △H=-25kJ/mol
ⅱ.Fe2O3(s)+3H2(g) 2Fe(s)+3H2O(g) △H=+98kJ/mol
2Fe(s)+3H2O(g) △H=+98kJ/mol
① 下列措施中能使反应i平衡时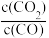 增大的是
增大的是______ (填字母)。
A.增大压强 B.降低温度 C.充入一定量氮气 D.增加Fe2O3(s)用量 E.增大CO的浓度 F.加入合适的催化剂
②若在1000℃下进行反应1(该温度下化学反应平衡常数为64), CO起始浓度为量2mol/L(Fe2O3过量),则CO的转化率为______ 。
③天然气竖炉冶铁相对于传统焦炭冶铁,该冶铁工艺的优点是______ 。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程发生的反应有:①2Fe3++Fe=3Fe2+
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③________________ 。

(1)催化反应室发生的反应为:
ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) △H=+206kJ/mol
CO(g)+3H2(g) △H=+206kJ/molⅱ.CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+247kJ/mol。
2CO(g)+2H2(g) △H=+247kJ/mol。① 催化反应室可能发生的副反应有CH4(g)+2H2O(g)
 CO2(g)+4H2(g),则该反应的△H=
CO2(g)+4H2(g),则该反应的△H=② 催化反应室的温度通常需维持在550~750℃之间,从化学反应速率角度考虑,其主要目的是
③ 在催化反应室中,若两反应达到平衡时,容器中n(CH4)=0.2mol,n(CO)=0.3mol,n(H2)=0.5mol,则通入催化反应室CH4的起始物质的量为
(2)还原反应室发生的反应为:
ⅰ.Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) △H=-25kJ/mol
2Fe(s)+3CO2(g) △H=-25kJ/molⅱ.Fe2O3(s)+3H2(g)
 2Fe(s)+3H2O(g) △H=+98kJ/mol
2Fe(s)+3H2O(g) △H=+98kJ/mol① 下列措施中能使反应i平衡时
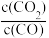 增大的是
增大的是A.增大压强 B.降低温度 C.充入一定量氮气 D.增加Fe2O3(s)用量 E.增大CO的浓度 F.加入合适的催化剂
②若在1000℃下进行反应1(该温度下化学反应平衡常数为64), CO起始浓度为量2mol/L(Fe2O3过量),则CO的转化率为
③天然气竖炉冶铁相对于传统焦炭冶铁,该冶铁工艺的优点是
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程发生的反应有:①2Fe3++Fe=3Fe2+
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
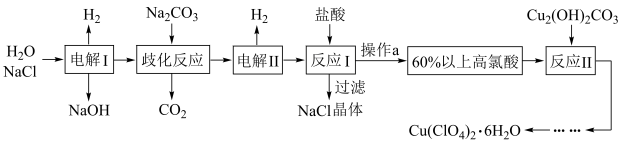
【推荐2】高氯酸铜易溶于水,在130'℃时会发生分解反应,是一种燃烧催化剂,以食盐等为原料制备高氯酸铜 [ Cu(ClO4)26 H2O) ]的一种工艺流程如下:
回答下列问题
(1)“电解I”的化学方程式为_________ ,所用交换膜是_ (填“阳离子交换膜或“阴离子交换膜”) 。
(2)歧化反应是同一种物质中同种元素(自身氧化还原反应 ,已知上述工艺流程中“歧化反应”的产物之一为 NaClO3
①“歧化反应”的化学方程式为_ 。
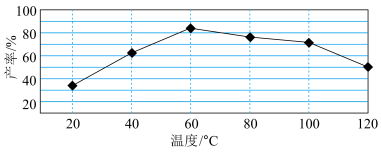
②“歧化反应”阶段不同温度对产率影响的结果如图所示。则该反应最适宜的温度是______ 。
(3)“电解II”的阳极产物为______ (填离子符号).
(4) 该流程中可循环利用的物质是_________ (填化学式) 。
(5) 用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a千克。 最终制得的Cu( ClO4)2• 6 H2O为b千克.则产率为_____ (用含a、 b 的代数式表示) 。
(6) 某温度下 ,高氯酸铜可按A、B 两种方式同时分解.分解过程中铜的化合价不发生改变。A方式为Cu( ClO4)2 CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为
CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).

回答下列问题
(1)“电解I”的化学方程式为
(2)歧化反应是同一种物质中同种元素(自身氧化还原反应 ,已知上述工艺流程中“歧化反应”的产物之一为 NaClO3
①“歧化反应”的化学方程式为
②“歧化反应”阶段不同温度对产率影响的结果如图所示。则该反应最适宜的温度是

(3)“电解II”的阳极产物为
(4) 该流程中可循环利用的物质是
(5) 用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a千克。 最终制得的Cu( ClO4)2• 6 H2O为b千克.则产率为
(6) 某温度下 ,高氯酸铜可按A、B 两种方式同时分解.分解过程中铜的化合价不发生改变。A方式为Cu( ClO4)2
 CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为
CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】CoCl2•6H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表。
③CoCl2•6H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2。
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为________________________ 。
(2)向浸出液中加入适量NaClO3目的是______________________________________ 。
(3)“加Na2CO3调pH至a”,a的范围是______ ;过滤所得沉淀的化学式为_________ 。
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是_____ ,使用该萃取剂的最佳pH范围是_____ (填选项字母,pH-萃取率见下)
A.5.0﹣5.5 B.4.0﹣4.5 C.3.0﹣3.5 D.2.0﹣2.5


已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为
(2)向浸出液中加入适量NaClO3目的是
(3)“加Na2CO3调pH至a”,a的范围是
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是
A.5.0﹣5.5 B.4.0﹣4.5 C.3.0﹣3.5 D.2.0﹣2.5

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】 是一种极易水解的化合物,它的制备需要在无水的条件下,密闭的装置中进行。若用常规(系统的体积较大)方法进行多实验缺点比较多,图采用微型实验进行
是一种极易水解的化合物,它的制备需要在无水的条件下,密闭的装置中进行。若用常规(系统的体积较大)方法进行多实验缺点比较多,图采用微型实验进行 的制备,解决了常规方法的弊端(已知:
的制备,解决了常规方法的弊端(已知: 的熔点为-33℃,沸点为114.1℃)。
的熔点为-33℃,沸点为114.1℃)。
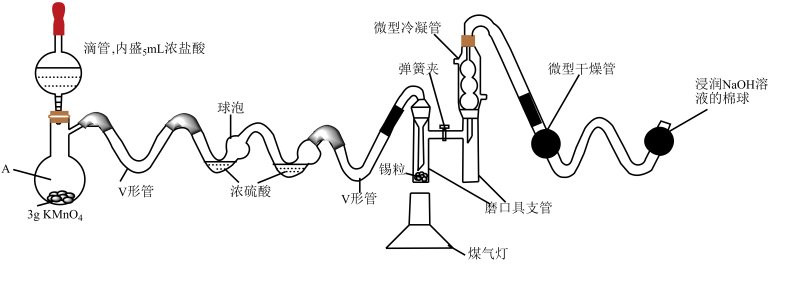
(1)将已干燥的各部分仪器按图连接好后,需要进行的操作为______________ 。
(2)V形管的作用是_________________________ 。
(3)下列说法中正确的是______________ 。
A.仪器A的名称为蒸馏烧瓶
B.为了充分干燥氯气,浓硫酸的体积应大于球泡的体积
C.操作时应先滴加浓盐酸,使整套装置内充满黄绿色气体,再用煤气灯加热
D.生成的 蒸气经冷却聚集在磨口具支管中
蒸气经冷却聚集在磨口具支管中
E.微型干燥管中的试剂可以是碱石灰、五氧化二磷或无水氯化钙等
(4)实验中0.5g锡粒完全反应制得1.03g ,则该实验的产率为
,则该实验的产率为__________ (计算结果保留一位小数)。
(5) 遇氨及水蒸气的反应是制作烟幕弹的原理,反应的化学方程式为
遇氨及水蒸气的反应是制作烟幕弹的原理,反应的化学方程式为______________ 。
(6)该微型实验的优点是_____________ (任写两条)。
 是一种极易水解的化合物,它的制备需要在无水的条件下,密闭的装置中进行。若用常规(系统的体积较大)方法进行多实验缺点比较多,图采用微型实验进行
是一种极易水解的化合物,它的制备需要在无水的条件下,密闭的装置中进行。若用常规(系统的体积较大)方法进行多实验缺点比较多,图采用微型实验进行 的制备,解决了常规方法的弊端(已知:
的制备,解决了常规方法的弊端(已知: 的熔点为-33℃,沸点为114.1℃)。
的熔点为-33℃,沸点为114.1℃)。
(1)将已干燥的各部分仪器按图连接好后,需要进行的操作为
(2)V形管的作用是
(3)下列说法中正确的是
A.仪器A的名称为蒸馏烧瓶
B.为了充分干燥氯气,浓硫酸的体积应大于球泡的体积
C.操作时应先滴加浓盐酸,使整套装置内充满黄绿色气体,再用煤气灯加热
D.生成的
 蒸气经冷却聚集在磨口具支管中
蒸气经冷却聚集在磨口具支管中E.微型干燥管中的试剂可以是碱石灰、五氧化二磷或无水氯化钙等
(4)实验中0.5g锡粒完全反应制得1.03g
 ,则该实验的产率为
,则该实验的产率为(5)
 遇氨及水蒸气的反应是制作烟幕弹的原理,反应的化学方程式为
遇氨及水蒸气的反应是制作烟幕弹的原理,反应的化学方程式为(6)该微型实验的优点是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】氯及其化合物在工业生产中具有很重要的作用。
(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:_______ 。要想得到纯净干燥的氯气,一般先通入饱和的食盐水,然后再通入浓硫酸中。饱和食盐水的作用:①_______ ②降低氯气在水中的溶解度。试通过平衡移动的原理分析饱和食盐水降低氯气在水中的溶解度。原因是:_______ 。
(2)氯的化合物 在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量
在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量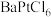 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、
、 和
和 ,T℃时平衡常数
,T℃时平衡常数 。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
_______ kPa,反应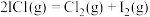 的平衡常数
的平衡常数
_______ 。
(3)氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:
①次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数 [
[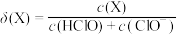 ,X为
,X为 或
或 与pH的关系如图所示。
与pH的关系如图所示。 的电离常数
的电离常数 值为
值为_______ 。

② 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,生成
溶液。上述过程中,生成 的反应属于歧化反应,每生成1mol
的反应属于歧化反应,每生成1mol 消耗
消耗 的量为
的量为_______ mol;产生“气泡”的化学方程式为_______ 。
③84消毒液的主要成分为 和
和 。已知25℃时,下列酸的电离平衡常数如下:
。已知25℃时,下列酸的电离平衡常数如下:
写出少量的 通入84消毒液中的离子方程式:
通入84消毒液中的离子方程式:_______ 。
④二氯异氰尿酸钠是一种常用的消毒剂,具有很强的氧化性,对各种致病性微生物如病毒、细菌芽孢、真菌等有很强的杀生作用,是一种适用范围广,高效的杀菌剂,二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。
已知:实验检测原理为:
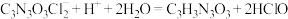



准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量 溶液,密封在暗处静置5min;用
溶液,密封在暗处静置5min;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
滴定终点的现象是:_______ ,该样品有效氯=_______ 。
(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:
(2)氯的化合物
 在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量
在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量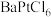 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、
、 和
和 ,T℃时平衡常数
,T℃时平衡常数 。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
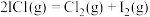 的平衡常数
的平衡常数
(3)氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:
①次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数
 [
[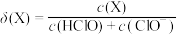 ,X为
,X为 或
或 与pH的关系如图所示。
与pH的关系如图所示。 的电离常数
的电离常数 值为
值为
②
 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,生成
溶液。上述过程中,生成 的反应属于歧化反应,每生成1mol
的反应属于歧化反应,每生成1mol 消耗
消耗 的量为
的量为③84消毒液的主要成分为
 和
和 。已知25℃时,下列酸的电离平衡常数如下:
。已知25℃时,下列酸的电离平衡常数如下:| 化学式 |  |  |  |
| 电离平衡常数 |  |   |  |
 通入84消毒液中的离子方程式:
通入84消毒液中的离子方程式:④二氯异氰尿酸钠是一种常用的消毒剂,具有很强的氧化性,对各种致病性微生物如病毒、细菌芽孢、真菌等有很强的杀生作用,是一种适用范围广,高效的杀菌剂,二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。
已知:实验检测原理为:
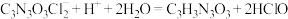



准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量
 溶液,密封在暗处静置5min;用
溶液,密封在暗处静置5min;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。滴定终点的现象是:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】二氯化二硫 可作硫化剂、氯化剂。常温下,
可作硫化剂、氯化剂。常温下, 是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)选用以下装置制取少量 (加热及夹持装置略)。
(加热及夹持装置略)。

①写出A中发生反应的化学方程式_______ 。
②装置连接顺序:A→_______ 。
③B中玻璃纤维的作用是什么_______ ?
④D中盛放的试剂是什么_______ ?
(2) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。

①W溶液可以是下列溶液中的_______ (填标号)。
a. 溶液 b.酸性
溶液 b.酸性 溶液 C.氯水 d.
溶液 C.氯水 d. 溶液
溶液
②计算混合气体中 的体积分数
的体积分数______ (用含 、
、 的代数式表示,不要求计算过程)。
的代数式表示,不要求计算过程)。
 可作硫化剂、氯化剂。常温下,
可作硫化剂、氯化剂。常温下, 是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)选用以下装置制取少量
 (加热及夹持装置略)。
(加热及夹持装置略)。
①写出A中发生反应的化学方程式
②装置连接顺序:A→
③B中玻璃纤维的作用是什么
④D中盛放的试剂是什么
(2)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
①W溶液可以是下列溶液中的
a.
 溶液 b.酸性
溶液 b.酸性 溶液 C.氯水 d.
溶液 C.氯水 d. 溶液
溶液②计算混合气体中
 的体积分数
的体积分数 、
、 的代数式表示,不要求计算过程)。
的代数式表示,不要求计算过程)。
您最近一年使用:0次
【推荐1】钛酸钡(BeTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__ 。
(2)用盐酸酸浸时发生反应的离子方程式为:__ ,为提高酸浸速率,可适当进行加热,但温度不宜过高,原因是__ 。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:__ 。
②简述证明草酸氧化钛钡晶体已洗净的操作及现象__ 。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:__ 。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___ 。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为__ mol/L。

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:
(2)用盐酸酸浸时发生反应的离子方程式为:
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:
②简述证明草酸氧化钛钡晶体已洗净的操作及现象
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】某小组利用一定浓度 溶液制备
溶液制备 ,再用
,再用 氧化
氧化 ,并检验氧化产物。
,并检验氧化产物。
Ⅰ.制备 。
。
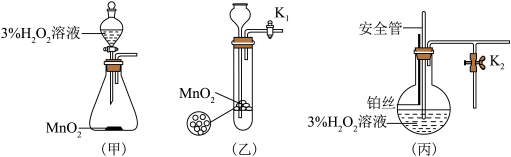
该小组同学设计了如下气体发生装置(夹持装置省略)___________ 。
(2)乙装置中,用粘合剂将 制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞
制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞 ,经长颈漏斗向试管中缓慢加入3%
,经长颈漏斗向试管中缓慢加入3% 溶液至
溶液至___________ ,欲使反应停止,关闭活塞 即可,此时装置中的现象是
即可,此时装置中的现象是___________ 。
(3)丙装置中盛装3% 溶液的仪器名称为
溶液的仪器名称为___________ 。丙装置可用于制备较多 ,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________ ,此时可以将铂丝抽离 溶液,还可以采取的安全措施是
溶液,还可以采取的安全措施是___________ 。
(4)丙装置的特点是___________ (填序号)。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的 含量高、杂质种类少
含量高、杂质种类少
Ⅱ.氧化 。
。
该小组同学设计的氧化 的装置如图(夹持装置省略)
的装置如图(夹持装置省略)___________ 。
②乙醇催化氧化的化学方程式为___________ 。
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
已知:a.乙醛的结构简式为 。
。
b.乙醛的官能团为醛基( ),常温下能使酸性
),常温下能使酸性 溶液褪色;加热条件下,能与新制
溶液褪色;加热条件下,能与新制 悬浊液反应生成砖红色沉淀(
悬浊液反应生成砖红色沉淀( )。
)。
实验①~③中的结论不合理的是___________ (填序号),原因是___________ 。
 溶液制备
溶液制备 ,再用
,再用 氧化
氧化 ,并检验氧化产物。
,并检验氧化产物。Ⅰ.制备
 。
。该小组同学设计了如下气体发生装置(夹持装置省略)
(2)乙装置中,用粘合剂将
 制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞
制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞 ,经长颈漏斗向试管中缓慢加入3%
,经长颈漏斗向试管中缓慢加入3% 溶液至
溶液至 即可,此时装置中的现象是
即可,此时装置中的现象是(3)丙装置中盛装3%
 溶液的仪器名称为
溶液的仪器名称为 ,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是 溶液,还可以采取的安全措施是
溶液,还可以采取的安全措施是(4)丙装置的特点是
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的
 含量高、杂质种类少
含量高、杂质种类少Ⅱ.氧化
 。
。该小组同学设计的氧化
 的装置如图(夹持装置省略)
的装置如图(夹持装置省略)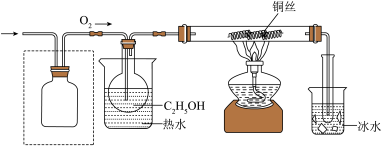
②乙醇催化氧化的化学方程式为
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
已知:a.乙醛的结构简式为
 。
。b.乙醛的官能团为醛基(
 ),常温下能使酸性
),常温下能使酸性 溶液褪色;加热条件下,能与新制
溶液褪色;加热条件下,能与新制 悬浊液反应生成砖红色沉淀(
悬浊液反应生成砖红色沉淀( )。
)。| 实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
| ① | 酸性 溶液 溶液 | 紫色褪去 | 产物含有乙醛 |
| ② | 新制 悬浊液,加热 悬浊液,加热 | 生成砖红色沉淀 | 产物含有乙醛 |
| ③ | 微红色含酚酞的 溶液 溶液 | 微红色褪去 | 产物可能含有乙酸 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】铁是人体必需的微量元素,主要存在于血红蛋白、硫酸亚铁片可以治疗缺铁性贫血。
(1)硫酸亚铁片上糖衣的作用:改善口感和_______ 。
(2)对药物相互作用原理进行分析
①从氧化还原反应的角度分析维生素C的作用为_______ 。
②硫酸亚铁溶液与碳酸氢钠溶液反应的离子方程式为_______ 。
(3)L-乳酸亚铁为第二代补铁剂,其制备流程图如下:

① 溶液与精制L-乳酸钙[
溶液与精制L-乳酸钙[ ]反应的化学方程式为
]反应的化学方程式为_______ 。
②“恒温反应”对提高产品质量十分重要,下图为反应温度与产品产率及产品中 杂质含量的关系。由图可知应选择的合适温度为
杂质含量的关系。由图可知应选择的合适温度为_______ 。温度过高,产品由浅绿色变为黄色,并伴有红褐色物质出现,其反应的化学方程式为_______ 。

③“干燥”方式为_______ (填标号)。
A. 低温常压 B. 低温真空 C. 高温常压 D. 高温真空
④该流程中可循环利用的物质是_______ 。
⑤ 经过制备得到的产品L-乳酸亚铁质量为
经过制备得到的产品L-乳酸亚铁质量为 ,则产品的产率为
,则产品的产率为_______ 。
| 硫酸亚铁片 英文名:Ferrous Sulfate Tablets 【辅料】羟丙甲纤维素、微品颗粒、硬脂酸镁、二氧化硅。 【性状】本品为糖衣片,除去糖衣后显淡蓝绿色。 【规格】0.3g 【贮藏】密封,在干燥处保存。 【药物相互作用】本品与维生素C同服有利于吸收;本品与制酸药如碳酸氢钠或饮料同用,易产生沉淀和气体,影响吸收。 |
(2)对药物相互作用原理进行分析
①从氧化还原反应的角度分析维生素C的作用为
②硫酸亚铁溶液与碳酸氢钠溶液反应的离子方程式为
(3)L-乳酸亚铁为第二代补铁剂,其制备流程图如下:

①
 溶液与精制L-乳酸钙[
溶液与精制L-乳酸钙[ ]反应的化学方程式为
]反应的化学方程式为②“恒温反应”对提高产品质量十分重要,下图为反应温度与产品产率及产品中
 杂质含量的关系。由图可知应选择的合适温度为
杂质含量的关系。由图可知应选择的合适温度为
③“干燥”方式为
A. 低温常压 B. 低温真空 C. 高温常压 D. 高温真空
④该流程中可循环利用的物质是
⑤
 经过制备得到的产品L-乳酸亚铁质量为
经过制备得到的产品L-乳酸亚铁质量为 ,则产品的产率为
,则产品的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】已知某纯碱试样中含有杂质氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验。

主要步骤如下,请填空:
①按图组装仪器,并检查装置的气密性②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;③称量盛有碱石灰的U形管的质量为bg;④从分液漏斗中滴入6mol/L的稀硫酸,直到不再产生气体为止,⑤从导管A处缓缓鼓入一定量的空气;⑥再次称量盛有碱石灰的U形管的质量为cg;⑦重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为dg。
回答下列问题:(碱石灰是一种干燥剂,不能干燥酸性气体)
(1)装置中干燥管B的作用是____________
(2)如果将分液漏斗中的硫酸换成同浓度的盐酸,测试的结果将____________ (填偏高.偏低或不变)
(3)浓硫酸的作用是____________
(4)步骤⑤的目的是____________
(5)步骤⑦的目的是____________
(6)该试样中纯碱的质量分数的计算式为____________

主要步骤如下,请填空:
①按图组装仪器,并检查装置的气密性②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;③称量盛有碱石灰的U形管的质量为bg;④从分液漏斗中滴入6mol/L的稀硫酸,直到不再产生气体为止,⑤从导管A处缓缓鼓入一定量的空气;⑥再次称量盛有碱石灰的U形管的质量为cg;⑦重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为dg。
回答下列问题:(碱石灰是一种干燥剂,不能干燥酸性气体)
(1)装置中干燥管B的作用是
(2)如果将分液漏斗中的硫酸换成同浓度的盐酸,测试的结果将
(3)浓硫酸的作用是
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
您最近一年使用:0次
【推荐2】I.为探究难溶性盐X(仅含三种元素)的组成和性质,设计并完成如下实验:
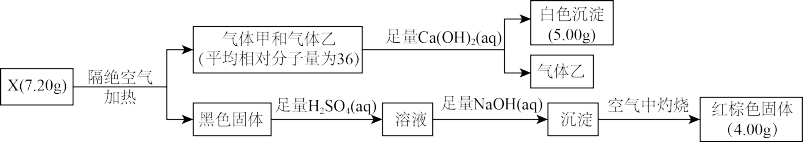
已知:气体甲和气体乙组成元素相同。
请回答:
(1)气体乙的摩尔质量是_________ 。
(2)写出X在隔绝空气条件下加热分解的化学方程式_______________ 。
Ⅱ.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图(注:SiCl4遇水易水解)。

请回答下列问题:
(3)D装置的作用_______________ 。
(4)装置A的硬质玻璃管中发生反应的化学方程式是________________ 。
(5)C中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和 。以下是探究该吸收液中可能存在其他酸根离子(忽略空气中CO2的影响)的实验。
。以下是探究该吸收液中可能存在其他酸根离子(忽略空气中CO2的影响)的实验。
【提出假设】假设1:只有 ;假设2:只有ClO-。假设3:……
;假设2:只有ClO-。假设3:……
【设计方案】取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈酸性,向试管中滴加_______ 溶液,若溶液变为蓝色,则假设2成立。

已知:气体甲和气体乙组成元素相同。
请回答:
(1)气体乙的摩尔质量是
(2)写出X在隔绝空气条件下加热分解的化学方程式
Ⅱ.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图(注:SiCl4遇水易水解)。

请回答下列问题:
(3)D装置的作用
(4)装置A的硬质玻璃管中发生反应的化学方程式是
(5)C中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和
 。以下是探究该吸收液中可能存在其他酸根离子(忽略空气中CO2的影响)的实验。
。以下是探究该吸收液中可能存在其他酸根离子(忽略空气中CO2的影响)的实验。【提出假设】假设1:只有
 ;假设2:只有ClO-。假设3:……
;假设2:只有ClO-。假设3:……【设计方案】取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈酸性,向试管中滴加
您最近一年使用:0次




