硝酸在生产生活及国防建设中非常重要,工业制备硝酸的流程如下:
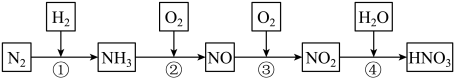
(1)②反应的化学方程式为___________ 。
(2) 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为___________ 。
(3)硝酸工厂产生的氮氧化物的尾气需处理后才能排放,可用NaOH溶液吸收。主要反应为NO+ NO2+2OH-=2 NO +H2O,2NO2+2OH-=NO
+H2O,2NO2+2OH-=NO +NO
+NO +H2O。下列措施能提高NO和NO2去除率的有
+H2O。下列措施能提高NO和NO2去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(4)也可用Na2CO3溶液吸收氮氧化物的尾气制备NaNO2、NaNO3。工艺流程如下:
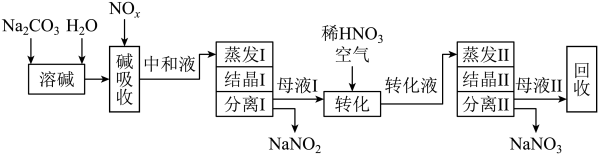
已知方程式:Na2CO3+NO+NO2 =2NaNO2+CO2。母液Ⅰ进行转化时通入空气的目的是___________ 。母液Ⅱ需回收利用,合理的处理方法是转入流程中___________ 中(填“中和液”或“转化液”)。

(1)②反应的化学方程式为
(2)
 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为(3)硝酸工厂产生的氮氧化物的尾气需处理后才能排放,可用NaOH溶液吸收。主要反应为NO+ NO2+2OH-=2 NO
 +H2O,2NO2+2OH-=NO
+H2O,2NO2+2OH-=NO +NO
+NO +H2O。下列措施能提高NO和NO2去除率的有
+H2O。下列措施能提高NO和NO2去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(4)也可用Na2CO3溶液吸收氮氧化物的尾气制备NaNO2、NaNO3。工艺流程如下:

已知方程式:Na2CO3+NO+NO2 =2NaNO2+CO2。母液Ⅰ进行转化时通入空气的目的是
更新时间:2023-05-14 10:52:39
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料。
Ⅰ.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸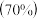 为原料制取硫酸铜晶体。其工艺流程如下:
为原料制取硫酸铜晶体。其工艺流程如下:
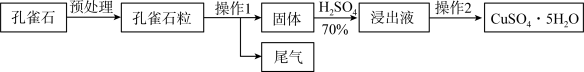
(1)预处理时要用破碎机将孔雀石破碎成粒子直径<1 mm,破碎的目的是_____ 。
(2)操作1为高温焙烧,主要反应化学方程式:_____ 。
(3)操作2为一系列的操作,通过加热浓缩、_____ 、过滤、洗涤、干燥等操作得到硫酸铜晶体。
Ⅱ.采用金属铜单质制备硫酸铜晶体
(4)教材中用金属铜单质与浓硫酸反应制备硫酸铜,虽然生产工艺简洁,但在实际生产过程中不采用,其原因是_____ 。(写两个)
(5)某实验小组在实验室制备少量硫酸铜溶液

①为了得到较纯净的硫酸铜溶液,硫酸与硝酸的物质的量之比为_____ ;所发生的离子方程式_____ 。
②充分吸收尾气得到循环使用的物质是_____ 。
Ⅰ.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸
 为原料制取硫酸铜晶体。其工艺流程如下:
为原料制取硫酸铜晶体。其工艺流程如下:
(1)预处理时要用破碎机将孔雀石破碎成粒子直径<1 mm,破碎的目的是
(2)操作1为高温焙烧,主要反应化学方程式:
(3)操作2为一系列的操作,通过加热浓缩、
Ⅱ.采用金属铜单质制备硫酸铜晶体
(4)教材中用金属铜单质与浓硫酸反应制备硫酸铜,虽然生产工艺简洁,但在实际生产过程中不采用,其原因是
(5)某实验小组在实验室制备少量硫酸铜溶液

①为了得到较纯净的硫酸铜溶液,硫酸与硝酸的物质的量之比为
②充分吸收尾气得到循环使用的物质是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】钴及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.
(1)CoxNi(1-x)Fe2O4可用作H2O2分解的催化剂
①已知CoxNi(1-x)Fe2O4中Co、Ni化合价均为+2,则该化合物这铁元素的化合价为_______
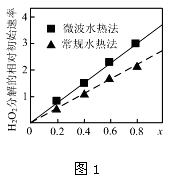
②如图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:_______ 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是__________
③CoxNi(1-x)Fe2O4能与氢碘酸发生氧化还原反应,所得溶液这含有三种金属离子,写出反应的离子方程式____________
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
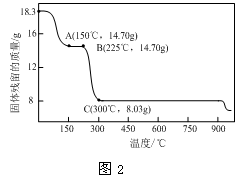
① 通过计算确定C点剩余固体的化学式为________
② 取一定质量二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为______________ 。
(3)以硫化钴(Co3S4)为原料冶炼钴的原理为在空气中焙烧矿石得到两种氧化物,反应中只有一种元素被氧化,然后利用铝热反应可得到钴。写出焙烧时的化学方程式:________ ;写出铝热反应的引发操作_______ 。
(1)CoxNi(1-x)Fe2O4可用作H2O2分解的催化剂
①已知CoxNi(1-x)Fe2O4中Co、Ni化合价均为+2,则该化合物这铁元素的化合价为
②如图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:

③CoxNi(1-x)Fe2O4能与氢碘酸发生氧化还原反应,所得溶液这含有三种金属离子,写出反应的离子方程式
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。

① 通过计算确定C点剩余固体的化学式为
② 取一定质量二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为
(3)以硫化钴(Co3S4)为原料冶炼钴的原理为在空气中焙烧矿石得到两种氧化物,反应中只有一种元素被氧化,然后利用铝热反应可得到钴。写出焙烧时的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以焙烧黄铁矿(FeS2,杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料,工艺流程如图。
颜料,工艺流程如图。
(1)写出两种能够提高酸浸率的措施___________ 。
(2)红渣的主要成分是___________ (填化学式),焙烧黄铁矿过程中若产生8.96 L(标准状况)SO2,则反应中转移电子的数目为___________ 。
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为___________ 。
(4)“一系列操作”包括___________ 、___________ 、过滤。
(5)简述洗涤铵铁蓝沉淀的操作:___________ 。
 颜料,工艺流程如图。
颜料,工艺流程如图。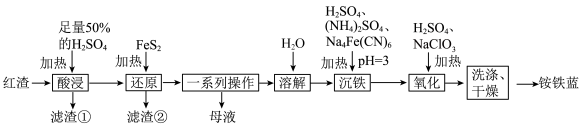
(1)写出两种能够提高酸浸率的措施
(2)红渣的主要成分是
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为
(4)“一系列操作”包括
(5)简述洗涤铵铁蓝沉淀的操作:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】碱式碳酸锰[Mn2(OH)2CO3]是一种不溶于水的固体,是制造其他含锰化合物的原料。工业上以方锰矿(主要成分为MnO,还含有少量的Fe3O4、Al2O3、CaO、SiO2)为原料制备碱式碳酸锰。
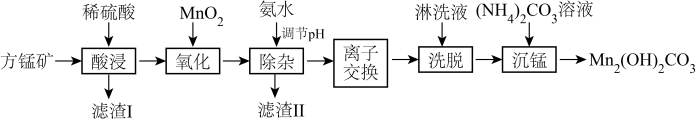
25℃时,相关物质的Ksp如表:
回答下列问题:
(1)“酸浸”时,滤渣I的成分是_____ (填化学式)。
(2)“氧化”时,该反应的离子方程式为_____ 。
(3)“除杂”时,使用氨水的目的是将Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥_____ ;若Al3+沉淀完全时,则溶液中Fe3+的物质的量浓度为_____ mol•L-1通常认为溶液中的离子浓度≤1×10-5mol•L-1沉淀完全)。
(4)“离子交换”和“洗脱”时,发生反应:Mn2++2HR MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为_____ (填“硫酸”、“氢氧化钠溶液”或“蒸馏水)。
(5)沉锰时,反应的离子方程式为_____ ,过滤、洗涤、干燥,得到Mn2(OH)2CO3,检验沉淀是否洗涤干净的操作是_____ 。

25℃时,相关物质的Ksp如表:
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| Ksp | 2×10-13 | 5×10-17 | 3×10-39 | 1×10-32 | 6×10-6 |
(1)“酸浸”时,滤渣I的成分是
(2)“氧化”时,该反应的离子方程式为
(3)“除杂”时,使用氨水的目的是将Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥
(4)“离子交换”和“洗脱”时,发生反应:Mn2++2HR
 MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2+2H+(HR是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为(5)沉锰时,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】请按要求写出相应的方程式。
(1)某小组同学合作探究铝铁混合物分离的工艺流程如下:
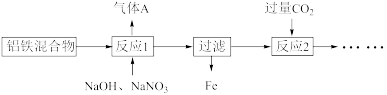
①气体A能使湿润的红色石蕊试纸变蓝。写出加热时反应1的离子方程式:______ 。
②反应2的离子方程式为______ 。
(2)由工业废气(NO、SO2)制备Na2S2O4的实验原理如下:
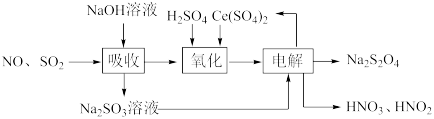
①氧化时Ce(SO4)2转化为Ce2(SO4)3,NO转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1。写出该反应的离子方程式:______ 。
②电解时SO 发生的电极反应为
发生的电极反应为_____ 。
(1)某小组同学合作探究铝铁混合物分离的工艺流程如下:

①气体A能使湿润的红色石蕊试纸变蓝。写出加热时反应1的离子方程式:
②反应2的离子方程式为
(2)由工业废气(NO、SO2)制备Na2S2O4的实验原理如下:

①氧化时Ce(SO4)2转化为Ce2(SO4)3,NO转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1。写出该反应的离子方程式:
②电解时SO
 发生的电极反应为
发生的电极反应为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】实验室用 固体配制900mL0.05mol·L-1的
固体配制900mL0.05mol·L-1的 溶液,回答下列问题:
溶液,回答下列问题:
(1)计算并称量 固体的质量为
固体的质量为___ g,该实验中必须用到的标有温度的玻璃仪器是___ 。
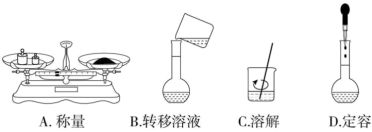
(2)下列实验操作规范的是____ (填标号)。
(3)下列情况会使所配制的 溶液浓度偏大的是
溶液浓度偏大的是_______ (填标号)
A.未洗涤烧杯和玻璃棒
B.将溶解后的溶液转移至容量瓶之前,容量瓶未干燥,含有少量蒸馏水
C.定容时俯视刻度线
D.定容时,发现液面超过刻度线,用吸管将多余的溶液吸出
(4)取所配制的 溶液1.0mL于试管中,向其中滴加稀硫酸和KI溶液,发现溶液由紫色变成棕黄色,测知有
溶液1.0mL于试管中,向其中滴加稀硫酸和KI溶液,发现溶液由紫色变成棕黄色,测知有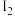 和
和 生成,则反应的离子方程式为
生成,则反应的离子方程式为_______ 。
 固体配制900mL0.05mol·L-1的
固体配制900mL0.05mol·L-1的 溶液,回答下列问题:
溶液,回答下列问题:(1)计算并称量
 固体的质量为
固体的质量为(2)下列实验操作规范的是

(3)下列情况会使所配制的
 溶液浓度偏大的是
溶液浓度偏大的是A.未洗涤烧杯和玻璃棒
B.将溶解后的溶液转移至容量瓶之前,容量瓶未干燥,含有少量蒸馏水
C.定容时俯视刻度线
D.定容时,发现液面超过刻度线,用吸管将多余的溶液吸出
(4)取所配制的
 溶液1.0mL于试管中,向其中滴加稀硫酸和KI溶液,发现溶液由紫色变成棕黄色,测知有
溶液1.0mL于试管中,向其中滴加稀硫酸和KI溶液,发现溶液由紫色变成棕黄色,测知有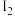 和
和 生成,则反应的离子方程式为
生成,则反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。根据所学知识,回答下列问题:
(1)实验室加热亚硝酸铵(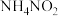 )的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为
)的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为___________ ,被氧化的氮原子与被还原的氮原子的物质的量之比为___________ 。
(2)氨气还原氧化铜也可制得氮气,实验装置如图。
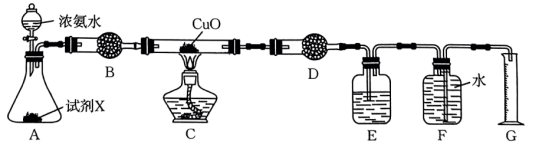
①试剂X为___________ 。
②装置B的作用为___________ 。
③氨水呈碱性的原因是___________ (用离子方程式表示)。
④若在试管中进行氨气与红热的氧化铜反应的实验,可观察到的实验现象为___________ ,反应的化学方程式为___________ 。
⑤某化肥厂用 制备
制备 。已知:由
。已知:由 制NO的产率是96%,由NO制
制NO的产率是96%,由NO制 的产率是92%,则制
的产率是92%,则制 所用去的
所用去的 的质量占总耗
的质量占总耗 质量(不考虑其他损耗)的百分比为
质量(不考虑其他损耗)的百分比为___________ (计算结果精确到0.1%)。
(1)实验室加热亚硝酸铵(
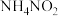 )的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为
)的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为(2)氨气还原氧化铜也可制得氮气,实验装置如图。

①试剂X为
②装置B的作用为
③氨水呈碱性的原因是
④若在试管中进行氨气与红热的氧化铜反应的实验,可观察到的实验现象为
⑤某化肥厂用
 制备
制备 。已知:由
。已知:由 制NO的产率是96%,由NO制
制NO的产率是96%,由NO制 的产率是92%,则制
的产率是92%,则制 所用去的
所用去的 的质量占总耗
的质量占总耗 质量(不考虑其他损耗)的百分比为
质量(不考虑其他损耗)的百分比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】研究氮的循环和转化对生产,生活有重要的价值。
(1)氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如图所示。_______ 。
②设备2、3中发生反应的化学方程式分别是_______ ;_______ 。
(2)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:
含 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水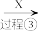 达标
达标
①过程①的目的是将 转化为
转化为 ,并通过鼓入大量空气将氨气吹出,写出
,并通过鼓入大量空气将氨气吹出,写出 转化为
转化为 的离子方程式:
的离子方程式:_______ 。
②过程②加入NaClO溶液可将氨氮物质转化为无毒物质,请用离子方程式表示该转化过程_______ 。
③含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的_______ (填字母)。
a.KOH b. c.
c. d.NaCl
d.NaCl
写出其中一个反应的离子方程式:_______ 。
(3) 是燃油汽车尾气中的主要污染物之一。
是燃油汽车尾气中的主要污染物之一。
①在催化剂和加热条件下, 与
与 可反应生成无害物质,请写出反应的化学方程式:
可反应生成无害物质,请写出反应的化学方程式:_______ 。
②实验室可用烧碱溶液吸收 和NO,(已知
和NO,(已知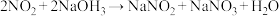 ,
,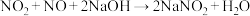 ),当消耗
),当消耗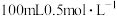 的烧碱溶液时,共吸收混合气体
的烧碱溶液时,共吸收混合气体_______ L(标准状况)。
(1)氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如图所示。
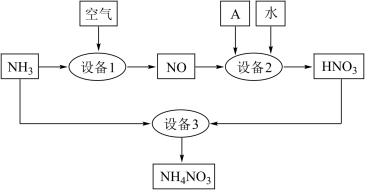
②设备2、3中发生反应的化学方程式分别是
(2)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:含
 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标①过程①的目的是将
 转化为
转化为 ,并通过鼓入大量空气将氨气吹出,写出
,并通过鼓入大量空气将氨气吹出,写出 转化为
转化为 的离子方程式:
的离子方程式:②过程②加入NaClO溶液可将氨氮物质转化为无毒物质,请用离子方程式表示该转化过程
③含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的
a.KOH b.
 c.
c. d.NaCl
d.NaCl写出其中一个反应的离子方程式:
(3)
 是燃油汽车尾气中的主要污染物之一。
是燃油汽车尾气中的主要污染物之一。①在催化剂和加热条件下,
 与
与 可反应生成无害物质,请写出反应的化学方程式:
可反应生成无害物质,请写出反应的化学方程式:②实验室可用烧碱溶液吸收
 和NO,(已知
和NO,(已知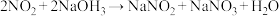 ,
,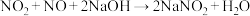 ),当消耗
),当消耗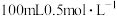 的烧碱溶液时,共吸收混合气体
的烧碱溶液时,共吸收混合气体
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
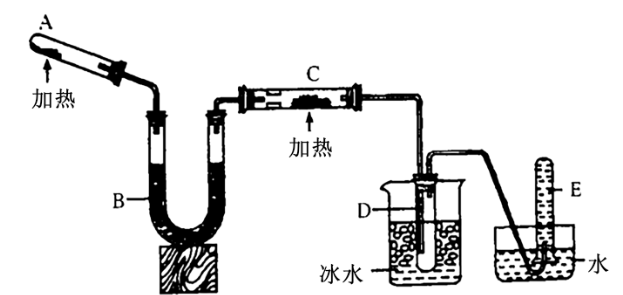
回答下列问题:
(1)A中加入的物质是___________ ,发生反应的化学方程式是___________ ;
(2)B中加入的物质是___________ ,其作用是___________ ;
(3)实验时在C中观察到的现象是___________ ,发生反应的化学方程式是___________ ;
(4)实验时在D中观察到的现象是___________ ,D中收集到的物质是___________ ,检验该物质的方法和现象是___________ 。

回答下列问题:
(1)A中加入的物质是
(2)B中加入的物质是
(3)实验时在C中观察到的现象是
(4)实验时在D中观察到的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】碳酸镧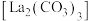 是一种用于治疗高磷血症的新型药物,实验室模拟利用碳酸氢铵溶液和氯化镧溶液反应制备水合碳酸铜
是一种用于治疗高磷血症的新型药物,实验室模拟利用碳酸氢铵溶液和氯化镧溶液反应制备水合碳酸铜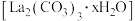 。
。
已知:① 为白色晶体,难溶于水,可溶于稀酸。
为白色晶体,难溶于水,可溶于稀酸。
②若溶液碱性太强,易生成难溶于水、受热易分解的碱式碳酸镧 。
。
Ⅰ.模拟制备水合碳酸镧,实验装置如下图所示(夹持装置已省略)。
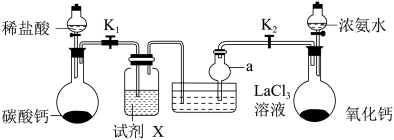
(1)试剂X是___________ ,仪器a的名称是___________ 。
(2)制备过程中浓氨水滴速不能太快,原因是___________ 。
(3)写出该实验制备 的化学方程式
的化学方程式___________ 。
Ⅱ.产品成分探究
(4)甲小组认为产品中可能混有可溶性 、
、 等杂质,请设计实验方案检验
等杂质,请设计实验方案检验 是否存在
是否存在___________ 。
(5)乙小组认为产品中可能含有难溶性碱式碳酸镧 。实验装置及步骤如图所示(夹持装置已省略)。
。实验装置及步骤如图所示(夹持装置已省略)。
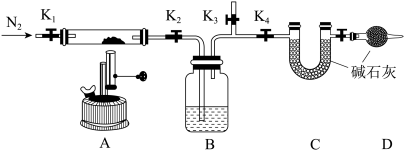
①检查装置气密性后,将已除去可溶性杂质的产品装入质量为 g的硬质石英玻璃管中。
g的硬质石英玻璃管中。
②打开 、
、 和
和 ,缓缓通入
,缓缓通入 。数分钟后关闭
。数分钟后关闭 、
、 ,打开
,打开 ,点燃酒精喷灯加热。
,点燃酒精喷灯加热。
③一段时间后停止加热,打开 ,通入
,通入 数分钟后关闭
数分钟后关闭 和
和 ,冷却到室温,称量硬质石英玻璃管。重复上述操作步骤直至恒重,记为
,冷却到室温,称量硬质石英玻璃管。重复上述操作步骤直至恒重,记为 g[此时硬质石英玻璃管中固体为
g[此时硬质石英玻璃管中固体为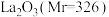 ]。称量装置C,质量增加
]。称量装置C,质量增加 g。实验中第二次通入
g。实验中第二次通入 的目的是
的目的是___________ 。根据实验数据计算,
___________ (用含 、
、 、
、 的计算式表示)。若
的计算式表示)。若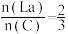 ,说明产品不含
,说明产品不含 。
。
Ⅲ.测定 元素的质量分数
元素的质量分数
丙小组称取1.000g样品,加入稀盐酸使其完全溶解后,转移至100 容量瓶并定容。每次取25.00
容量瓶并定容。每次取25.00 试样,用
试样,用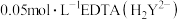 标准溶液进行滴定。(已知:
标准溶液进行滴定。(已知: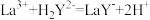 ),平行测定3次,平均每次消耗22.00
),平行测定3次,平均每次消耗22.00 。
。
(6)样品中 元素的质量分数约为
元素的质量分数约为___________ 。(保留三位有效数字)。
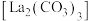 是一种用于治疗高磷血症的新型药物,实验室模拟利用碳酸氢铵溶液和氯化镧溶液反应制备水合碳酸铜
是一种用于治疗高磷血症的新型药物,实验室模拟利用碳酸氢铵溶液和氯化镧溶液反应制备水合碳酸铜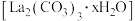 。
。已知:①
 为白色晶体,难溶于水,可溶于稀酸。
为白色晶体,难溶于水,可溶于稀酸。②若溶液碱性太强,易生成难溶于水、受热易分解的碱式碳酸镧
 。
。Ⅰ.模拟制备水合碳酸镧,实验装置如下图所示(夹持装置已省略)。

(1)试剂X是
(2)制备过程中浓氨水滴速不能太快,原因是
(3)写出该实验制备
 的化学方程式
的化学方程式Ⅱ.产品成分探究
(4)甲小组认为产品中可能混有可溶性
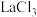 、
、 等杂质,请设计实验方案检验
等杂质,请设计实验方案检验 是否存在
是否存在(5)乙小组认为产品中可能含有难溶性碱式碳酸镧
 。实验装置及步骤如图所示(夹持装置已省略)。
。实验装置及步骤如图所示(夹持装置已省略)。
①检查装置气密性后,将已除去可溶性杂质的产品装入质量为
 g的硬质石英玻璃管中。
g的硬质石英玻璃管中。②打开
 、
、 和
和 ,缓缓通入
,缓缓通入 。数分钟后关闭
。数分钟后关闭 、
、 ,打开
,打开 ,点燃酒精喷灯加热。
,点燃酒精喷灯加热。③一段时间后停止加热,打开
 ,通入
,通入 数分钟后关闭
数分钟后关闭 和
和 ,冷却到室温,称量硬质石英玻璃管。重复上述操作步骤直至恒重,记为
,冷却到室温,称量硬质石英玻璃管。重复上述操作步骤直至恒重,记为 g[此时硬质石英玻璃管中固体为
g[此时硬质石英玻璃管中固体为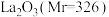 ]。称量装置C,质量增加
]。称量装置C,质量增加 g。实验中第二次通入
g。实验中第二次通入 的目的是
的目的是
 、
、 、
、 的计算式表示)。若
的计算式表示)。若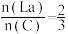 ,说明产品不含
,说明产品不含 。
。Ⅲ.测定
 元素的质量分数
元素的质量分数丙小组称取1.000g样品,加入稀盐酸使其完全溶解后,转移至100
 容量瓶并定容。每次取25.00
容量瓶并定容。每次取25.00 试样,用
试样,用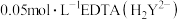 标准溶液进行滴定。(已知:
标准溶液进行滴定。(已知: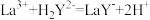 ),平行测定3次,平均每次消耗22.00
),平行测定3次,平均每次消耗22.00 。
。(6)样品中
 元素的质量分数约为
元素的质量分数约为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】以方铅矿(主要成分 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为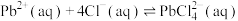
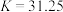
②
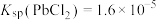
(1) 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为___________ ;“协同浸取”时加入 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是___________ 。
(2)“沉降分铅”的目的是将滤液中的 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数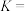
___________ 。
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是________ 。
(4)制备 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中,___________ ,真空40干燥得产品 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)
 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为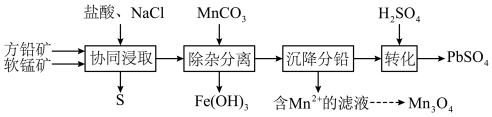
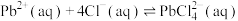
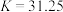
②

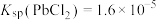
(1)
 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是(2)“沉降分铅”的目的是将滤液中的
 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数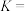
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与
 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是(4)制备
 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中, 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)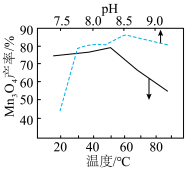
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】二氧化硫是造成空气污染的主要物质之一,对人体健康危害很大。我国已将二氧化硫列为一种主要的法规控制空气污染物,并将大气中二氧化硫的浓度水平作为评价空气质量的一项重要指标。
(1)为了实现变废为宝,某化学小组同学利用SO2与Cl2反应制取重要的有机合成试剂磺酰氯(SO2Cl2)。已知:SO2Cl2的熔点为−54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。下图装置的集气瓶G中装有干燥纯净的氯气。
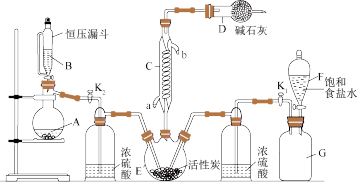
回答下列问题:
①仪器C的名称是___________ 。
②仪器D中碱石灰的作用是___________ 。
③试剂B、A的组合最好是___________ 。
a.18.4mol·L−1H2SO4+Cu b.4mol·L−1HNO3+Na2SO3 c.80%H2SO4+Na2SO3
④将G中的氯气排入E中的操作方法是___________ 。反应结束后,将装置E中混合物分离的方法是___________ 。
(2)目前通常采用滴定法测定食品中残留二氧化硫的含量。具体实验过程如下:样品经处理后,加入氢氧化钾使残留的二氧化硫以亚硫酸盐的形式固定,再加入硫酸使二氧化硫游离,用碘标准溶液滴定二氧化硫。在滴定时用___________ (填名称)作指示剂。滴定反应方程为___________ 。
(1)为了实现变废为宝,某化学小组同学利用SO2与Cl2反应制取重要的有机合成试剂磺酰氯(SO2Cl2)。已知:SO2Cl2的熔点为−54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。下图装置的集气瓶G中装有干燥纯净的氯气。

回答下列问题:
①仪器C的名称是
②仪器D中碱石灰的作用是
③试剂B、A的组合最好是
a.18.4mol·L−1H2SO4+Cu b.4mol·L−1HNO3+Na2SO3 c.80%H2SO4+Na2SO3
④将G中的氯气排入E中的操作方法是
(2)目前通常采用滴定法测定食品中残留二氧化硫的含量。具体实验过程如下:样品经处理后,加入氢氧化钾使残留的二氧化硫以亚硫酸盐的形式固定,再加入硫酸使二氧化硫游离,用碘标准溶液滴定二氧化硫。在滴定时用
您最近一年使用:0次



