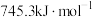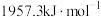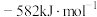AA705合金(含Al、Zn、Mg和Cu)被用于飞机机身和机翼、智能手机外壳上等。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,这样可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
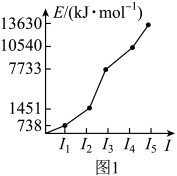
(1)第三周期某元素的前5个电子的电离能如图1所示。该元素是______ (填元素符号),判断依据是______ 。
(2)CN-、NH3、H2O和OH-等配体都能与Zn2+形成配离子。则[Zn(NH3)4]2+中心离子的配位数为______ 。
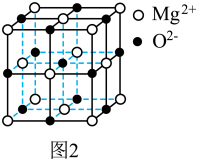
(3)氧化镁是一种熔点极高的离子晶体,结构类似NaCl,其晶胞如图2所示,该晶胞中Mg2+数目为______ ;1个O2-周围有_____ 个Mg2+最近且等距离。
(1)第三周期某元素的前5个电子的电离能如图1所示。该元素是

(2)CN-、NH3、H2O和OH-等配体都能与Zn2+形成配离子。则[Zn(NH3)4]2+中心离子的配位数为
(3)氧化镁是一种熔点极高的离子晶体,结构类似NaCl,其晶胞如图2所示,该晶胞中Mg2+数目为

更新时间:2023-04-25 08:17:50
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】铜及其化合物在生活、生产中用途广泛。回答下列问题:
(1)基态铁原子的价层电子的轨道表示式为__________ ,其原子核外电子的空间运动状态有__________ 种。
(2)高温下CuO能转化为 ,说明高温下
,说明高温下 比
比 稳定,原因是
稳定,原因是__________ 。
(3)在水溶液中 则不如
则不如 稳定,因为
稳定,因为 在水溶液中可以
在水溶液中可以 的形式存在。请结合表中信息加以解释
的形式存在。请结合表中信息加以解释__________ 。
(注:水合能指的是气态基态离子与水分子结合生成 水合离子时所释放的能量。)
水合离子时所释放的能量。)
(4)H、N、O与Cu能形成一种阳离子M,呈轴向狭长的八面体结构(如下图所示)。__________ ,加热时,M首先失去的组分分子空间结构名称为__________ 。
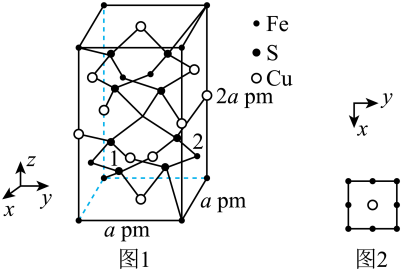
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为__________ 。晶胞参数分别为 ,
, 、
、 ,晶胞棱边夹角均为90°,该晶体的密度为
,晶胞棱边夹角均为90°,该晶体的密度为__________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
(1)基态铁原子的价层电子的轨道表示式为
(2)高温下CuO能转化为
 ,说明高温下
,说明高温下 比
比 稳定,原因是
稳定,原因是(3)在水溶液中
 则不如
则不如 稳定,因为
稳定,因为 在水溶液中可以
在水溶液中可以 的形式存在。请结合表中信息加以解释
的形式存在。请结合表中信息加以解释第一电离能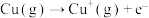 | 第二电离能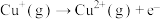 | 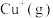 水合能( 水合能( ) ) | 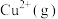 水合能( 水合能( ) ) |
|
|
|
|
 水合离子时所释放的能量。)
水合离子时所释放的能量。)(4)H、N、O与Cu能形成一种阳离子M,呈轴向狭长的八面体结构(如下图所示)。
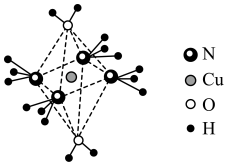
(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 ,
, 、
、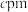 ,晶胞棱边夹角均为90°,该晶体的密度为
,晶胞棱边夹角均为90°,该晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】我国具有悠久的历史,在春秋时期已经开始冶铁,在西汉就有湿法炼铜( )。
)。
(1)基态铁原子的电子排布式为
_______ 。
(2)铁氰化钾 是检验
是检验 的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是
的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_______ ,碳原子的杂化类型是________ 。
(3) 是一种浅黄色液体,熔点
是一种浅黄色液体,熔点 ,沸点103℃,易溶于苯等有机溶剂,不溶于水。
,沸点103℃,易溶于苯等有机溶剂,不溶于水。 是
是_________ 分子(填“极性”或“非极性”)
(4)铜常见化合价为 、
、 价,高温下
价,高温下 比
比 更稳定的原因是
更稳定的原因是__________ 。
(5) 比
比 的熔点高的原因是
的熔点高的原因是_____________ 。
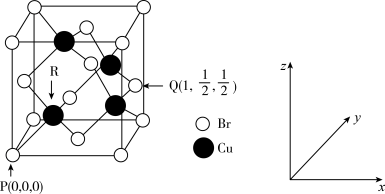
(6)一种铜的溴化物晶胞结构如图所示,由图可知,该晶体的化学式为_____________ ,与每个 紧邻的
紧邻的 有
有___________ 个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_____ 。若 原子与最近的
原子与最近的 原子的核间距为
原子的核间距为 ,则该晶体的密度计算表达式为
,则该晶体的密度计算表达式为
______  。
。
 )。
)。(1)基态铁原子的电子排布式为
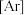
(2)铁氰化钾
 是检验
是检验 的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是
的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是(3)
 是一种浅黄色液体,熔点
是一种浅黄色液体,熔点 ,沸点103℃,易溶于苯等有机溶剂,不溶于水。
,沸点103℃,易溶于苯等有机溶剂,不溶于水。 是
是(4)铜常见化合价为
 、
、 价,高温下
价,高温下 比
比 更稳定的原因是
更稳定的原因是(5)
 比
比 的熔点高的原因是
的熔点高的原因是(6)一种铜的溴化物晶胞结构如图所示,由图可知,该晶体的化学式为
 紧邻的
紧邻的 有
有 原子与最近的
原子与最近的 原子的核间距为
原子的核间距为 ,则该晶体的密度计算表达式为
,则该晶体的密度计算表达式为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钴、钙等多种化学物质。请回答下列问题:
(1)科学家常利用_______ 区分晶体硼和无定形硼,二者之间互为_______ 。第二周期元素的第一电离能按由小到大的顺序排列,B元素排在第_______ 位,其基态能量最低的能级电子云轮廓图为_______ 。
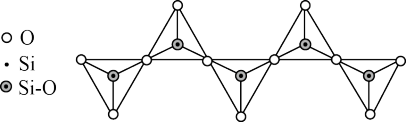
(2)硅酸根有多种结构形式,一种无限长链状结构如图所示,其化学式为_______ ,Si原子的杂化类型为_______ 。
(3)N元素位于元素周期表_______ 区;该元素形成的简单氢化物的沸点比 的沸点高,其原因为
的沸点高,其原因为_______ 。
(4) 的几何构型为正八面体形,Co在中心。
的几何构型为正八面体形,Co在中心。
① 中,1个Co提供
中,1个Co提供_______ 个空轨道。该配位离子的作用力为_______ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
②若将 中的两个
中的两个 分子换成两个
分子换成两个 可以形成
可以形成_______ 种不同的结构形式。
(1)科学家常利用
(2)硅酸根有多种结构形式,一种无限长链状结构如图所示,其化学式为

(3)N元素位于元素周期表
 的沸点高,其原因为
的沸点高,其原因为(4)
 的几何构型为正八面体形,Co在中心。
的几何构型为正八面体形,Co在中心。①
 中,1个Co提供
中,1个Co提供A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
②若将
 中的两个
中的两个 分子换成两个
分子换成两个 可以形成
可以形成
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铁、镍、铜、钇( )在医药、催化及材料等领域中应用广泛。回答下列问题:
)在医药、催化及材料等领域中应用广泛。回答下列问题:
(1) 在元素周期表中的位置为
在元素周期表中的位置为________ ,第二周期中基态原子末成对电子数与 相同且电负性最小的元素是
相同且电负性最小的元素是___________ (填元素符号)。
(2)一种某铁的配合物结构如图所示。该物质中不含有的化学键类型是________ (填标号)。

A.离子键 B.配位键 C.非极性共价键 D. 键 E.
键 E. 键
键
在 、
、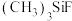 、
、 分子中,
分子中,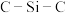 键角最大的是
键角最大的是________ 。
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
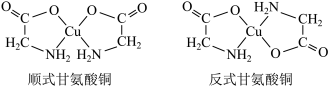
甘氨酸铜中铜原子的杂化类型为___________ (填“ ”或“
”或“ ”);
”);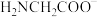 能与
能与 形成稳定的环状化合物,其原因是
形成稳定的环状化合物,其原因是___________ ;顺式甘氨酸铜在水中溶解度远大于反式甘氨酸铜,主要原因是___________ 。
(4)铁酸钇的正交相晶胞结构以及各原子的投影如图所示。
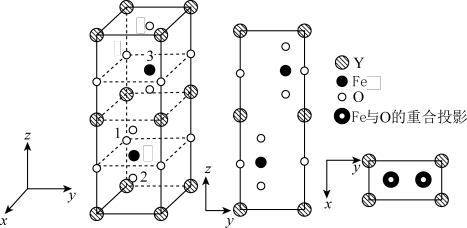
已知1号 原子分数坐标为
原子分数坐标为 ,2号
,2号 原子分数坐标为
原子分数坐标为 ,则3号
,则3号 原子的分数坐标为
原子的分数坐标为___________ ;若晶胞参数为 和
和 ,
, ,用
,用 表示阿伏伽德罗常数的值,则该晶体的密度为
表示阿伏伽德罗常数的值,则该晶体的密度为___________  (列出表达式)
(列出表达式)
 )在医药、催化及材料等领域中应用广泛。回答下列问题:
)在医药、催化及材料等领域中应用广泛。回答下列问题:(1)
 在元素周期表中的位置为
在元素周期表中的位置为 相同且电负性最小的元素是
相同且电负性最小的元素是(2)一种某铁的配合物结构如图所示。该物质中不含有的化学键类型是

A.离子键 B.配位键 C.非极性共价键 D.
 键 E.
键 E. 键
键在
 、
、 、
、 分子中,
分子中,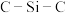 键角最大的是
键角最大的是(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

甘氨酸铜中铜原子的杂化类型为
 ”或“
”或“ ”);
”);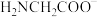 能与
能与 形成稳定的环状化合物,其原因是
形成稳定的环状化合物,其原因是(4)铁酸钇的正交相晶胞结构以及各原子的投影如图所示。

已知1号
 原子分数坐标为
原子分数坐标为 ,2号
,2号 原子分数坐标为
原子分数坐标为 ,则3号
,则3号 原子的分数坐标为
原子的分数坐标为 和
和 ,
, ,用
,用 表示阿伏伽德罗常数的值,则该晶体的密度为
表示阿伏伽德罗常数的值,则该晶体的密度为 (列出表达式)
(列出表达式)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
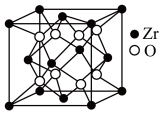
【推荐2】据世界权威刊物《自然》最近报道, 选择碲化锆 (ZrTe5)为材料验证了三维量子霍尔效应, 并发现了金属-绝缘体的转换。Te属于ⅥA元素。回答下列问题:
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是___ ,Zr2+的价电子排布图是___ 。
(2)O、Se、Te的第一电离能由大到小的顺序是___ ,H2O、H2Se、H2Te的沸点由高到低的顺序是___ 。
(3)H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是___ 。
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___ (填符号), 1个[Zr(C2H5O)2]2+离子中含共价键的数目是___ 。
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是___ 。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为___ g/cm3。
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是
(2)O、Se、Te的第一电离能由大到小的顺序是
(3)H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】硼及其化合物在新材料、工农业生产等方面用途、广泛。
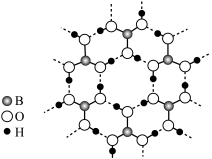
(1)写出基态B原子的轨道表达式___________ 。
(2)已知:硼酸的电离方程式可表示为H3BO3+H2O⇌[B(OH)4]-+H+。
①根据以上信息,下列说法正确的是_________ 。(填序号)
a.硼酸是一元酸
b.硼酸在电离的过程中,B原子的杂化类型发生了变化
c.硼酸与过量NaOH反应,能观察到白色沉淀逐渐消失
②从化学键的角度表述由H3BO3,形成[B(OH)4]-的过程__________ 。
(3)B与N可以形成不同类型的晶体,如六方氮化硼、立方氮化硼等,其结构如图。
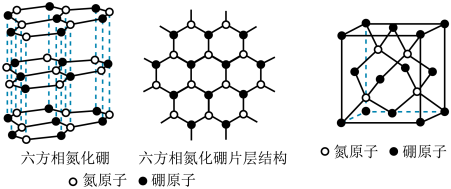
①六方氮化硼的晶体结构类似石墨,每一个B或N的杂化类型是__________ 。
②立方氮化硼因其硬度高、耐磨性好,在机械加工行业广泛用作切削工具。立方氮化硼可在高温高压的条件下由六方氮化硼转化而成。如图,立方氮化硼的晶体类型为___________ ,立方氮化硼的密度为dg⋅cm-3,阿伏加德罗常数为NA,B与N的相对原子质量分别为m和n,则立方晶胞边长a=______________ cm。

(1)写出基态B原子的轨道表达式
(2)已知:硼酸的电离方程式可表示为H3BO3+H2O⇌[B(OH)4]-+H+。
①根据以上信息,下列说法正确的是
a.硼酸是一元酸
b.硼酸在电离的过程中,B原子的杂化类型发生了变化
c.硼酸与过量NaOH反应,能观察到白色沉淀逐渐消失
②从化学键的角度表述由H3BO3,形成[B(OH)4]-的过程
(3)B与N可以形成不同类型的晶体,如六方氮化硼、立方氮化硼等,其结构如图。

①六方氮化硼的晶体结构类似石墨,每一个B或N的杂化类型是
②立方氮化硼因其硬度高、耐磨性好,在机械加工行业广泛用作切削工具。立方氮化硼可在高温高压的条件下由六方氮化硼转化而成。如图,立方氮化硼的晶体类型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的 洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了 、
、 、
、 、C等多种元素。请回答:
、C等多种元素。请回答:
(1)铁位于元素周期表中_______ 列,基态 的核外简化电子排布式为
的核外简化电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 晶体。
(3)实验室常用 溶液检验
溶液检验 。
。
①与 互为等电子体的非极性分子的化学式为
互为等电子体的非极性分子的化学式为_______ 。
② 中碳原子杂化类型为
中碳原子杂化类型为_______ 。
(4)配位化合物 中心原子
中心原子 的配位数为
的配位数为_______ ,配位原子为_______ 。 中含
中含 键
键_______  。
。
(5)已知 可以形成多种氧化物,其中一种
可以形成多种氧化物,其中一种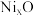 晶体的晶胞结构为
晶体的晶胞结构为 型(
型( 晶胞如下图),由于晶体缺陷导致
晶胞如下图),由于晶体缺陷导致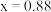 ,晶胞参数为
,晶胞参数为 ,则晶体密度为
,则晶体密度为_______  (
( 表示阿伏加德罗常数的值,只需列出计算式)。
表示阿伏加德罗常数的值,只需列出计算式)。
 洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了 、
、 、
、 、C等多种元素。请回答:
、C等多种元素。请回答:(1)铁位于元素周期表中
 的核外简化电子排布式为
的核外简化电子排布式为(2)
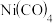 常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测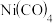 是
是(3)实验室常用
 溶液检验
溶液检验 。
。①与
 互为等电子体的非极性分子的化学式为
互为等电子体的非极性分子的化学式为②
 中碳原子杂化类型为
中碳原子杂化类型为(4)配位化合物
 中心原子
中心原子 的配位数为
的配位数为 中含
中含 键
键 。
。(5)已知
 可以形成多种氧化物,其中一种
可以形成多种氧化物,其中一种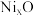 晶体的晶胞结构为
晶体的晶胞结构为 型(
型( 晶胞如下图),由于晶体缺陷导致
晶胞如下图),由于晶体缺陷导致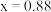 ,晶胞参数为
,晶胞参数为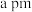 ,则晶体密度为
,则晶体密度为 (
( 表示阿伏加德罗常数的值,只需列出计算式)。
表示阿伏加德罗常数的值,只需列出计算式)。
您最近一年使用:0次
【推荐2】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_______ 。
(2)硫酸镍溶于氨水形成 [Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_______ 。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是_______ 。
③氨的沸点_______ (填“高于”或“低于”)膦(PH3),原因是_______ ;氨是分子_______ (填“极性”或“非极性”),中心原子的轨道杂化类型为_______ 。
(3)单质铜及镍都是由_______ 键形成的晶体;元素铜与镍的第二电离能分别为: ICu=1958 kJ·mol–1、INi=1 753 kJ·mol–1, ICu> INi的原因是_______ 。
(4)某镍白铜合金的立方晶胞结构如图所示。
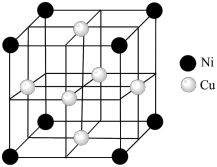
①晶胞中铜原子与镍原子的数量比为_______ 。
②若合金的密度为d g·cm–3,晶胞参数a=_______ nm。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成 [Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是
③氨的沸点
(3)单质铜及镍都是由
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为
②若合金的密度为d g·cm–3,晶胞参数a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】自然界中存在大量的金属元素,对工农业生产有重要的价值。
(1)NaF的熔点是995℃,而SiF4的熔点为-90.2℃,试分析原因_______ 。
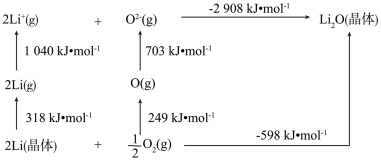
(2)Li2O是离子晶体,如图可知Li原子的第一电离能为_______ kJ/mol,O=O键的键能为_______ kJ/mol。
(3)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成的。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是_______ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;该晶胞中粒子个数比Hg:Ge:Sb=_______ 。
③设X的最简式的摩尔质量为Mr,则X晶体的密度为_______ g/cm3(列出算式)。
(1)NaF的熔点是995℃,而SiF4的熔点为-90.2℃,试分析原因
(2)Li2O是离子晶体,如图可知Li原子的第一电离能为

(3)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成的。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
③设X的最简式的摩尔质量为Mr,则X晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
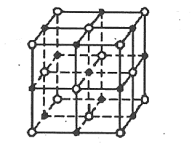
【推荐1】第Ⅷ族元素 Fe、Co、Ni 性质相似,称为铁系元素,主要用于制造合金。
(1)基态Co 原子核外电子排布式_________
(2)Fe3+与酚类物质的显色反应常用于其离子检验,已知 Fe3+遇邻苯二酚(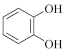 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚
)均显绿色。邻苯二酚的熔沸点比对苯二酚___________ (填“高”或“低”),原因是_________
(3)有历史记载的第一个配合物是 Fe4[Fe(CN)6]3(普鲁士蓝),1mol该配合物中含有的σ键数目为___________ ;下表为 Co2+、Ni2+不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,Ni2+比较稳定的配离子配位数是___________ (填“4”或“6”)。
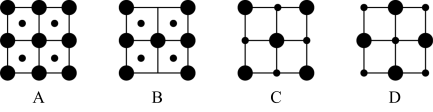
(4)NiO 晶体结构中阴阳离子的配位数均为 6,则晶胞的俯视图可能是___________ (填选项字母)。
(1)基态Co 原子核外电子排布式
(2)Fe3+与酚类物质的显色反应常用于其离子检验,已知 Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚
)均显绿色。邻苯二酚的熔沸点比对苯二酚(3)有历史记载的第一个配合物是 Fe4[Fe(CN)6]3(普鲁士蓝),1mol该配合物中含有的σ键数目为
| 离子 | Co2+ | Ni2+ | ||
| 配位数 | 6 | 4 | 6 | 4 |
| 晶体场稳定化能(Dq) | -8Dq+2p | -5.34Dq+2p | -12Dq+3p | -3.56Dq+3p |
(4)NiO 晶体结构中阴阳离子的配位数均为 6,则晶胞的俯视图可能是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出A 在基态时的外围电子排布式为______________ 。
(2)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。水分子中心原子价层电子对数为_______ ,苯分子中碳原子的杂化类型为________ 。
(3)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+ 等。铑(Rh)与钴属于同族元素,某些性质相似。现有铑的某盐组成为CsRh(SO4)2·4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成。该盐中铑离子的配位数为____ 。
(1)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出A 在基态时的外围电子排布式为
(2)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。水分子中心原子价层电子对数为
(3)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+ 等。铑(Rh)与钴属于同族元素,某些性质相似。现有铑的某盐组成为CsRh(SO4)2·4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成。该盐中铑离子的配位数为
您最近一年使用:0次
【推荐3】如图是元素周期表的一部分,图中所列的字母分别代表某一化学元素.________ 组元素的单质可能都是电的良导体
a.③⑤⑨ b.②④⑦ c.⑥⑧⑩
(2)元素⑩的外围电子排布式为__________ ,其通过面心立方堆积形成晶体的晶胞结构如图所示,则每个原子的配位数为_____ ,每个晶胞中实际包含的原子数为__________ ;__________ ;
(4)元素①和元素③形成的一种化合物是优良的有机溶剂,其相对分子质量为114,分子中只有1种不同化学环境的氢原子,则该化合物的结构简式为____________ ;
(5)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.
原子失去核外不同电子所需的能量/(kJ∙mol-1)
Y可能为图中10种元素中的_______ (填字母).
(6)一种锆氧化合物晶胞如图所示,则该氧化物的化学式为______________ .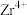 离子在晶胞中的配位数是
离子在晶胞中的配位数是______________ 。

a.③⑤⑨ b.②④⑦ c.⑥⑧⑩
(2)元素⑩的外围电子排布式为
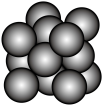
(4)元素①和元素③形成的一种化合物是优良的有机溶剂,其相对分子质量为114,分子中只有1种不同化学环境的氢原子,则该化合物的结构简式为
(5)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.
原子失去核外不同电子所需的能量/(kJ∙mol-1)
| 元素 | 锂 | X | Y |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | — | 9550 | 11600 |
(6)一种锆氧化合物晶胞如图所示,则该氧化物的化学式为
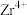 离子在晶胞中的配位数是
离子在晶胞中的配位数是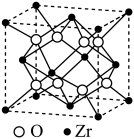
您最近一年使用:0次