干冰(固态二氧化碳)在﹣78℃时可直接升华为气体,其晶胞结构如下图所示。下列说法不正确 的是


| A.CO2中有C=O键,中心原子C是sp2杂化 |
| B.每个晶胞中含有4个CO2分子 |
| C.每个CO2分子周围有12个紧邻CO2分子 |
| D.干冰升华时需克服分子间作用力 |
2023·北京东城·模拟预测 查看更多[6]
陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(一)化学试题2023年北京市第五十五中学高三上学期保温卷化学试卷北京市第二十中学2023-2024学年高三上学期12月月考化学试题(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)考点巩固卷06 物质结构与性质(4大考点55题)-2024年高考化学一轮复习考点通关卷(新高考通用)北京市第五十五中学2023届高三保温卷化学试题
更新时间:2023-06-02 09:47:08
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】下列说法正确的是
| A.凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体 |
| B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
| C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 |
| D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】下列描述正确的是
① 为V形的极性分子;
为V形的极性分子;
② 的空间构型为平面三角形;
的空间构型为平面三角形;
③ 中有6对完全相同的成键电子对
中有6对完全相同的成键电子对
④ 和
和 的中心原子均为
的中心原子均为 杂化;
杂化;
⑤ 分子中既含
分子中既含 键又含
键又含 键;
键;
⑥ 的键角小于
的键角小于 的键角
的键角
①
 为V形的极性分子;
为V形的极性分子;②
 的空间构型为平面三角形;
的空间构型为平面三角形;③
 中有6对完全相同的成键电子对
中有6对完全相同的成键电子对④
 和
和 的中心原子均为
的中心原子均为 杂化;
杂化;⑤
 分子中既含
分子中既含 键又含
键又含 键;
键;⑥
 的键角小于
的键角小于 的键角
的键角| A.①②③④⑥ | B.②③④ | C.③④⑤⑥ | D.①④⑧ |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐3】对H3O+的说法正确的是
| A.离子中无配位键 | B.O原子采取sp3杂化 |
| C.离子中配体为O原子 | D.H3O+中有2个σ键 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】氮、氧分别是空气中和地壳中含量最多的两种元素。下列说法正确的是
| A.电负性:N>O | B.活泼性: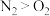 |
| C.第一电离能:N>O | D.熔沸点: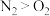 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示(一个小黑点代表一个C60分子),下列说法正确的是


| A.C60摩尔质量是720 |
| B.C60与金刚石都是碳元素形成的单质分子 |
| C.在C60晶胞中有14个C60分子 |
| D.每个C60分子周围与它距离最近等距离的C60分子有12个 |
您最近一年使用:0次



