人体必需的一些元素在周期表中的分布情况如图:
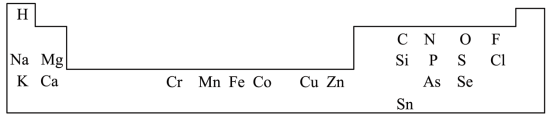
(1)请写出 Si 在周期表的位置_______
(2)S 、Cl 、K 元素对应的简单离子半径由小到大的顺序_______ (用离子符号表示)
(3)锡(Sn)与 C 为同一主族元素,Sn 原子比 C 原子多三个电子层, 则 Sn 的原子序数为_______
(4)X 射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是_______ (填字母)
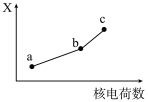
(5)前四周期同族元素的某种性质 X 随核电荷数的变化趋势如图所示, 则下列说法正确的是_______
(6)铬是胰岛素不可缺少的辅助成分,但食用不当也会带来很大的危害。六价铬的化合物有剧毒,所以要对 Cr(Ⅵ)(罗马数字表示元素的化合价, 下同)废水进行化学处理,可转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气 (氧化部分Fe2+ )并加入 NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气 (氧化部分Fe2+ )并加入 NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出CrO 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:_______
②若处理含 1molCrO (不考虑其他含铬微粒)的污水时恰好消耗 10molFeSO4,则当铁铬氧体中n (Fe2+):n(Fe3+ )=3:2 时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10molFeSO4,则当铁铬氧体中n (Fe2+):n(Fe3+ )=3:2 时,铁铬氧体的化学式为_______

(1)请写出 Si 在周期表的位置
(2)S 、Cl 、K 元素对应的简单离子半径由小到大的顺序
(3)锡(Sn)与 C 为同一主族元素,Sn 原子比 C 原子多三个电子层, 则 Sn 的原子序数为
(4)X 射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是
| A | B | C | D |
| HCl |  | CO2 |  |
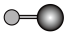 | 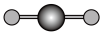 | 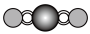 | 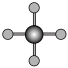 |
| 直线形 | 直线形 | 直线形 | 平面正方形 |

| A.若 a、b 、c 表示碱金属元素, 则 X 表示对应单质的密度 |
| B.若 a 、b 、c 表示卤族元素, 则 X 表示对应简单离子的还原性 |
| C.若 a 、b 、c 表示氧族元素, 则 X 表示对应氢化物的稳定性 |
| D.若 a、b 、c 表示第ⅡA 族元素,则 X 表示最高价氧化物对应水化物的碱性 |
 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气 (氧化部分Fe2+ )并加入 NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气 (氧化部分Fe2+ )并加入 NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出CrO
 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:②若处理含 1molCrO
 (不考虑其他含铬微粒)的污水时恰好消耗 10molFeSO4,则当铁铬氧体中n (Fe2+):n(Fe3+ )=3:2 时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10molFeSO4,则当铁铬氧体中n (Fe2+):n(Fe3+ )=3:2 时,铁铬氧体的化学式为
更新时间:2023-06-07 20:12:48
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】按要求填空:
(1)FeO·Cr2O3+NaNO3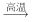 Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________ ,该反应的氧化产物为_____________ ,该步骤不能使陶瓷容器,用反应式说明:_________ 。
(2)完成下列反应_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:_______________ 。
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是________ 。
(5)用离子反应方程式表示泡沫灭火器的反应原理:__________________ 。
(1)FeO·Cr2O3+NaNO3
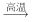 Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为(2)完成下列反应
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是
(5)用离子反应方程式表示泡沫灭火器的反应原理:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。
(1)某校科研人员利用 溶液实现“碳捕获”的技术的装置如图:
溶液实现“碳捕获”的技术的装置如图:
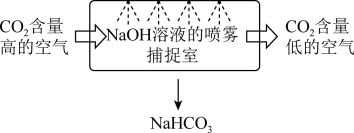
①在整个“捕捉”过程中,发生的离子反应方程式_______ ,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为________ 。
②下列溶液中,同样能用于“捕捉”二氧化碳的是_________ (填序号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(2)科学家提出用 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C.用
制取C.用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C.已知第二步反应为:
制取C.已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为___________ 。
(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原 制
制 。则每生成
。则每生成 (标准状况下)
(标准状况下) 的过程中电子转移的物质的量为
的过程中电子转移的物质的量为___________ 。
(4)科研人员发现 捕获和转化还可以通过如下途径实现,其原理如图所示。
捕获和转化还可以通过如下途径实现,其原理如图所示。
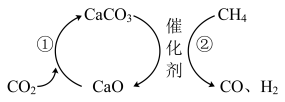
请用必要的化学用语和文字描述上述捕获和转化过程:___________ 。
(1)某校科研人员利用
 溶液实现“碳捕获”的技术的装置如图:
溶液实现“碳捕获”的技术的装置如图:
①在整个“捕捉”过程中,发生的离子反应方程式
 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为②下列溶液中,同样能用于“捕捉”二氧化碳的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液(2)科学家提出用
 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C.用
制取C.用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C.已知第二步反应为:
制取C.已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原
 制
制 。则每生成
。则每生成 (标准状况下)
(标准状况下) 的过程中电子转移的物质的量为
的过程中电子转移的物质的量为(4)科研人员发现
 捕获和转化还可以通过如下途径实现,其原理如图所示。
捕获和转化还可以通过如下途径实现,其原理如图所示。
请用必要的化学用语和文字描述上述捕获和转化过程:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】认识氧化物的性质,能帮助我们更好地认识自然和保护环境。
(1)摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
①Si在元素周期表中的位置是____ 。
②根据用途推测SiO2在水中的溶解性:____ (填“易溶”或“难溶”)。
③比较酸性强弱:H2SO4____ (填“>”或“<”)H2SiO3。
(2)SO2和NO2的任意排放均会污染环境。
①从物质分类角度看,SO2属于酸性氧化物,能与NaOH溶液反应生成亚硫酸盐。写出SO2与过量的NaOH溶液反应的离子方程式:____ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。则反应SO2+Br2+2H2O=H2SO4+2HBr中体现了SO2的____ (填“氧化性”或“还原性”)。
③NO2是一种____ 色的有毒气体,易溶于水,与水反应有无色气体生成,写出NO2与水反应的化学方程式:____ ,反应中每生成标准状况下的气体2.24L,则转移电子的物质的量为____ mol。
(1)摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
①Si在元素周期表中的位置是
②根据用途推测SiO2在水中的溶解性:
③比较酸性强弱:H2SO4
(2)SO2和NO2的任意排放均会污染环境。
①从物质分类角度看,SO2属于酸性氧化物,能与NaOH溶液反应生成亚硫酸盐。写出SO2与过量的NaOH溶液反应的离子方程式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。则反应SO2+Br2+2H2O=H2SO4+2HBr中体现了SO2的
③NO2是一种
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
(1)上述标出的8种元素中金属性最强的是______ ,非金属性最强的是______ 。(填元素符号)
(2)e元素名称为______ ,位于第______ 周期______ 族。
(3)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式______ 。
(4)g 和e形成的化合物g2e2是______ 化合物(填“离子”或“共价”),其电子式为______ 。
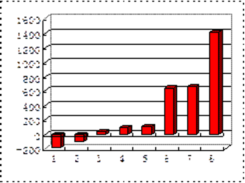
(5)如图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表Si,则其中柱形“2”代表______ 。(填化学式)
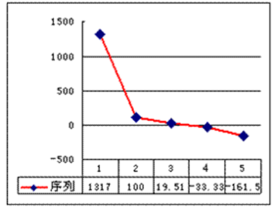
(6)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(如图),序列“5”的氢化物的名称是______ ,序列“2”的氢化物的结构式为______ 。
| a | |||||||
| b | c | d | e | f | |||
| g | h |
(2)e元素名称为
(3)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式
(4)g 和e形成的化合物g2e2是
(5)如图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表Si,则其中柱形“2”代表

(6)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(如图),序列“5”的氢化物的名称是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】下表为部分短周期元素在元素周期表中的位置,回答下列问题
(1)写出由①、④两种元素形成的既含极性键又含非极性键的一种化合物的化学式______ ;
由①、③、⑧三种元素形成的一种离子化合物的电子式_______________ 。
(2)工业上制备元素⑥单质的方程式为_________________________________ 。
(3)①、②两种元素形成的离子化合物中,两种简单离子的半径大小_____________ (用微粒符号表示);用一个化学反应方程式表示元素⑧的非金属性强于元素⑦_________________ 。
(4)常温下,将元素⑧的单质通入⑤的最高价氧化物的水溶液中,两者恰好反应,此时溶液中离子浓度由大到小的顺序是____________________________ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
由①、③、⑧三种元素形成的一种离子化合物的电子式
(2)工业上制备元素⑥单质的方程式为
(3)①、②两种元素形成的离子化合物中,两种简单离子的半径大小
(4)常温下,将元素⑧的单质通入⑤的最高价氧化物的水溶液中,两者恰好反应,此时溶液中离子浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】如表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题:
(1)元素③的原子结构示意图是___________ ,以上元素的最高价氧化物形成的水化物酸性最强的是___________ (填分子式)。
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序排列为___________ (用离子符号表示);②、③两种元素的最高价氧化物对应的水化物碱性由弱到强的顺序是___________ (用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为___________ 。
(4)②和⑦按原子个数比1∶1形成离子化合物的电子式___________ 。
(5)设计一个实验比较②与③的金属性强弱___________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 二 | ① | ⑦ | ||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序排列为
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为
(4)②和⑦按原子个数比1∶1形成离子化合物的电子式
(5)设计一个实验比较②与③的金属性强弱
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】无机物可根据其组成和性质进行分类。现有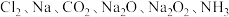 六种物质,完成下列填空:
六种物质,完成下列填空:
(1)由分子构成的单质是
(2)既有离子键又有共价键的物质的电子式为
(3)上述化合物中组成元素的原子半径由大到小的顺序是
(4)
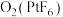 是离子化合物,其中
是离子化合物,其中 为
为 价。正确判断是___________。
价。正确判断是___________。| A.常温下为固体 | B.不存在共价键 | C.属于极性分子 | D.由 构成 构成 |
您最近一年使用:0次
【推荐2】第ⅢA元素也称为硼族元素,除硼外其余均为金属元素。硼的应用非常广泛,可用于原子反应堆和高温技术,甚至可用来制作火箭中所用的某些结构材料。
(1)硼元素位于元素周期表第__________ 周期。铝与氢氧化钠溶液反应的离子方程式为_________________________ 。
(2)氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂(主要成分为Na2B4O7·10H2O)为起始物,经过一系列反应可以得到BN、B和BF3等。

①反应a的化学方程式为________ ,为了加快反应a的化学反应速率可采取的措施有_____________ (回答一条即可)。
②生成BN的化学反应_________ (填“是”或“不是”)氧化还原反应。
③由B2O3制硼时所得到的产品不纯,主要含有的杂质为____________ 。
(3)有一类硼烷形似鸟巢,故称为巢式硼烷,如下有三种巢式硼烷的结构:
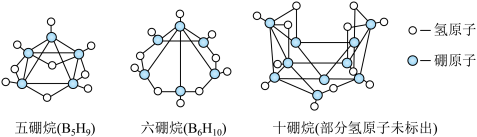
①根据五硼烷和六硼烷的化学式,推测十硼烷的化学式为_____________ 。
②已知:B6H10+O2→B2O3+H2O(未配平),每1 mol B6H10完全燃烧时转移__________ mol电子。
(4)NaBH4被称为“万能还原剂”,近年来常用NaBH4与过氧化氢构建一种新型碱性电池,如图所示;则该电池放电时的负极反应式为___________ ,正极附近溶液的pH会___________ 。(填“增大”、“减小”或“不变”)。
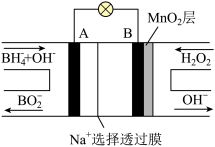
(1)硼元素位于元素周期表第
(2)氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂(主要成分为Na2B4O7·10H2O)为起始物,经过一系列反应可以得到BN、B和BF3等。

①反应a的化学方程式为
②生成BN的化学反应
③由B2O3制硼时所得到的产品不纯,主要含有的杂质为
(3)有一类硼烷形似鸟巢,故称为巢式硼烷,如下有三种巢式硼烷的结构:

①根据五硼烷和六硼烷的化学式,推测十硼烷的化学式为
②已知:B6H10+O2→B2O3+H2O(未配平),每1 mol B6H10完全燃烧时转移
(4)NaBH4被称为“万能还原剂”,近年来常用NaBH4与过氧化氢构建一种新型碱性电池,如图所示;则该电池放电时的负极反应式为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】下表是元素周期表的一部分,针对表中的①~⑩十种元素,填写下列空白:
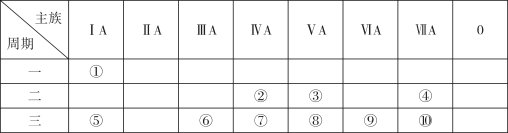
(1)形成化合物种类最多的元素的原子结构示意图为_____________ ,该元素有多种核素,其中一种考古时用于测定文物年代,请写出其原子符号____________ 。
(2)③⑤⑦三种元素的单质中,熔点最高的是____________ (写化学式),元素⑨的气态氢化物的电子式为____________ ,将⑩的单质通入该氢化物的水溶液中,发生反应的离子方程式为____________ 。
(3)这十种元素中,非金属性最强的元素为____________ (写元素符号);⑧⑨⑩三种元素的最高价氧化物对应的水化物中,酸性最弱的是____________ (写化学式)。
(4)⑤⑨⑩三种元素的简单离子半径,由大到小依次为____________ (写离子符号)。
(5)1889年,门捷列夫获得用元素⑥的单质制成的奖杯,以表彰其编制化学元素周期表的贡献。这种单质当时无比珍贵,如今已广泛使用。现在工业上冶炼该单质的化学方程式____________ 。

(1)形成化合物种类最多的元素的原子结构示意图为
(2)③⑤⑦三种元素的单质中,熔点最高的是
(3)这十种元素中,非金属性最强的元素为
(4)⑤⑨⑩三种元素的简单离子半径,由大到小依次为
(5)1889年,门捷列夫获得用元素⑥的单质制成的奖杯,以表彰其编制化学元素周期表的贡献。这种单质当时无比珍贵,如今已广泛使用。现在工业上冶炼该单质的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】用元素符号回答原子序数11-18的元素的有关问题:(填对应物质的化学式)。
(1)最高价氧化物的水化物碱性最强的是___ ,其电子式为:___ 。
(2)最高价氧化物的水化物呈两性的是___ ,该两性物质与KOH反应的离子反应方程式是____ 。
(3)最高价氧化物对应水化物酸性最强的是___ ,气态氢化物最稳定的是___ ,15号至17号简单阴离子半径最小的是(填离子符号)____ 。
(1)最高价氧化物的水化物碱性最强的是
(2)最高价氧化物的水化物呈两性的是
(3)最高价氧化物对应水化物酸性最强的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】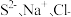 三种微粒的半径从小到大的顺序是
三种微粒的半径从小到大的顺序是___________ 。
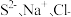 三种微粒的半径从小到大的顺序是
三种微粒的半径从小到大的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】硅材料在生活中占有重要地位。请回答:
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为___________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①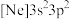 、②
、②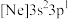 、③
、③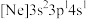 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________ ,该化合物的化学式为___________ 。
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为
(2)由硅原子核形成的三种微粒,电子排布式分别为:①
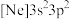 、②
、②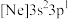 、③
、③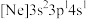 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是

您最近一年使用:0次



