从废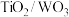 纳米薄膜中回收钛和钨等稀缺金属,既有利于资源综合利用,又避免污染环境。回收的工艺流程如下:
纳米薄膜中回收钛和钨等稀缺金属,既有利于资源综合利用,又避免污染环境。回收的工艺流程如下:

已知:
Ⅰ.乙胺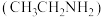 是无色极易挥发的液体,呈碱性,能与酸发生反应:
是无色极易挥发的液体,呈碱性,能与酸发生反应: 。
。
Ⅱ.酸性条件下,乙胺萃取 的反应为
的反应为 。
。
Ⅲ. 易溶于水,属于强电解质。偏钛酸难溶于水,其化学式可表示为
易溶于水,属于强电解质。偏钛酸难溶于水,其化学式可表示为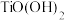 或
或 ,室温时
,室温时 。
。
回答下列问题:
(1)“碱浸”时发生反应的化学方程式为___________ 。“萃取”前,需要将“滤液I”的 调整到3.5左右,目的是
调整到3.5左右,目的是___________ 。
(2)试剂a为________ (写名称)。“反萃取”过程中发生反应的化学方程式为___________ 。
(3)检验“过滤Ⅱ”所得 已洗涤干净的方法是
已洗涤干净的方法是___________ 。
(4)室温下测得“滤液Ⅲ”的 ,则此时“滤液Ⅲ”中
,则此时“滤液Ⅲ”中
___________  。
。
(5) 与
与 同周期,
同周期, 、
、 、
、 可形成一种具有特殊导电性的晶体(化学式为
可形成一种具有特殊导电性的晶体(化学式为 ,
, 、
、 为整数),其立方晶胞如图所示,
为整数),其立方晶胞如图所示, 与
与 最小间距大于
最小间距大于 与
与 最小间距。
最小间距。

该晶体中,1个 周围与其最近的
周围与其最近的 的个数为
的个数为___________ 。
②若 与
与 最小间距为
最小间距为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
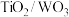 纳米薄膜中回收钛和钨等稀缺金属,既有利于资源综合利用,又避免污染环境。回收的工艺流程如下:
纳米薄膜中回收钛和钨等稀缺金属,既有利于资源综合利用,又避免污染环境。回收的工艺流程如下:
已知:
Ⅰ.乙胺
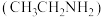 是无色极易挥发的液体,呈碱性,能与酸发生反应:
是无色极易挥发的液体,呈碱性,能与酸发生反应: 。
。Ⅱ.酸性条件下,乙胺萃取
 的反应为
的反应为 。
。Ⅲ.
 易溶于水,属于强电解质。偏钛酸难溶于水,其化学式可表示为
易溶于水,属于强电解质。偏钛酸难溶于水,其化学式可表示为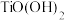 或
或 ,室温时
,室温时 。
。回答下列问题:
(1)“碱浸”时发生反应的化学方程式为
 调整到3.5左右,目的是
调整到3.5左右,目的是(2)试剂a为
(3)检验“过滤Ⅱ”所得
 已洗涤干净的方法是
已洗涤干净的方法是(4)室温下测得“滤液Ⅲ”的
 ,则此时“滤液Ⅲ”中
,则此时“滤液Ⅲ”中
 。
。(5)
 与
与 同周期,
同周期, 、
、 、
、 可形成一种具有特殊导电性的晶体(化学式为
可形成一种具有特殊导电性的晶体(化学式为 ,
, 、
、 为整数),其立方晶胞如图所示,
为整数),其立方晶胞如图所示, 与
与 最小间距大于
最小间距大于 与
与 最小间距。
最小间距。
该晶体中,1个
 周围与其最近的
周围与其最近的 的个数为
的个数为②若
 与
与 最小间距为
最小间距为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
更新时间:2023-08-08 16:49:51
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】金属钛(Ti)及化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是___________ ,其电子占据最高能级的电子云轮廓图是___________
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是___________ ,它们的第二电离能(I2)分别为3051kJ/mol、1310kJ/mol,其原因是___________ 。
(3)钛与卤素形成的化合物TiX4熔点如下表
它们熔点差异的原因___________
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为___________ ,与Ti形成配位键的元素是___________ ,碳碳键类型是___________ ;所含非金属元素的含氧酸根离子中心原子杂化轨道类型是sp2的是___________ 、立体构型是V形的是___________
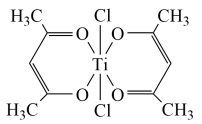
(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=___________ g/cm3(阿伏加德罗常数值为NA,N、Ti的相对原子质量分别用Ar(N)和Ar(Ti)表示)

(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是
(3)钛与卤素形成的化合物TiX4熔点如下表
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点℃ | 377 | -24 | 38.3 | 153 |
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为

(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】一种从分银渣(含CuO、 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下:
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。
Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
回答下列问题:
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:___________________ 。
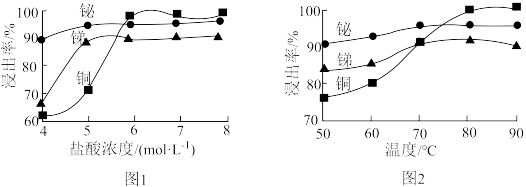
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。______ ;浸出时温度以80℃为宜,其原因是_____________________ 。
(3)①已知“滤渣2”的主要成分是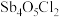 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为________ 。
②已知“滤渣3”的主要成分是BiOCl和 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是______ 。
(4)“滤渣1”中的AgCl可用硫酸-硫脲(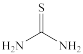 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:________________ ;该配合物中不存在__________ (填标号)。
A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:_________________ 。
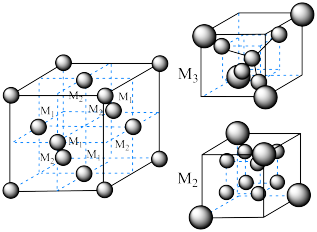
(6)尖晶石属于立方晶系,其晶胞可视为 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型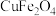 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为________  。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下: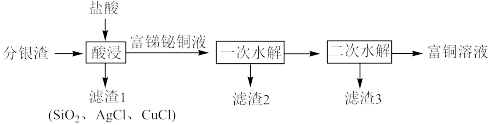
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含
 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
金属离子 |
|
|
|
|
开始沉淀时( | 0.5 | 1.5 | 4.7 | 1.5 |
完全沉淀时( | 1.4 | 2.5 | 6.7 | 3.2 |
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。
(3)①已知“滤渣2”的主要成分是
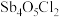 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为②已知“滤渣3”的主要成分是BiOCl和
 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是(4)“滤渣1”中的AgCl可用硫酸-硫脲(
 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:
(6)尖晶石属于立方晶系,其晶胞可视为
 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型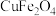 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为 。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】碳、氮、铜形成的单质及它们形成的化合物有重要研究和应用价值,回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①基态Cu原子的价电子轨道表达式为_______ ,在元素周期表中铜位于_______ 区(填“s”“p”“d”或“ds”)。
②C、N、O三种元素的第一电离能由大到小的顺序为_______ 。
③邻氨基吡啶的铜配合物中,Cu2+的配位数是_______ ,N原子的杂化类型为_______ 。
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是_______ 。
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为_______ (填“极性键”“非极性键”)。
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。
①图a中原子坐标参数分别为:A(0,0,0),B( ,
, ,0),C(
,0),C( ,0,
,0, ),则D的原子坐标参数为
),则D的原子坐标参数为_______ 。

②图b为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为_______ g·cm-3(用含R、NA的式子表示)

(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①基态Cu原子的价电子轨道表达式为
②C、N、O三种元素的第一电离能由大到小的顺序为
③邻氨基吡啶的铜配合物中,Cu2+的配位数是
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。
①图a中原子坐标参数分别为:A(0,0,0),B(
 ,
, ,0),C(
,0),C( ,0,
,0, ),则D的原子坐标参数为
),则D的原子坐标参数为
②图b为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
(1)最适合作氧化剂X的是__________ ,。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是_______________ 。
(3)加入的物质Y是___ (写化学式),目的是调节溶液的pH。根据信息,溶液的pH范围应为___ 。
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=_______
(5)结合方程式和必要文字说明解释不能将溶液III直接蒸发结晶得到CuCl2·2H2O晶体的原因_____ 。
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有_______ 。

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 4 | 9.0 | 6.7 |
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是
(3)加入的物质Y是
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=
(5)结合方程式和必要文字说明解释不能将溶液III直接蒸发结晶得到CuCl2·2H2O晶体的原因
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
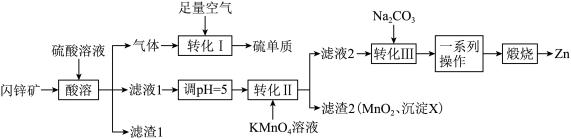
【推荐2】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:
请回答下列问题:
(1)滤渣1的化学式为_______ ,
(2)沉淀X的化学式为______________ 。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________ 。
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为__________________ 。

请回答下列问题:
(1)滤渣1的化学式为
(2)沉淀X的化学式为
(3)“转化Ⅱ”中主要反应的离子方程式为
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用。
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
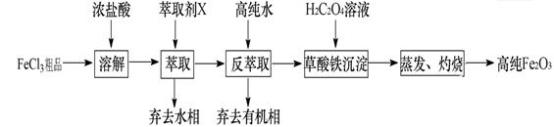
已知:HCl(浓)+ FeCl3 HFeCl4。试回答下列问题:
HFeCl4。试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
① Ca2+、Mn2+、Cu2+等杂质离子主要在__________ (填“水”或“有机”)相。
② 若实验时共用萃取剂X 150mL,萃取率最高的方法是__________ (填字母)。
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是________________ (写化学式);反萃取能发生的原因是___________________ 。
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是________________ 。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式___________________ 。
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式____________ 。
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=__________ 。(结果保留小数点后2位)
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:

已知:HCl(浓)+ FeCl3
 HFeCl4。试回答下列问题:
HFeCl4。试回答下列问题:(1)用萃取剂X萃取,该步骤中:
① Ca2+、Mn2+、Cu2+等杂质离子主要在
② 若实验时共用萃取剂X 150mL,萃取率最高的方法是
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=
您最近一年使用:0次

 )的pH
)的pH )的pH
)的pH

