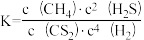对于反应2NO(g)+O2(g)=2NO2(g) ΔH=-116.4 kJ·mol-1,下列说法正确的是
| A.该反应能够自发的原因是ΔS > 0 |
| B.工业上使用合适的催化剂可提高NO2的生产效率 |
| C.升高温度,该反应v(逆)增大,v(正)减小,平衡向逆反应方向移动 |
| D.2 mol NO(g)和1 mol O2(g)中所含化学键能总和比2 mol NO2(g)中大116.4 kJ·mol-1 |
2022·江苏·一模 查看更多[3]
(已下线)化学(江苏B卷)-学易金卷:2023年高考第一次模拟考试卷江苏省南京市六校联合体2022-2023学年高一下学期5月期中考试化学试题福建省厦门双十中学2023-2024学年高二上学期期中考试化学试题
更新时间:2023-08-10 17:33:49
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
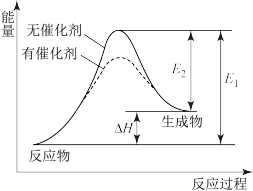

| A.该反应为放热反应 |
| B.逆反应的活化能大于正反应的活化能 |
| C.该反应的焓变△H=E2-E1 |
| D.催化剂能降低该反应的活化能 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】根据如图所示的 和
和 反应生成
反应生成 过程中能量变化情况,判断下列说法错误的是
过程中能量变化情况,判断下列说法错误的是
 和
和 反应生成
反应生成 过程中能量变化情况,判断下列说法错误的是
过程中能量变化情况,判断下列说法错误的是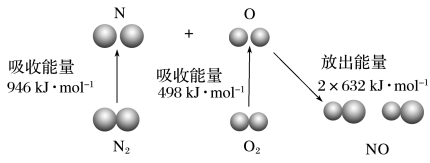
A. 气态氧原子结合生成 气态氧原子结合生成 时,能放出 时,能放出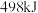 能量 能量 |
B.断裂 分子中的化学键,需要吸收 分子中的化学键,需要吸收 能量 能量 |
C.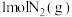 和 和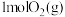 具有的总能量小于 具有的总能量小于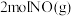 具有的总能量 具有的总能量 |
D.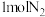 和 和 反应的焓变 反应的焓变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】甲酸分子在活性Pd催化剂表面脱氢的反应历程与能量变化如图所示。
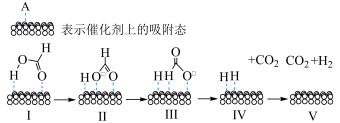
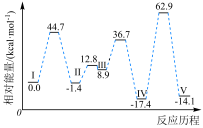
下列说法正确的是


下列说法正确的是
| A.升高温度,甲酸的平衡转化率增大 |
B.在Pd催化剂表面 键的解离速率比 键的解离速率比 键的解离速率快 键的解离速率快 |
C. 键的键能约为 键的键能约为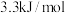 |
D.若用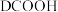 代替 代替 ,可得到 ,可得到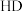 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】汽车尾气调节和处理已成为世界上一个至关重要问题。下图是汽车尾气中的 、
、 和碳氢化合物净化原理图。下列说法正确的是
和碳氢化合物净化原理图。下列说法正确的是

 、
、 和碳氢化合物净化原理图。下列说法正确的是
和碳氢化合物净化原理图。下列说法正确的是
| A.催化剂对化学反应有选择性 |
B. 、 、 均发生了氧化反应 均发生了氧化反应 |
| C.催化剂能提高反应速率和平衡转化率 |
D. 转化为 转化为 时, 时, 转化为 转化为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】根据下列实验操作和现象所得到的结论正确的是
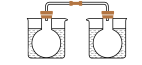 将 NO2 球浸泡在冷水和热水中 2NO2(g)  N2O4(g) N2O4(g) | 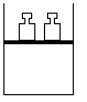 H2(g)+I2 H2(g)+I2 2HI(g) 2HI(g) |  推动注射器活塞 | 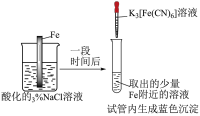 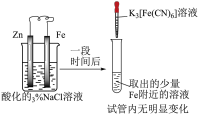 |
| A.气体在热水中 比在冷水中颜色浅 | B.平衡体系加压后颜色先变深后变浅 | C.加压后气体颜色变深后不再变化 | D.Zn 保护了 Fe 不被腐蚀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下图表示可逆反应 mA(g)+nB(g)  pC(g)+qD(g) 在不同温度(T)和压强(P)下生成物D的体积分数w(D)随时间的变化情况。关于上述正反应的判断正确的是
pC(g)+qD(g) 在不同温度(T)和压强(P)下生成物D的体积分数w(D)随时间的变化情况。关于上述正反应的判断正确的是
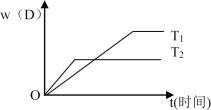
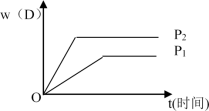
 pC(g)+qD(g) 在不同温度(T)和压强(P)下生成物D的体积分数w(D)随时间的变化情况。关于上述正反应的判断正确的是
pC(g)+qD(g) 在不同温度(T)和压强(P)下生成物D的体积分数w(D)随时间的变化情况。关于上述正反应的判断正确的是 

| A.T1>T2 ,△H<0 | B.T2>T1 ,△H>0 |
| C.P2>P1 ,m+n>p+q | D.P1>P2 ,m+n>p+q |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列反应中熵显著增加的是
| A.2N2O5(g) = 4NO2(g) +O2(g) | B.Cu(s)+Cl2(g) = CuCl2(s) |
| C.C(s) + O2(g) = CO2(g) | D.2H2(g) + O2(g) = 2H2O(1) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列关于焓与熵的说法正确的是
| A.焓与内能无关 |
| B.化学反应的反应热等于反应的焓变 |
| C.焓与物质的聚集状态有关,熵与物质的聚集状态无关 |
| D.孤立体系(与环境没有物质交换和能量交换)的自发过程向着熵增方向进行 |
您最近一年使用:0次

 2SO3(g),
2SO3(g),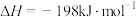 的说法正确的是
的说法正确的是

 是
是 分解的催化剂
分解的催化剂
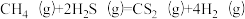 ,既可以除去天然气中的H2S,又可以获得H2.下列说法正确的是
,既可以除去天然气中的H2S,又可以获得H2.下列说法正确的是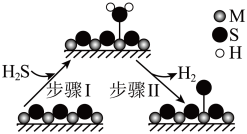
 S<0
S<0