以 作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的AS(Ⅲ)。已知:
作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的AS(Ⅲ)。已知: 微溶于水。在酸性或中性溶液中迅速氧化
微溶于水。在酸性或中性溶液中迅速氧化 产生
产生 ,在碱性溶液中较稳定。在
,在碱性溶液中较稳定。在 和
和 催化作用下发生分解。
催化作用下发生分解。
(1)制备高铁酸钾。向 和
和 混合溶液中加入
混合溶液中加入 ,过滤得到
,过滤得到 固体。
固体。
①制备 的化学方程式为
的化学方程式为___________ 。
②制备过程中 和
和 需过量的原因是
需过量的原因是___________ 。
③过滤所得的滤液中加入稀硫酸,产生 ,原因可能是:酸性条件下
,原因可能是:酸性条件下 氧化了
氧化了 ,还可能是
,还可能是___________ 。
(2)实验室可用间接碘量法测定含少量 杂质的
杂质的 样品的纯度:称取
样品的纯度:称取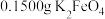 样品溶于碱性KI溶液中,调节pH使混合液充分反应。用
样品溶于碱性KI溶液中,调节pH使混合液充分反应。用 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 标准溶液
标准溶液 。滴定时,发生反应的离子方程式:
。滴定时,发生反应的离子方程式: ;
;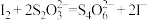 ,请计算
,请计算 样品的纯度:
样品的纯度:___________ (写出计算过程)。
 作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的AS(Ⅲ)。已知:
作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的AS(Ⅲ)。已知: 微溶于水。在酸性或中性溶液中迅速氧化
微溶于水。在酸性或中性溶液中迅速氧化 产生
产生 ,在碱性溶液中较稳定。在
,在碱性溶液中较稳定。在 和
和 催化作用下发生分解。
催化作用下发生分解。(1)制备高铁酸钾。向
 和
和 混合溶液中加入
混合溶液中加入 ,过滤得到
,过滤得到 固体。
固体。①制备
 的化学方程式为
的化学方程式为②制备过程中
 和
和 需过量的原因是
需过量的原因是③过滤所得的滤液中加入稀硫酸,产生
 ,原因可能是:酸性条件下
,原因可能是:酸性条件下 氧化了
氧化了 ,还可能是
,还可能是(2)实验室可用间接碘量法测定含少量
 杂质的
杂质的 样品的纯度:称取
样品的纯度:称取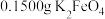 样品溶于碱性KI溶液中,调节pH使混合液充分反应。用
样品溶于碱性KI溶液中,调节pH使混合液充分反应。用 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 标准溶液
标准溶液 。滴定时,发生反应的离子方程式:
。滴定时,发生反应的离子方程式: ;
;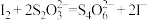 ,请计算
,请计算 样品的纯度:
样品的纯度:
更新时间:2023/08/21 08:10:02
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某兴趣课外小组设计实验室制取KMnO4的流程如图:

回答下列问题:
(1)将浓盐酸滴入漂白粉中,产生的气体为__ ,利用了盐酸的__ 性。
(2)实验装置如图:
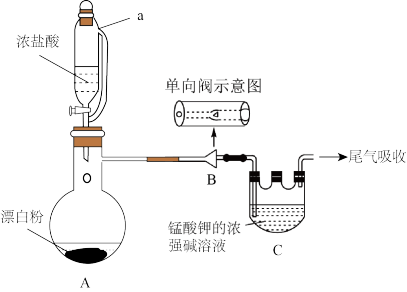
①仪器A的名称为__ ,a管的作用是_ 。
②仪器C中生成产物发生反应的化学方程式为__ ;单向阀的作用是__ ;
(3)上述装置存在一处缺陷,会导致KMnO4的产率降低,改进的方法是__ 。

回答下列问题:
(1)将浓盐酸滴入漂白粉中,产生的气体为
(2)实验装置如图:

①仪器A的名称为
②仪器C中生成产物发生反应的化学方程式为
(3)上述装置存在一处缺陷,会导致KMnO4的产率降低,改进的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】利用废镍催化剂(主要成分为Ni和NiO,还含有一定量的ZnO、 、CaO等)制备水合氢氧化氧镍(
、CaO等)制备水合氢氧化氧镍( )的工艺流程如下:
)的工艺流程如下:

已知:①Ni能与 反应生成NiO;②
反应生成NiO;② 。回答以下问题:
。回答以下问题:
(1)“焙烧”前,需将废镍催化剂粉碎的目的是_______ ,滤渣1的成分是_______ 。
(2)“酸浸”时,主要反应的离子方程式为_______ 。
(3)“沉钙”后,欲使 ,应加
,应加 使反应后的溶液中
使反应后的溶液中
_______  。
。
(4)“萃取”时,pH对金属离子萃取率的影响如下图所示:
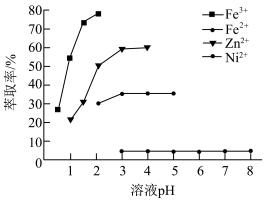
萃取剂萃取金属离子的原理如下:

萃取剂的萃取能力随pH的降低而_______ (填“降低”“不变”或“升高”),其原因是_______ 。
(5)“氧化”时,生成 的离子方程式为
的离子方程式为_______ 。
(6)取10.1g纯净干燥的 ,在空气中加强热,充分反应后生成8.3g
,在空气中加强热,充分反应后生成8.3g ,则
,则
_______ 。
 、CaO等)制备水合氢氧化氧镍(
、CaO等)制备水合氢氧化氧镍( )的工艺流程如下:
)的工艺流程如下:
已知:①Ni能与
 反应生成NiO;②
反应生成NiO;② 。回答以下问题:
。回答以下问题:(1)“焙烧”前,需将废镍催化剂粉碎的目的是
(2)“酸浸”时,主要反应的离子方程式为
(3)“沉钙”后,欲使
 ,应加
,应加 使反应后的溶液中
使反应后的溶液中
 。
。(4)“萃取”时,pH对金属离子萃取率的影响如下图所示:

萃取剂萃取金属离子的原理如下:

萃取剂的萃取能力随pH的降低而
(5)“氧化”时,生成
 的离子方程式为
的离子方程式为(6)取10.1g纯净干燥的
 ,在空气中加强热,充分反应后生成8.3g
,在空气中加强热,充分反应后生成8.3g ,则
,则
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】金属钨具有高熔点、低蒸气压、导热性好等特点,是等离子体材料的最佳候选材料。一种以黑钨矿(也叫钨锰铁矿,主要成分是FeWO4和MnWO4)为原料生产金属钨及含钨产品的工业流程如下图所示:

已知:“水浸”后滤液中的阴离子主要是 、
、 、
、 、
、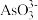 和
和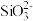 。
。
(1)“焙烧”前需要将黑钨矿进行粉碎,其目的是___________ ;已知“滤渣1”主要是Mn3O4和Fe2O3,写出MnWO4发生反应的化学方程式:___________ 。
(2)写出“氧化”时发生反应的离子方程式:_______ 。
(3)“滤渣2”主要是___________ (填化学式)。
(4)“操作X”是___________ ,产品 1是___________ 。
(5)已知钨酸钙(CaWO4)微溶于水,钨酸难溶于水,请结合平衡移动原理解释利用盐酸进行“酸解”的原因:___________ 。
(6)在实验室利用碘量法测定产品2中WCl6 [(易溶于CS2)的纯度,实验如下:
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为___________ g(不考虑空气中水蒸气的干扰)。
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过 离子交换柱发生反应:
离子交换柱发生反应: +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 ;交换结束后,向所得含
;交换结束后,向所得含 的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为___________ ,(列出计算式,无需化简)

已知:“水浸”后滤液中的阴离子主要是
 、
、 、
、 、
、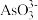 和
和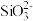 。
。(1)“焙烧”前需要将黑钨矿进行粉碎,其目的是
(2)写出“氧化”时发生反应的离子方程式:
(3)“滤渣2”主要是
(4)“操作X”是
(5)已知钨酸钙(CaWO4)微溶于水,钨酸难溶于水,请结合平衡移动原理解释利用盐酸进行“酸解”的原因:
(6)在实验室利用碘量法测定产品2中WCl6 [(易溶于CS2)的纯度,实验如下:
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过
 离子交换柱发生反应:
离子交换柱发生反应: +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 ;交换结束后,向所得含
;交换结束后,向所得含 的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验小组制备高铁酸钾( )并探究其性质。
)并探究其性质。
资料:
① 为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降与水反应放出氯气。
为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降与水反应放出氯气。
② 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
③ 与水反应还能产生具有强吸附性的
与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。
胶体,可除去水中细微的悬浮物,有净水作用。
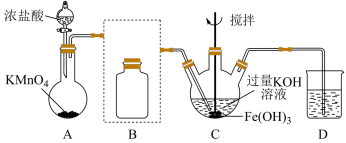
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 。
(2)A中发生反应的化学方程式为:___________ ,实验室还可以用二氧化锰和浓盐酸制备氯气,请写出其反应的离子方程式:___________ ,当 参与反应时,被氧化的
参与反应时,被氧化的 的质量为
的质量为___________ ,生成的 在标准状况下的体积约为
在标准状况下的体积约为___________ 。
(3)装置B是为了除去 中混有的
中混有的 杂质,将除杂装置B补充完整并标明所用试剂
杂质,将除杂装置B补充完整并标明所用试剂___________ 。
(4)D中可选用的试剂是___________。
(5)C中通 制得
制得 的化学方程式
的化学方程式___________ ,同时还发生了另一个反应的离子方程式是___________ 。
(6)下列关于 的说法中,正确的是
的说法中,正确的是___________ 。
A.是强氧化性的盐 B.固体保存需要防潮 C.其消毒和净化水的原理相同
 )并探究其性质。
)并探究其性质。资料:
①
 为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降与水反应放出氯气。
为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降与水反应放出氯气。②
 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。③
 与水反应还能产生具有强吸附性的
与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。
胶体,可除去水中细微的悬浮物,有净水作用。
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)A中发生反应的化学方程式为:
 参与反应时,被氧化的
参与反应时,被氧化的 的质量为
的质量为 在标准状况下的体积约为
在标准状况下的体积约为(3)装置B是为了除去
 中混有的
中混有的 杂质,将除杂装置B补充完整并标明所用试剂
杂质,将除杂装置B补充完整并标明所用试剂(4)D中可选用的试剂是___________。
| A.KOH溶液 | B.NaCl溶液 | C.稀硫酸 | D.NaI溶液 |
 制得
制得 的化学方程式
的化学方程式(6)下列关于
 的说法中,正确的是
的说法中,正确的是A.是强氧化性的盐 B.固体保存需要防潮 C.其消毒和净化水的原理相同
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
【查阅资料】①Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成KClO3;②K2FeO4易溶于水,微溶于浓KOH溶液,在0~5 ℃的强碱性溶液中较稳定。
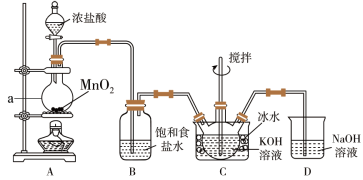
(1)仪器a的名称是________ ;装置A中反应的化学方程式为_______________________ 。
(2)装置C中三颈烧瓶置于冰水浴中的目的是______________________ 。
(3)装置B吸收的气体是________ ,装置D的作用是____________ 。
(4)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25 ℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为____________________________________ 。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0~5 ℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是__________________ .
【查阅资料】①Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成KClO3;②K2FeO4易溶于水,微溶于浓KOH溶液,在0~5 ℃的强碱性溶液中较稳定。

(1)仪器a的名称是
(2)装置C中三颈烧瓶置于冰水浴中的目的是
(3)装置B吸收的气体是
(4)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25 ℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0~5 ℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
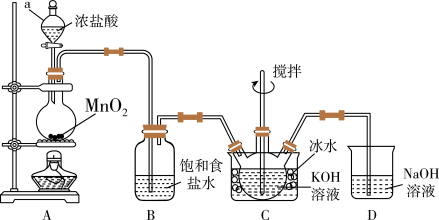
<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)装置C中三颈瓶置于冰水浴中的目的是_____________ 。
(2)装置B吸收的气体是___________ ,装置D的作用是__________________________ 。
(3)C中得到足量KClO后,将三颈烧瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为______________ 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③____________________________________ 。
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。

<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)装置C中三颈瓶置于冰水浴中的目的是
(2)装置B吸收的气体是
(3)C中得到足量KClO后,将三颈烧瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】铁红(Fe2O3)是一种用途广泛的颜料,用某烧渣(主要成分为 ,含少量
,含少量 )制备铁红的流程如下:
)制备铁红的流程如下: 还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是
还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是_______ 。
(2)“酸浸”时,生成 的离子方程式为
的离子方程式为_______ 。
(3)“沉铁”时,除了生成 白色沉淀,还生成一种气体,该气体为
白色沉淀,还生成一种气体,该气体为_______ 。(填化学式)
(4)“煅烧”时,在一定温度下加热颗粒状 。一段时间后所得产物有两种成分,其中外层产物为
。一段时间后所得产物有两种成分,其中外层产物为 ,内层产物为
,内层产物为 。从受热的温度和接触的气体分析,产生该现象的可能原因是
。从受热的温度和接触的气体分析,产生该现象的可能原因是_______ 。
(5)产品中 的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的
的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的 溶液,发生反应
溶液,发生反应 ,充分反应后,除去其中过量
,充分反应后,除去其中过量 ;再向锥形瓶中逐滴加入0.1000mol·L
;再向锥形瓶中逐滴加入0.1000mol·L
 溶液,发生反应
溶液,发生反应 ,恰好完全反应时消耗
,恰好完全反应时消耗 溶液18.75mL。计算产品中
溶液18.75mL。计算产品中 的质量分数
的质量分数_______ 。(写出计算过程)
 ,含少量
,含少量 )制备铁红的流程如下:
)制备铁红的流程如下: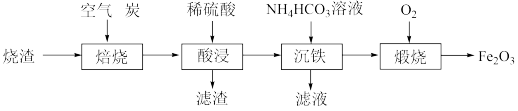
 还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是
还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是(2)“酸浸”时,生成
 的离子方程式为
的离子方程式为(3)“沉铁”时,除了生成
 白色沉淀,还生成一种气体,该气体为
白色沉淀,还生成一种气体,该气体为(4)“煅烧”时,在一定温度下加热颗粒状
 。一段时间后所得产物有两种成分,其中外层产物为
。一段时间后所得产物有两种成分,其中外层产物为 ,内层产物为
,内层产物为 。从受热的温度和接触的气体分析,产生该现象的可能原因是
。从受热的温度和接触的气体分析,产生该现象的可能原因是(5)产品中
 的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的
的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的 溶液,发生反应
溶液,发生反应 ,充分反应后,除去其中过量
,充分反应后,除去其中过量 ;再向锥形瓶中逐滴加入0.1000mol·L
;再向锥形瓶中逐滴加入0.1000mol·L
 溶液,发生反应
溶液,发生反应 ,恰好完全反应时消耗
,恰好完全反应时消耗 溶液18.75mL。计算产品中
溶液18.75mL。计算产品中 的质量分数
的质量分数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】Na2S2O3∙5H2O在化学定量分析中常用作基准物质,实验室制备原理为:Na2CO3 + 4SO2 + 2Na2S  3Na2S2O3+ CO2设计如图1装置
3Na2S2O3+ CO2设计如图1装置 夹持仪器省略
夹持仪器省略 进行实验。
进行实验。
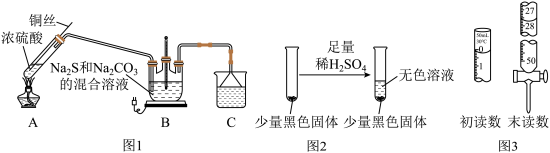
⑴A中发生的化学反应方程式为______ ;
⑵C中所盛试剂可能是______ ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 ______ ;
⑶学生乙在加热A后,发现液面下的铜丝变黑,如图2。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS。
学生丙提出假设②一定不成立,依据是______ ;该生用如下实验进一步验证黑色物质的组成:基于上述假设分析,黑色物质的组成为 ______ (填化学式)
⑷实验室用Na2S2O3标准液测量某工业废水中的I2的浓度。
已知:I2 + 2S2O32- = S4O62- + 2I-
①以淀粉为指示剂,则到达滴定终点的现象是______ ;
②若标液Na2S2O3的浓度0.0030mol/L,滴定25.00 mL工业废水消耗该Na2S2O3溶液体积如右图所示,则该废水中I2的浓度为______ 。
 3Na2S2O3+ CO2设计如图1装置
3Na2S2O3+ CO2设计如图1装置 夹持仪器省略
夹持仪器省略 进行实验。
进行实验。
⑴A中发生的化学反应方程式为
⑵C中所盛试剂可能是
⑶学生乙在加热A后,发现液面下的铜丝变黑,如图2。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS。
学生丙提出假设②一定不成立,依据是
⑷实验室用Na2S2O3标准液测量某工业废水中的I2的浓度。
已知:I2 + 2S2O32- = S4O62- + 2I-
①以淀粉为指示剂,则到达滴定终点的现象是
②若标液Na2S2O3的浓度0.0030mol/L,滴定25.00 mL工业废水消耗该Na2S2O3溶液体积如右图所示,则该废水中I2的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】三氯乙醛(CCl3CHO)是无色油状液体,是制取农药的常用原料。某探究小组模拟工业生产制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
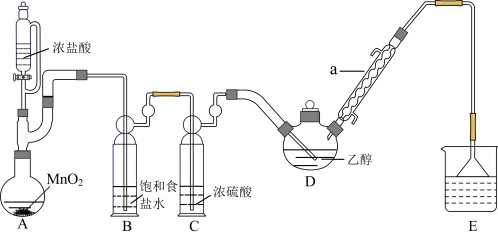
查阅资料知:①制备CCl3CHO的反应原理为: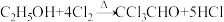 ,可能发生的副反应有:
,可能发生的副反应有: ;
; 。
。
②有关物质的性质:
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ ,仪器a的作用是_______ 。
(2)实验时,应维持装置D的反应温度为70℃左右,装置D采用较合理的加热方式是_______ ,若发现D中导管口处气泡速率过快,合理的解决方法是_______ 。
(3)若撤去装置C会导致CCl3CHO产率降低,原因是_______ 。
(4)从反应后的混合物中获得CCl3CHO粗产品,应采取的实验操作方法是_______ 。
(5)粗产品纯度的测定:
Ⅰ.称取m g CCl3CHO(相对分子质量为147.5)粗产品,配成待测溶液,然后用酸式滴定管量取xmL0.100mol·L-1碘标准溶液加入待测溶液,再加入适量碳酸钠溶液,使反应: 、
、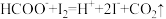 充分进行;
充分进行;
Ⅱ.再加适量盐酸调节溶液的pH,并立即用0.020mol·L-1Na2S2O3溶液滴定至终点,发生反应: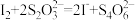 ;
;
Ⅲ.重复上述操作3次,平均消耗Na2S2O3溶液ymL。测得产品的纯度为_______ ,下列情况可能导致产品纯度的测量值偏小的是_______ (填标号)。
a.量取碘标准液时,酸式滴定管未用碘标准液润洗
b.在滴定终点读数时,俯视标准液液面
c.Na2S2O3溶液部分被氧化
d.步骤Ⅱ加入盐酸调节溶液pH,调节后溶液pH过低

查阅资料知:①制备CCl3CHO的反应原理为:
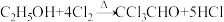 ,可能发生的副反应有:
,可能发生的副反应有: ;
; 。
。②有关物质的性质:
| 物质 | C2H5OH | CCl3 CHO | CCl3COOH | C2H5Cl |
| 熔点/℃ | -114.1 | -57.1 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(1)装置A中发生反应的离子方程式为
(2)实验时,应维持装置D的反应温度为70℃左右,装置D采用较合理的加热方式是
(3)若撤去装置C会导致CCl3CHO产率降低,原因是
(4)从反应后的混合物中获得CCl3CHO粗产品,应采取的实验操作方法是
(5)粗产品纯度的测定:
Ⅰ.称取m g CCl3CHO(相对分子质量为147.5)粗产品,配成待测溶液,然后用酸式滴定管量取xmL0.100mol·L-1碘标准溶液加入待测溶液,再加入适量碳酸钠溶液,使反应:
 、
、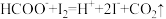 充分进行;
充分进行;Ⅱ.再加适量盐酸调节溶液的pH,并立即用0.020mol·L-1Na2S2O3溶液滴定至终点,发生反应:
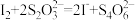 ;
;Ⅲ.重复上述操作3次,平均消耗Na2S2O3溶液ymL。测得产品的纯度为
a.量取碘标准液时,酸式滴定管未用碘标准液润洗
b.在滴定终点读数时,俯视标准液液面
c.Na2S2O3溶液部分被氧化
d.步骤Ⅱ加入盐酸调节溶液pH,调节后溶液pH过低
您最近一年使用:0次



