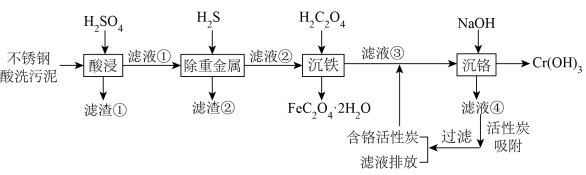
一种新型的“水浸一分步沉淀法”实现了以不锈钢酸洗污泥(主要含有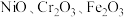 、
、 等组分)为原料,高效回收金属镍铁铬。其流程示意图如图所示。
等组分)为原料,高效回收金属镍铁铬。其流程示意图如图所示。
已知:Ⅰ. 时溶度积:
时溶度积: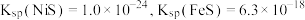 ;
;
Ⅱ. 性质与
性质与 类似。
类似。
回答下列问题:
(1)基态 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为___________ 。
(2)滤渣①的主要成分有___________ (填化学式)。
(3)“除重金属”时,通入一定量的 气体,调节溶液的
气体,调节溶液的 ,当
,当 刚好完全沉淀时,则
刚好完全沉淀时,则
___________ 。(设 的平衡浓度为
的平衡浓度为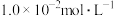 ,已知:
,已知: 的
的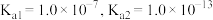 )。
)。
(4)“沉铁”时,加入草酸发生的离子方程式为___________ 。
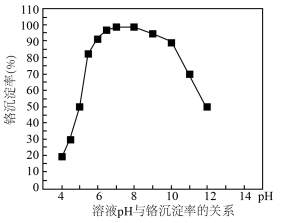
(5)“沉铬”时,需要往滤液③中滴加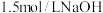 溶液调
溶液调 ,溶液
,溶液 与铬沉淀率的关系如图(b)所示。综合考虑,确定铬沉淀时,溶液适宜
与铬沉淀率的关系如图(b)所示。综合考虑,确定铬沉淀时,溶液适宜
___________ 。若 过大,则会造成
过大,则会造成 产率下降,其原因是
产率下降,其原因是___________ (用离子方程式表达)。
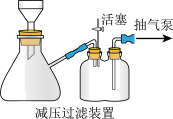
(6)“沉铬”后,采用减压过滤的方式,分离得到 ,减压过滤装置如图所示。减压过滤时,需要用蒸馏水洗涤
,减压过滤装置如图所示。减压过滤时,需要用蒸馏水洗涤 沉淀,判断
沉淀,判断 沉淀洗净的实验操作和现象是
沉淀洗净的实验操作和现象是___________ 。
(7)将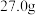 草酸亚铁晶体
草酸亚铁晶体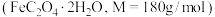 在空气中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示。其中B点时,固体只含有一种铁的氧化物,则B点的固体物质为
在空气中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示。其中B点时,固体只含有一种铁的氧化物,则B点的固体物质为___________ 。

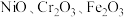 、
、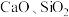 等组分)为原料,高效回收金属镍铁铬。其流程示意图如图所示。
等组分)为原料,高效回收金属镍铁铬。其流程示意图如图所示。
已知:Ⅰ.
 时溶度积:
时溶度积: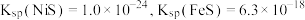 ;
;Ⅱ.
 性质与
性质与 类似。
类似。回答下列问题:
(1)基态
 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为(2)滤渣①的主要成分有
(3)“除重金属”时,通入一定量的
 气体,调节溶液的
气体,调节溶液的 ,当
,当 刚好完全沉淀时,则
刚好完全沉淀时,则
 的平衡浓度为
的平衡浓度为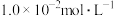 ,已知:
,已知: 的
的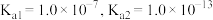 )。
)。(4)“沉铁”时,加入草酸发生的离子方程式为
(5)“沉铬”时,需要往滤液③中滴加
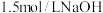 溶液调
溶液调 ,溶液
,溶液 与铬沉淀率的关系如图(b)所示。综合考虑,确定铬沉淀时,溶液适宜
与铬沉淀率的关系如图(b)所示。综合考虑,确定铬沉淀时,溶液适宜
 过大,则会造成
过大,则会造成 产率下降,其原因是
产率下降,其原因是
(6)“沉铬”后,采用减压过滤的方式,分离得到
 ,减压过滤装置如图所示。减压过滤时,需要用蒸馏水洗涤
,减压过滤装置如图所示。减压过滤时,需要用蒸馏水洗涤 沉淀,判断
沉淀,判断 沉淀洗净的实验操作和现象是
沉淀洗净的实验操作和现象是
(7)将
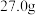 草酸亚铁晶体
草酸亚铁晶体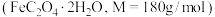 在空气中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示。其中B点时,固体只含有一种铁的氧化物,则B点的固体物质为
在空气中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示。其中B点时,固体只含有一种铁的氧化物,则B点的固体物质为
更新时间:2023-10-07 20:59:53
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
【推荐1】现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_____ 。
(2)B元素的电负性_____ (填“大于”“小于”或“等于”)C元素的电负性。
(3)下列关于F原子的价层电子轨道表示式正确的是_____ (填字母)。
(4)基态F3+的核外电子排布式为______ 。
(5)元素铜与镍的第二电离能分别为ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是______ 。
(6)B原子核外有______ 种不同运动状态的电子。基态B原子中,能量最高的电子所占据的原子轨道的形状为_____ 。
(7)As的卤化物的熔点如表:
表中卤化物熔点差异的原因是______ 。
(8)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是______ ,Fe3+的配位数为______ 。

| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738kJ·mol-1;I2=1451kJ·mol-1;I3=7733kJ·mol-1;I4=10540kJ·mol-1 |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(2)B元素的电负性
(3)下列关于F原子的价层电子轨道表示式正确的是
A.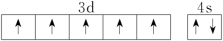 | B.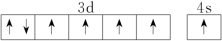 |
C. | D.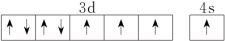 |
(5)元素铜与镍的第二电离能分别为ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是
(6)B原子核外有
(7)As的卤化物的熔点如表:
| 物质 | AsCl3 | AsBr3 | AsI3 |
| 熔点/K | 256.8 | 304 | 413 |
(8)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】硼等非金属元素形成的单质和化合物在生活、生产中有重要的用途。回答下列问题:
(1)下列分别为B、F、P、S基态原子的价层电子排布图,其中正确的是_______(填标号)。
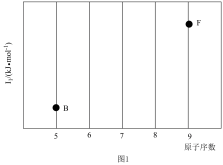
(2)参照图1中B、F元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出C、N、O三种元素的相对位置_______ (不必连线)。
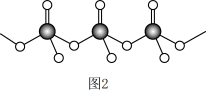
(3)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图2所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为_______ 。
(4) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
①与Ti同周期,基态时,与Ti原子的未成对电子数相同的元素有Ni、Ge、_______ (填元素符号,下同)。
② 中所含元素的电负性由小到大排列顺序为
中所含元素的电负性由小到大排列顺序为_______ 。
③ 由
由 和
和 构成,
构成, 可由
可由 和
和 结合而成。阴离子
结合而成。阴离子 的空间结构为
的空间结构为_______ , 中含有
中含有_______ (填序号)。
A.离子键 B. 键 C.
键 C. 键 D.配位键 E.氢键
键 D.配位键 E.氢键
(5)一种四方结构的超导化合物的晶胞结构如图3所示,晶胞中Sm和As原子的投影位置如图4所示。
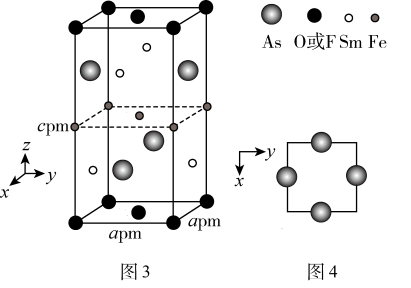
图中F和O共同占据晶胞的上下底面位置,若两者的比例依次用x和 代表,则该化合物的化学式表示为
代表,则该化合物的化学式表示为_______ ,通过测定密度 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
_______  。
。
(1)下列分别为B、F、P、S基态原子的价层电子排布图,其中正确的是_______(填标号)。
A.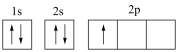 | B.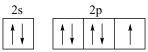 |
C.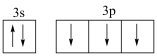 | D. |

(3)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图2所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为

(4)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①与Ti同周期,基态时,与Ti原子的未成对电子数相同的元素有Ni、Ge、
②
 中所含元素的电负性由小到大排列顺序为
中所含元素的电负性由小到大排列顺序为③
 由
由 和
和 构成,
构成, 可由
可由 和
和 结合而成。阴离子
结合而成。阴离子 的空间结构为
的空间结构为 中含有
中含有A.离子键 B.
 键 C.
键 C. 键 D.配位键 E.氢键
键 D.配位键 E.氢键(5)一种四方结构的超导化合物的晶胞结构如图3所示,晶胞中Sm和As原子的投影位置如图4所示。

图中F和O共同占据晶胞的上下底面位置,若两者的比例依次用x和
 代表,则该化合物的化学式表示为
代表,则该化合物的化学式表示为 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】据世界权威刊物《自然》最近报道,选择碲化锆 (ZrTe5) 为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。Te 属于VIA族元素。回答下列问题:
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是___________ ,Zr2+的价电子排布图是___________ 。
(2) Zr、 Te、Cl的电负性能由大到小的顺序是___________ ,H2O、H2S、H2Te的沸点由高到低的顺序是___________ 酸性强弱比较: H2SO4___________ H2TeO4 (填“>”或“<”)。
(3) H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是_____ 。
(4) [Zr(C2H5O)2]2+是 Zr4+形成的一种配离子,其中的配位原子是___________ (填符号),1个[Zr(C2H5O)2]2+离子中含共价键的数目是___________ 。
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是___________ 。 若晶胞中距离最近的两个氧原子间的距离为a nm,则立方氧化锆的密度为___________ g/cm3 (写出计算表达式)。
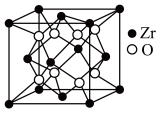
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是
(2) Zr、 Te、Cl的电负性能由大到小的顺序是
(3) H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是
(4) [Zr(C2H5O)2]2+是 Zr4+形成的一种配离子,其中的配位原子是
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】据海通证券发布的最新研究报告表明,受尼龙66的拉动,目前我国己二酸供给缺口较大,且预计2024—2026年仍将整体处于紧缺状态.实验室模拟高锰酸钾氧化环己醇(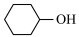 )制备己二酸
)制备己二酸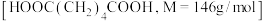 的实验过程如下:
的实验过程如下:
②用电热套加热升温到40℃,移走电热套,缓慢滴加环己醇,控制温度50℃左右,使之充分反应;
③趁热抽滤,用热水洗涤滤渣
 2~3次,合并滤液;
2~3次,合并滤液;④向滤液中加入4mL浓盐酸酸化,加热浓缩,冷却析出晶体,抽滤,得到己二酸粗品4.599g.回答下列问题:
(1)已知:
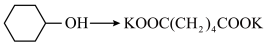 会放出热量,补全该反应的化学方程式
会放出热量,补全该反应的化学方程式(2)经反复实验对比研究,该实验条件下环己醇滴速控制在20s/滴时最佳,理由是
(3)实验中判断反应进行完全的方法是用玻璃棒蘸取1滴反应混合物,点到滤纸上,若滤纸上
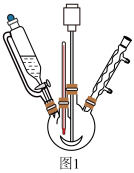
(4)步骤④中抽滤时采用如下装置(图2).抽滤时先打开水龙头,抽气管,用倾析法将混合物转移至布氏漏斗中.抽滤完毕,接下来的操作是
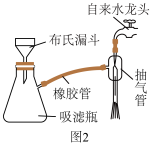
(5)步骤④中加入浓盐酸酸化的目的是
(6)图3是己二酸的浓度与温度关系曲线图.介稳区表示己二酸溶液处于饱和状态,稳定区表示己二酸溶液处于
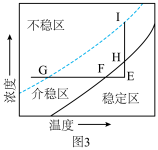
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】钒铬还原渣的主要成分为VO2·xH2O、Cr(OH)3及少量的SiO2,它是有色冶金领域重要危险固体废弃物。一种分离钒铬还原渣中钒铬并获得Na2Cr2O7的工艺流程如下:

已知:①“酸浸”后VO2·xH2O转化为VO2+;②Cr(OH)3的Ksp近似为1×10-28;③Na2Cr2O7和Na2SO4的溶解度随温度变化的曲线如下图所示:

回答下列问题:
(1)为了提高钒铬还原渣的浸取率,可以进行的操作是___________ (写出一条即可)。
(2)“滤渣”的主要成分是___________ ,“氧化”生成 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(3)若“含Cr3+净化液”中c(Cr3+)=0.1 mol/L,则“水解沉钒”调pH的范围是2.5~___________ 。
(4)“溶液1”中含 ,加入H2O2后发生反应的离子方程式为
,加入H2O2后发生反应的离子方程式为___________ 。
(5)“多步操作”包括___________ 、___________ 、洗涤、干燥等步骤。
(6)若称取mg该钒铬还原渣,其中Cr(OH)3的质量分数为10%,最终制得n g Na2Cr2O7固体,则该过程中Cr元素的转化率为___________ 。

已知:①“酸浸”后VO2·xH2O转化为VO2+;②Cr(OH)3的Ksp近似为1×10-28;③Na2Cr2O7和Na2SO4的溶解度随温度变化的曲线如下图所示:

回答下列问题:
(1)为了提高钒铬还原渣的浸取率,可以进行的操作是
(2)“滤渣”的主要成分是
 ,发生反应的离子方程式为
,发生反应的离子方程式为(3)若“含Cr3+净化液”中c(Cr3+)=0.1 mol/L,则“水解沉钒”调pH的范围是2.5~
(4)“溶液1”中含
 ,加入H2O2后发生反应的离子方程式为
,加入H2O2后发生反应的离子方程式为(5)“多步操作”包括
(6)若称取mg该钒铬还原渣,其中Cr(OH)3的质量分数为10%,最终制得n g Na2Cr2O7固体,则该过程中Cr元素的转化率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】聚硅酸铁是将铁离子引入到活性硅酸而制得的复合型混凝剂。用废铁皮(主要成分Fe和Fe3O4,少量碳)为原料制备的流程如下:

(1)废铁渣进行“粉碎”的目的是_________________ 。
(2)在实验室进行过滤操作时,所用到玻璃仪器有___________________________ 。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
已知:在一定温度下,Fe3+在pH=2开始沉淀,pH=3.7沉淀完全。
①酸浸时应控制溶液的pH___________
②酸浸时通入O2的目的是_______________________________ 。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是__________________________ 。
(4)滤渣的主要成分为____________________________ (填化学式)。
(5)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为_________________________ ;
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2,用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为_____________________ (结果保留两位有效数字)。

(1)废铁渣进行“粉碎”的目的是
(2)在实验室进行过滤操作时,所用到玻璃仪器有
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
| 温度(℃) | 40 | 60 | 80 | 100 | 120 |
| 铁浸取率(%) | 50 | 62 | 79 | 92 | 83 |
①酸浸时应控制溶液的pH
②酸浸时通入O2的目的是
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是
(4)滤渣的主要成分为
(5)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2,用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为
您最近一年使用:0次



