氧化镁在医药、建筑等行业应用广泛。以菱镁矿(主要成分为 ,另含少量杂质
,另含少量杂质 、
、 )为原料制备高纯氧化镁的工艺流程如下:
)为原料制备高纯氧化镁的工艺流程如下:
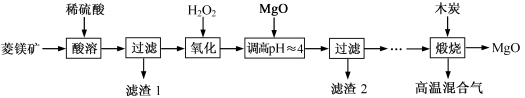
已知: 完全沉淀的pH为3.2。
完全沉淀的pH为3.2。
回答下列问题:
(1)“酸溶”时, 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_____ 。
(2)“滤渣1”为_____ (填化学式)。
(3)“氧化”过程中发生反应的离子方程式为_____ 。
(4)“煅烧”过程中,同时存在以下三个反应:
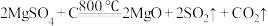
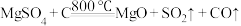
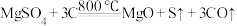
利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
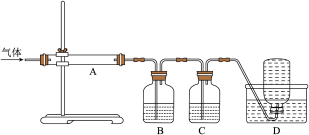
①B中盛放的溶液是酸性高锰酸钾溶液(足量),发生反应的离子方程式为_____ 。
②在清洗A管中沉积S时,通常用热的浓NaOH溶液,反应中S歧化生成 和
和 。写出反应的化学方程式并用“双线桥”表示电子转移的方向和数目:
。写出反应的化学方程式并用“双线桥”表示电子转移的方向和数目:_____ 。
③要使D中只收集到一种气体,则C中盛放的试剂是_____ (填标号)。
a.浓NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaCl溶液
④D中收集的气体是_____ (填化学式)。
 ,另含少量杂质
,另含少量杂质 、
、 )为原料制备高纯氧化镁的工艺流程如下:
)为原料制备高纯氧化镁的工艺流程如下:
已知:
 完全沉淀的pH为3.2。
完全沉淀的pH为3.2。回答下列问题:
(1)“酸溶”时,
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(2)“滤渣1”为
(3)“氧化”过程中发生反应的离子方程式为
(4)“煅烧”过程中,同时存在以下三个反应:
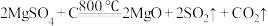
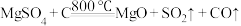
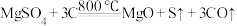
利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。

①B中盛放的溶液是酸性高锰酸钾溶液(足量),发生反应的离子方程式为
②在清洗A管中沉积S时,通常用热的浓NaOH溶液,反应中S歧化生成
 和
和 。写出反应的化学方程式并用“双线桥”表示电子转移的方向和数目:
。写出反应的化学方程式并用“双线桥”表示电子转移的方向和数目:③要使D中只收集到一种气体,则C中盛放的试剂是
a.浓NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaCl溶液
④D中收集的气体是
更新时间:2023-10-23 16:46:48
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是__________ ,其作用是__________ 。
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_____________________ 。B中应放置的液体是__________ (填字母)。
a.水 b.酸性KMnO4 c.浓溴水 d.饱和NaHSO3
(3)取6.4g铜片和12mL 18.4mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是__________
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是__________ (填字母)。
a.铁粉 b.银粉 c.碳酸氢钠溶液 d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的是__________ (填字母)
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
a.水 b.酸性KMnO4 c.浓溴水 d.饱和NaHSO3
(3)取6.4g铜片和12mL 18.4mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是
a.铁粉 b.银粉 c.碳酸氢钠溶液 d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的是
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】二氧化硫(SO2)是一种在空间地理、环境科学、地质勘探等领域受到广泛研究的一种气体。某研究小组设计了一套制备及检验SO2部分性质的装置,如图所示:

(1)检验装置A气密性的方法是___________ 。
(2)实验过程中观察到装置B中的现象是___________ ,证明SO2具有___________ 。
(3)①有同学对C装置变浑浊现象提出质疑:该装置没有排空气,而空气中的O2氧化性强于SO2,因此装置C中即使有浑浊现象也不能说明是SO2导致的。请你写出O2与Na2S溶液反应的化学方程式___________ 。
②为进一步探究装置C产生浑浊现象的原因,进行新的实验。实验操作及现象见表:
由实验现象可知:该实验条件下 溶液出现浑浊现象是SO2导致的。你认为上表实验1反应较慢的原因可能是
溶液出现浑浊现象是SO2导致的。你认为上表实验1反应较慢的原因可能是___________ 。
(4)装置D的目的是探究SO2与品红作用的可逆性,写出实验操作及现象___________ 。
(5)装置E中发生反应的离子方程式为___________ 。

(1)检验装置A气密性的方法是
(2)实验过程中观察到装置B中的现象是
(3)①有同学对C装置变浑浊现象提出质疑:该装置没有排空气,而空气中的O2氧化性强于SO2,因此装置C中即使有浑浊现象也不能说明是SO2导致的。请你写出O2与Na2S溶液反应的化学方程式
②为进一步探究装置C产生浑浊现象的原因,进行新的实验。实验操作及现象见表:
| 序号 | 实验操作 | 实验现象 |
| 1 | 向10 mL1 mol/LNa2S溶液中通O2 | 15 min后,溶液才出现浑浊 |
| 2 | 向10 mL1mol/L溶液中通SO2 | 溶液立即出现黄色浑浊 |
 溶液出现浑浊现象是SO2导致的。你认为上表实验1反应较慢的原因可能是
溶液出现浑浊现象是SO2导致的。你认为上表实验1反应较慢的原因可能是(4)装置D的目的是探究SO2与品红作用的可逆性,写出实验操作及现象
(5)装置E中发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二:打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C试管中溶液的pH。
结合上述实验,回答以下问题:
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________ ,其中发生反应的化学方程式为_______________________ 。
(2)甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质_____________ ,该物质发生电离所致。
(3)通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是_______________________ 。
测定结果如下:
实验发现:C瓶中溶液的酸性始终比B瓶中的酸性强。
(4)通过查阅文献,I﹣可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程分两步进行如下,将ii补充完整。
i.SO2+4I﹣+4H+=S↓+2I2+2H2O
ii.I2+2H2O+___ ═___ +___ +2I﹣
(5)最终结论:C瓶中溶液酸性强于B瓶,是由于生成了____________ ,该过程中体现出二氧化硫哪些化学性质________________ (选填“氧化性”,“还原性”)。

步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二:打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C试管中溶液的pH。
结合上述实验,回答以下问题:
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是
(2)甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质
(3)通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是
测定结果如下:
| 第1次实验 | 第2次实验 | 第3次实验 | |
| B瓶中pH | 2.15 | 2.10 | 2.17 |
| C瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现:C瓶中溶液的酸性始终比B瓶中的酸性强。
(4)通过查阅文献,I﹣可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程分两步进行如下,将ii补充完整。
i.SO2+4I﹣+4H+=S↓+2I2+2H2O
ii.I2+2H2O+
(5)最终结论:C瓶中溶液酸性强于B瓶,是由于生成了
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
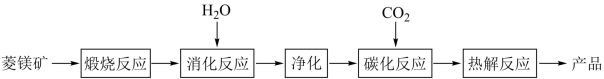
(1)根据下列表格数据,选择消化反应的最佳温度__________ ;理由是___________________________ 。
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________ 。
(3)流程图中__________ 和__________ 可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH 为9.5时,此时Mn2+小于__________ mol·L-1,不会沉淀出来。
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________ 。
A.Ca(ClO)2 B.Cl2
C.H2O2 D.HNO3
③下列方案中,较好的为_________ ,理由是_____________________ 。


(1)根据下列表格数据,选择消化反应的最佳温度
| 消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为
(3)流程图中
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH 为9.5时,此时Mn2+小于
| 物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为
A.Ca(ClO)2 B.Cl2
C.H2O2 D.HNO3
③下列方案中,较好的为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某工厂排出的废水中含有大量的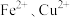 和
和 。为了减少污染并变废为宝,某实验小组在实验室设计了如下流程,以回收铜和硫酸亚铁。请回答:
。为了减少污染并变废为宝,某实验小组在实验室设计了如下流程,以回收铜和硫酸亚铁。请回答:
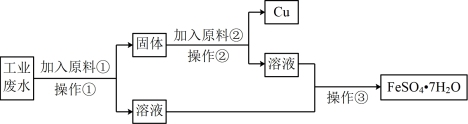
(1)原料①为金属___________ (填元素符号)。
(2)加入原料②是为了溶解过量的①,加入原料②反应的离子方程式___________ 。
(3)操作②要用到的玻璃仪器的名称是漏斗、___________ 、玻璃棒。
(4)操作③要用到蒸发皿,操作③的实验名称是___________ 。
(5)硫酸亚铁分解生成铁红,将反应补充完整: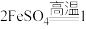
________ 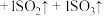 。
。
(6)硫酸亚铁溶液吸收氯气的离子方程式为___________ 。
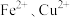 和
和 。为了减少污染并变废为宝,某实验小组在实验室设计了如下流程,以回收铜和硫酸亚铁。请回答:
。为了减少污染并变废为宝,某实验小组在实验室设计了如下流程,以回收铜和硫酸亚铁。请回答:
(1)原料①为金属
(2)加入原料②是为了溶解过量的①,加入原料②反应的离子方程式
(3)操作②要用到的玻璃仪器的名称是漏斗、
(4)操作③要用到蒸发皿,操作③的实验名称是
(5)硫酸亚铁分解生成铁红,将反应补充完整:
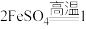
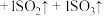 。
。(6)硫酸亚铁溶液吸收氯气的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验室以铁碳化合物 为主要原料,制备
为主要原料,制备 溶液,步骤如下:
溶液,步骤如下:
步骤Ⅰ:称取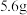 铁碳化合物,在足量空气中高温灼烧,生成有磁性的固体X。
铁碳化合物,在足量空气中高温灼烧,生成有磁性的固体X。
步骤Ⅱ:将X与过量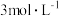 的盐酸反应,向反应后溶液中加入过量
的盐酸反应,向反应后溶液中加入过量 溶液。
溶液。
步骤Ⅲ:将“步骤Ⅱ”所得的溶液加热煮沸一段时间,冷却。
回答下列问题:
(1)步骤Ⅰ中用到的硅酸盐仪器有酒精灯、玻璃棒、___________ 、___________ ,若 充分反应,则X的质量=
充分反应,则X的质量=___________ g。
(2)实验室有各种规格的常用容量瓶,用 的盐酸和蒸馏水配制
的盐酸和蒸馏水配制 盐酸。
盐酸。
①配制时需要用量筒量取___________ 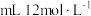 的盐酸。
的盐酸。
②下列操作导致所配溶液浓度偏高的是___________ (填标号)。
a.定容时俯视刻度线 b.转移溶液时有液体溅出
c.配制溶液时容量瓶中有少许蒸馏水 d.量取 的盐酸时仰视读数
的盐酸时仰视读数
(3)步骤Ⅱ中X与过量盐酸反应后,溶液中含有的盐的化学式为 、
、___________ ,若要将 溶液中的
溶液中的 氧化,需要消耗
氧化,需要消耗___________  。
。
(4)用步骤Ⅲ所制得的 溶液制备
溶液制备 胶体的具体操作为
胶体的具体操作为___________ ,检验制备胶体成功的方法是___________ 。
 为主要原料,制备
为主要原料,制备 溶液,步骤如下:
溶液,步骤如下:步骤Ⅰ:称取
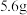 铁碳化合物,在足量空气中高温灼烧,生成有磁性的固体X。
铁碳化合物,在足量空气中高温灼烧,生成有磁性的固体X。步骤Ⅱ:将X与过量
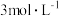 的盐酸反应,向反应后溶液中加入过量
的盐酸反应,向反应后溶液中加入过量 溶液。
溶液。步骤Ⅲ:将“步骤Ⅱ”所得的溶液加热煮沸一段时间,冷却。
回答下列问题:
(1)步骤Ⅰ中用到的硅酸盐仪器有酒精灯、玻璃棒、
 充分反应,则X的质量=
充分反应,则X的质量=(2)实验室有各种规格的常用容量瓶,用
 的盐酸和蒸馏水配制
的盐酸和蒸馏水配制 盐酸。
盐酸。①配制时需要用量筒量取
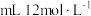 的盐酸。
的盐酸。②下列操作导致所配溶液浓度偏高的是
a.定容时俯视刻度线 b.转移溶液时有液体溅出
c.配制溶液时容量瓶中有少许蒸馏水 d.量取
 的盐酸时仰视读数
的盐酸时仰视读数(3)步骤Ⅱ中X与过量盐酸反应后,溶液中含有的盐的化学式为
 、
、 溶液中的
溶液中的 氧化,需要消耗
氧化,需要消耗 。
。(4)用步骤Ⅲ所制得的
 溶液制备
溶液制备 胶体的具体操作为
胶体的具体操作为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
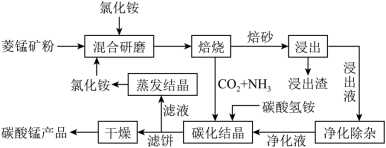
【推荐1】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
已知:①锰和粉的主要成分是 ,还含少量Fe、Al、Ca、Mg等元素。
,还含少量Fe、Al、Ca、Mg等元素。
②相关金属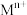 离于
离于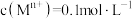 形成
形成 沉淀的pH范围如下:
沉淀的pH范围如下:
回答下列问题:
(1)“焙烧时发生的主要反应的化学方程式为_______ 。
(2)浸出液“净化除杂”过程如下:
①加入 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
②加入 调节溶液pH范围为
调节溶液pH范围为_______ ,将 、
、 变为沉淀除去。
变为沉淀除去。
(3)碳化结晶时,反应的离子方程式为_______ 。
(4)流程中能循环利用的物质除了氯化铵之外还有_______ 。

已知:①锰和粉的主要成分是
 ,还含少量Fe、Al、Ca、Mg等元素。
,还含少量Fe、Al、Ca、Mg等元素。②相关金属
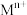 离于
离于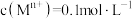 形成
形成 沉淀的pH范围如下:
沉淀的pH范围如下:| 金属离子 |  | 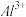 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
| 沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧时发生的主要反应的化学方程式为
(2)浸出液“净化除杂”过程如下:
①加入
 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为②加入
 调节溶液pH范围为
调节溶液pH范围为 、
、 变为沉淀除去。
变为沉淀除去。(3)碳化结晶时,反应的离子方程式为
(4)流程中能循环利用的物质除了氯化铵之外还有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】钠及其化合物在日常生活中有许多重要应用。回答下列问题:
Ⅰ.如图为钠的价类二维图。

(1)若①处是淡黄色固体,其化学式为___________ ,②处所属的物质类别为___________ 。
(2)氢化钠(NaH)能与水反应生成氢氧化钠和氢气,写出该反应的化学方程式:___________ 。
(3)钠钾合金可用作原子反应堆的导热剂的原因除了钠钾合金是难气化的液态合金,还有可能是___________ 。
Ⅱ.我国化学家侯德榜发明了联合制碱法( ),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去,
),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去, 极易溶于水,其水溶液呈碱性)。
极易溶于水,其水溶液呈碱性)。

(4)流程图中标注的物质属于电解质的有___________ 种,①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(5)煅烧 固体的化学方程式为
固体的化学方程式为___________ 。
(6)关于上述流程,下列说法中正确的是___________ (填字母)。
a.两种气体的先后顺序为先通入 再通入
再通入
b.先析出 的原因是
的原因是 的溶解度小于
的溶解度小于
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为 、
、 、
、 、
、
Ⅰ.如图为钠的价类二维图。

(1)若①处是淡黄色固体,其化学式为
(2)氢化钠(NaH)能与水反应生成氢氧化钠和氢气,写出该反应的化学方程式:
(3)钠钾合金可用作原子反应堆的导热剂的原因除了钠钾合金是难气化的液态合金,还有可能是
Ⅱ.我国化学家侯德榜发明了联合制碱法(
 ),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去,
),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去, 极易溶于水,其水溶液呈碱性)。
极易溶于水,其水溶液呈碱性)。
(4)流程图中标注的物质属于电解质的有
(5)煅烧
 固体的化学方程式为
固体的化学方程式为(6)关于上述流程,下列说法中正确的是
a.两种气体的先后顺序为先通入
 再通入
再通入
b.先析出
 的原因是
的原因是 的溶解度小于
的溶解度小于
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为
 、
、 、
、 、
、
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】碲化锌 可用作半导体和红外材料。以一种锌合金废渣
可用作半导体和红外材料。以一种锌合金废渣 主要含锌、铝、铜、镁,还含少量铁
主要含锌、铝、铜、镁,还含少量铁 制备碲化锌的工艺流程如下:
制备碲化锌的工艺流程如下:

已知:常温下,金属离子开始沉淀和沉淀完全时的pH及氢氧化物的 如下表所示:
如下表所示:
请回答下列问题:
(1) 与
与 同主族,则
同主族,则 在元素周期表中的位置是
在元素周期表中的位置是______________ 。
(2)滤渣1的主要成分是_______________  填化学式
填化学式 。
。
(3) “灼烧”时,用到的硅酸盐仪器有泥三角、玻璃棒、_____ 、_____ 。
(4) “氧化”时,若试剂X为 ,则该过程中发生反应的离子方程式为
,则该过程中发生反应的离子方程式为_________________ 。
(5)常温下,“沉淀1”中加 调节pH的范围是
调节pH的范围是_____________ 。若向含相同浓度的 、
、 混合溶液中滴加氨水,当
混合溶液中滴加氨水,当 刚好沉淀完全时,
刚好沉淀完全时,
___________ mol·L-1,当离子浓度小于等于1.0×10-5mol·L-1,时,认为离子沉淀完全 。
。
(6)Zn与Al性质相似,其氧化物和氢氧化物都具有两性。常温下“沉淀2”中___________  填“能”或“不能”
填“能”或“不能” 加KOH调节pH,其原因是
加KOH调节pH,其原因是____________________________ 。
(7)将滤液3加入相应试剂调配后,再蒸发浓缩可以制得晶体nK2SO4·mMgSO4·xH2O。称取 该晶体溶于水配成
该晶体溶于水配成 溶液,再将该溶液分成两等份,向其中一份溶液中滴加50mL1.0mol·L-1NaOH溶液,恰好沉淀完全,向另一份溶液中滴加足量
溶液,再将该溶液分成两等份,向其中一份溶液中滴加50mL1.0mol·L-1NaOH溶液,恰好沉淀完全,向另一份溶液中滴加足量 溶液充分反应后,过滤、洗涤、干燥,称得固体质量为
溶液充分反应后,过滤、洗涤、干燥,称得固体质量为 ,则该晶体的化学式为
,则该晶体的化学式为_______________ 。
 可用作半导体和红外材料。以一种锌合金废渣
可用作半导体和红外材料。以一种锌合金废渣 主要含锌、铝、铜、镁,还含少量铁
主要含锌、铝、铜、镁,还含少量铁 制备碲化锌的工艺流程如下:
制备碲化锌的工艺流程如下:
已知:常温下,金属离子开始沉淀和沉淀完全时的pH及氢氧化物的
 如下表所示:
如下表所示:| 金属离子 | 开始沉淀pH | 沉淀完全pH |  |
 |  | 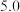 | 1.0×10-32 |
 |  |  | 3.5×10-38 |
 |  |  | 1.8×10-11 |
 | 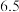 |  | 1.2×10-17 |
请回答下列问题:
(1)
 与
与 同主族,则
同主族,则 在元素周期表中的位置是
在元素周期表中的位置是(2)滤渣1的主要成分是
 填化学式
填化学式 。
。(3) “灼烧”时,用到的硅酸盐仪器有泥三角、玻璃棒、
(4) “氧化”时,若试剂X为
 ,则该过程中发生反应的离子方程式为
,则该过程中发生反应的离子方程式为(5)常温下,“沉淀1”中加
 调节pH的范围是
调节pH的范围是 、
、 混合溶液中滴加氨水,当
混合溶液中滴加氨水,当 刚好沉淀完全时,
刚好沉淀完全时,
 。
。(6)Zn与Al性质相似,其氧化物和氢氧化物都具有两性。常温下“沉淀2”中
 填“能”或“不能”
填“能”或“不能” 加KOH调节pH,其原因是
加KOH调节pH,其原因是(7)将滤液3加入相应试剂调配后,再蒸发浓缩可以制得晶体nK2SO4·mMgSO4·xH2O。称取
 该晶体溶于水配成
该晶体溶于水配成 溶液,再将该溶液分成两等份,向其中一份溶液中滴加50mL1.0mol·L-1NaOH溶液,恰好沉淀完全,向另一份溶液中滴加足量
溶液,再将该溶液分成两等份,向其中一份溶液中滴加50mL1.0mol·L-1NaOH溶液,恰好沉淀完全,向另一份溶液中滴加足量 溶液充分反应后,过滤、洗涤、干燥,称得固体质量为
溶液充分反应后,过滤、洗涤、干燥,称得固体质量为 ,则该晶体的化学式为
,则该晶体的化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室以电镀废渣(Cr2O3、CuO、CaO 不含其它难溶于水的杂质)为原料制取铜粉和K2Cr2O7的主要流程如下:

(1) “酸浸”时,得到的残渣的成分是___________
(2) “制铜氨液”,即制取[Cu(NH3)4]SO4溶液时,采用 8 mol·L-1氨水,适量 30% H2O2,并通入 O2,控制温度为 55 ℃。温度不宜过高,这是因为___________ 。
(3) “沉 CuNH4SO3”时可用如下装置(夹持、加热仪器略):

①“沉 CuNH4SO3”时,反应液需控制在 45 ℃,合适的加热方式是___________ 。
②实验中向三颈瓶中通入 SO2将[Cu(NH3)4]SO4转化为 CuNH4SO3,每沉淀 1molCuNH4SO3需要消耗 SO2的物质的量为___________
(4)已知:①碱性条件下,H2O2可将+3 价的 Cr 氧化为 CrO ;酸性条件下,H2O2可将+6 价的 Cr 还原为+3 价的 Cr;+6 价的 Cr 在溶液 pH<5 时,主要以 Cr2O
;酸性条件下,H2O2可将+6 价的 Cr 还原为+3 价的 Cr;+6 价的 Cr 在溶液 pH<5 时,主要以 Cr2O 的形式存在;在pH>7 时,主要以 CrO
的形式存在;在pH>7 时,主要以 CrO 的形式存在。部分物质溶解度曲线如图所示
的形式存在。部分物质溶解度曲线如图所示
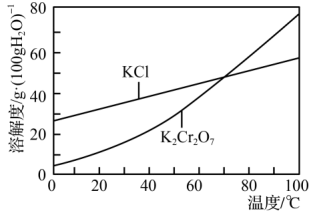
可用 Cr(OH)3为原料,制取 K2Cr2O7的实验是将原料置于烧杯中,加适量的水调成浆状后加入如下试剂及必要操作得到 K2Cr2O7 溶液。
①实验中必须使用的试剂:
A、KOH 溶液;B、10%H2O2溶液;C、稀盐酸
写出上述实验过程中加药先后顺序为___________ (填字母)
②从K2Cr2O7溶液中得到 K2Cr2O7晶体的实验操作为___________

(1) “酸浸”时,得到的残渣的成分是
(2) “制铜氨液”,即制取[Cu(NH3)4]SO4溶液时,采用 8 mol·L-1氨水,适量 30% H2O2,并通入 O2,控制温度为 55 ℃。温度不宜过高,这是因为
(3) “沉 CuNH4SO3”时可用如下装置(夹持、加热仪器略):

①“沉 CuNH4SO3”时,反应液需控制在 45 ℃,合适的加热方式是
②实验中向三颈瓶中通入 SO2将[Cu(NH3)4]SO4转化为 CuNH4SO3,每沉淀 1molCuNH4SO3需要消耗 SO2的物质的量为
(4)已知:①碱性条件下,H2O2可将+3 价的 Cr 氧化为 CrO
 ;酸性条件下,H2O2可将+6 价的 Cr 还原为+3 价的 Cr;+6 价的 Cr 在溶液 pH<5 时,主要以 Cr2O
;酸性条件下,H2O2可将+6 价的 Cr 还原为+3 价的 Cr;+6 价的 Cr 在溶液 pH<5 时,主要以 Cr2O 的形式存在;在pH>7 时,主要以 CrO
的形式存在;在pH>7 时,主要以 CrO 的形式存在。部分物质溶解度曲线如图所示
的形式存在。部分物质溶解度曲线如图所示
可用 Cr(OH)3为原料,制取 K2Cr2O7的实验是将原料置于烧杯中,加适量的水调成浆状后加入如下试剂及必要操作得到 K2Cr2O7 溶液。
①实验中必须使用的试剂:
A、KOH 溶液;B、10%H2O2溶液;C、稀盐酸
写出上述实验过程中加药先后顺序为
②从K2Cr2O7溶液中得到 K2Cr2O7晶体的实验操作为
您最近一年使用:0次
【推荐2】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:

流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________ 等。
(2)加入H2O2的目的是____________ ,所发生的离子方程式为____________________ 。
(3)“除铁”时,控制溶液pH的范围为_____________________ 。
(4)滤渣B的主要成分的化学式为___________________ ,滤液中的阳离子有________ 。
(5)“氧化”生成Ni2O3的离子方程式为________________ 。

流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2的目的是
(3)“除铁”时,控制溶液pH的范围为
(4)滤渣B的主要成分的化学式为
(5)“氧化”生成Ni2O3的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】设计了如图所示的实验装置模拟工业生产制备少量硝酸。
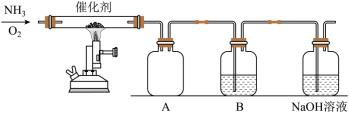
(1)工业上合成氨气的方程式为:_____ 。
(2)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是_____ 反应(填“吸热”或“放热”),反应的化学方程式是_____ 。
(3)B可以制备少量的硝酸,则试剂为_____ ,可能发生的反应为_____ 。
(4)NaOH溶液的作用是_____ 。
(5)控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是_____ ,白烟的化学式是_____ 。
(6)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO=2CO2+N2,当生成1molN2时,被还原的NO为_____ mol。
(7)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+_____→_____+_____+N2O↑+H2O_____
配平其离子方程式:____Fe2++____NO +____H+=_____Fe3++____N2O↑+____H2O。
+____H+=_____Fe3++____N2O↑+____H2O。_____

(1)工业上合成氨气的方程式为:
(2)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是
(3)B可以制备少量的硝酸,则试剂为
(4)NaOH溶液的作用是
(5)控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是
(6)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO=2CO2+N2,当生成1molN2时,被还原的NO为
(7)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+_____→_____+_____+N2O↑+H2O
配平其离子方程式:____Fe2++____NO
 +____H+=_____Fe3++____N2O↑+____H2O。
+____H+=_____Fe3++____N2O↑+____H2O。
您最近一年使用:0次



