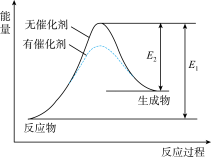
下列有关有效碰撞理论和活化能的认识,正确的是
| A.增大压强(对于气体反应),活化分子百分数增大,故反应速率增大 |
| B.温度升高,分子动能增加,反应所需活化能减小,故反应速率增大 |
| C.选用适当的催化剂,可以降低反应的活化能和焓变 |
| D.H+和 OH-的反应活化能接近于零,反应几乎在瞬间完成 |
更新时间:2023-10-24 16:08:49
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列说法错误的是
①当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
②发生有效碰撞的分子一定是活化分子
③活化分子间的碰撞一定是有效碰撞
④活化分子间每次碰撞都发生化学反应
⑤能发生有效碰撞的分子必须具有相当高的能量
⑥活化能指活化分子多出反应物分子平均能量的那部分能量
①当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
②发生有效碰撞的分子一定是活化分子
③活化分子间的碰撞一定是有效碰撞
④活化分子间每次碰撞都发生化学反应
⑤能发生有效碰撞的分子必须具有相当高的能量
⑥活化能指活化分子多出反应物分子平均能量的那部分能量
| A.①④ | B.③④ | C.④⑤⑥ | D.②⑤ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】一定条件下,在恒压绝热容器中发生反应:N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ·mol-1.下列说法正确的是
2NH3(g) ∆H=-92.4kJ·mol-1.下列说法正确的是
 2NH3(g) ∆H=-92.4kJ·mol-1.下列说法正确的是
2NH3(g) ∆H=-92.4kJ·mol-1.下列说法正确的是| A.达到化学平衡状态时,v正(N2)=3v逆(H2) |
| B.容器内的压强不再变化说明反应达到化学平衡状态 |
| C.向容器中充入He气体,正反应速率减小,逆反应速率减小 |
| D.加入1molN2和3molH2,充分反应后放出热量92.4kJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知反应: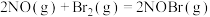
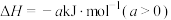 ,其反应机理如下:
,其反应机理如下:
①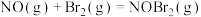
 快反应;
快反应;
②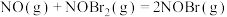
 慢反应。
慢反应。
下列说法不正确的是
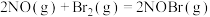
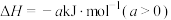 ,其反应机理如下:
,其反应机理如下:①
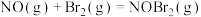
 快反应;
快反应;②
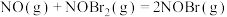
 慢反应。
慢反应。下列说法不正确的是
A.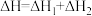 |
| B.该反应的反应速率主要取决于反应② |
| C.NOBr2是该反应的中间产物,不是催化剂 |
| D.恒容时,增大Br2(g)的浓度能增加单位体积内活化分子百分数,加快反应速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法中正确的是( )
| A.增大反应物浓度,使活化分子百分数增大,化学反应速率增大 |
| B.升高温度,反应物分子中活化分子的百分数增大,从而增大化学反应速率 |
| C.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
| D.有气体参加的反应,压强增大时,活化分子百分数一定增加,从而使反应速率增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】我国科学家合成了Y、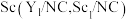 单原子催化剂,用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法中错误的是
单原子催化剂,用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法中错误的是
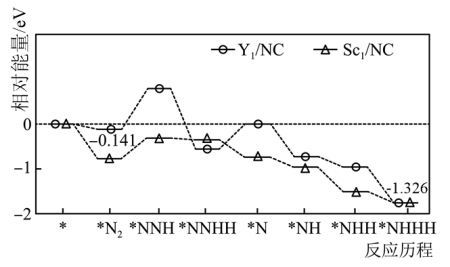
 单原子催化剂,用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法中错误的是
单原子催化剂,用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法中错误的是
A.相同条件下,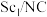 比 比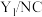 催化剂更利于吸附氮气 催化剂更利于吸附氮气 |
| B.实际生产中将催化剂的尺寸处理成纳米级颗粒可提高氨气的平衡转化率 |
C.使用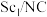 单原子催化剂,反应的快慢由生成 单原子催化剂,反应的快慢由生成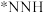 的速率决定 的速率决定 |
| D.工业合成氨与电化学催化还原氮气均涉及到共价键的断裂与形成 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】2-甲基丙烯与HCl的加成反应有两种产物,这两种加成反应过程与其相应的能量变化曲线关系如下图所示。在恒容绝热密闭容器中通入一定量的2-甲基丙烯与HCl的混合物进行有关反应。下列说法正确的是
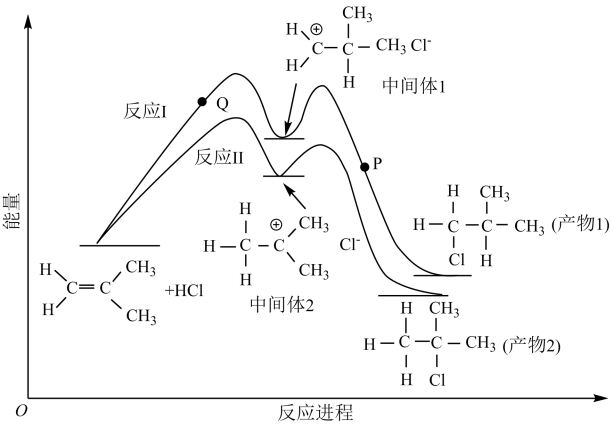

| A.产物稳定性的强弱:产物1>产物2 |
| B.反应的活化能大小:反应I>反应II |
| C.升高温度,反应I的逆反应速率变化值小于反应II的逆反应速率变化值 |
D.2-甲基丙烯与 的加成反应产物中, 的加成反应产物中,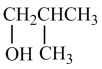 更稳定 更稳定 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】某科研团队合作开发了活性位点催化剂,先“吸氢”再将硝基化合物转化为氨基化合物,反应历程和每步的活化能如图所示:
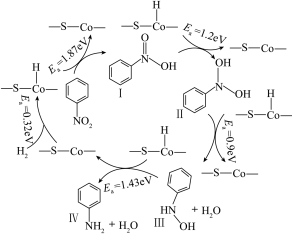
下列说法正确的是

下列说法正确的是
A.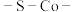 是该反应历程的中间产物 是该反应历程的中间产物 |
| B.提高Ⅲ→Ⅳ的反应速率,对快速提升总反应速率起决定性作用 |
C.I→Ⅱ→Ⅲ→Ⅳ的转化过程中, 元素的化合价逐渐降低 元素的化合价逐渐降低 |
D.总反应为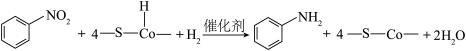 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列选项中的原因或结论与现象不对应的是
| 选项 | 现象 | 原因或结论 |
| A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
| B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) N2O4(g)ΔH<0,平衡向生成NO2方向移动 N2O4(g)ΔH<0,平衡向生成NO2方向移动 |
| C | 在密闭容器中有反应:A+xB(g) 2C(g)达到平衡时测得c(A)为0.5 mol·L-1,恒温条件下将容器容积扩大到原来的两倍,测得c(A)为0.4 mol·L-1 2C(g)达到平衡时测得c(A)为0.5 mol·L-1,恒温条件下将容器容积扩大到原来的两倍,测得c(A)为0.4 mol·L-1 | A为非气体、x=1 |
| D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次