化学工业为世界能源消费生产了多种能源物质。
(1)在常温常压下, 和
和 的混合气体共
的混合气体共 完全燃烧生成
完全燃烧生成 和液态水放出
和液态水放出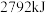 的热量。
的热量。
已知: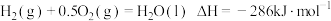 ;
;
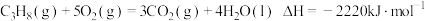 。
。
则该混合气体中, 和
和 的体积比为
的体积比为___________ 。
(2)一种利用太阳能将甲烷重整制氢原理的示意图如下:

①第Ⅰ步反应的还原剂是___________ 。
②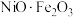 在整个反应过程中的作用是
在整个反应过程中的作用是___________ 。
③反应每消耗 ,理论上可生成标准状况下
,理论上可生成标准状况下 的体积为
的体积为___________ 。
(3)在催化剂光照条件下,CO2和H2O可转化为CH3OH,该反应的化学方程式为: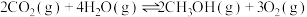 。一定条件下,在
。一定条件下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 水蒸气进行上述反应,测得
水蒸气进行上述反应,测得 随时间的变化如下表所示:
随时间的变化如下表所示:
①用H2O(g)表示0~3min内该反应的平均反应速率为___________ 。
②第4分钟时
___________ 。(填“>”“<”或“=”)第3分钟时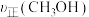 。
。
③能说明该反应已达到平衡状态的是___________ 。
A.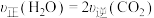 B.
B.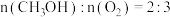
C.容器内密度保持不变 D.容器内四种物质共存
④上述反应达到平衡时二氧化碳的转化率为___________ 。
(1)在常温常压下,
 和
和 的混合气体共
的混合气体共 完全燃烧生成
完全燃烧生成 和液态水放出
和液态水放出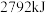 的热量。
的热量。已知:
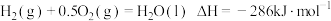 ;
;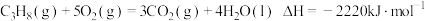 。
。则该混合气体中,
 和
和 的体积比为
的体积比为(2)一种利用太阳能将甲烷重整制氢原理的示意图如下:

①第Ⅰ步反应的还原剂是
②
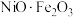 在整个反应过程中的作用是
在整个反应过程中的作用是③反应每消耗
 ,理论上可生成标准状况下
,理论上可生成标准状况下 的体积为
的体积为(3)在催化剂光照条件下,CO2和H2O可转化为CH3OH,该反应的化学方程式为:
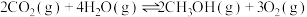 。一定条件下,在
。一定条件下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 水蒸气进行上述反应,测得
水蒸气进行上述反应,测得 随时间的变化如下表所示:
随时间的变化如下表所示:时间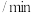 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
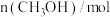 | 0.00 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
②第4分钟时

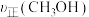 。
。③能说明该反应已达到平衡状态的是
A.
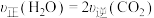 B.
B.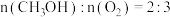
C.容器内密度保持不变 D.容器内四种物质共存
④上述反应达到平衡时二氧化碳的转化率为
更新时间:2023-10-04 10:43:07
|
相似题推荐
【推荐1】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物 排放的控制与监测已刻不容缓。回答下列问题:
排放的控制与监测已刻不容缓。回答下列问题:
 平板玻璃熔窑烟气中的
平板玻璃熔窑烟气中的 以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成
以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成 ,该氧化剂的分子式为
,该氧化剂的分子式为______ 。
 用
用 催化还原
催化还原 可在一定程度上消除氮氧化物的污染。
可在一定程度上消除氮氧化物的污染。
已知: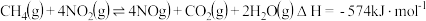
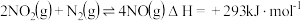
则反应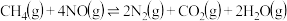 的
的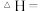
______  。
。
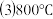 时,在刚性反应器中以投料比为1:1的
时,在刚性反应器中以投料比为1:1的 与
与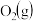 反应:
反应:

其中 二聚为
二聚为 的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示
的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示 时,
时, 完全反应
完全反应 。
。
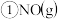 与
与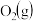 合成的反应速率
合成的反应速率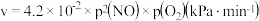 ,
,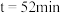 时,测得体系中
时,测得体系中 ,则此时的
,则此时的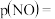
______ kPa,
______ 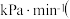 计算结果保留1位小数
计算结果保留1位小数 。
。
 若升高反应温度至
若升高反应温度至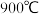 ,则
,则 与
与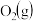 完全反应后体系压强
完全反应后体系压强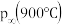
______  填“大于”“等于”或“小于”
填“大于”“等于”或“小于”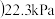 ,原因是
,原因是______ 。
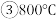 时,反应
时,反应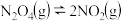 的平衡常数
的平衡常数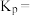
______  为以分压表示的平衡常数,计算结果保留2位小数
为以分压表示的平衡常数,计算结果保留2位小数 。
。
 对于反应
对于反应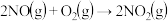 ,科研工作者提出如下反应历程:
,科研工作者提出如下反应历程:
第一步: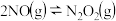 快速平衡
快速平衡
第二步: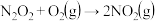 慢反应
慢反应
下列表述正确的是______  填标号
填标号 。
。
A.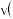 第一步的逆反应
第一步的逆反应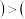 第二步反应
第二步反应
B.反应的中间产物为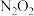
C.第二步中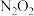 与
与 的碰撞全部有效
的碰撞全部有效
D.第二步反应活化能较低
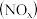 排放的控制与监测已刻不容缓。回答下列问题:
排放的控制与监测已刻不容缓。回答下列问题: 平板玻璃熔窑烟气中的
平板玻璃熔窑烟气中的 以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成
以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成 ,该氧化剂的分子式为
,该氧化剂的分子式为 用
用 催化还原
催化还原 可在一定程度上消除氮氧化物的污染。
可在一定程度上消除氮氧化物的污染。已知:
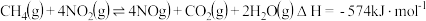
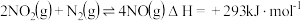
则反应
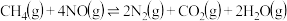 的
的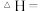
 。
。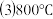 时,在刚性反应器中以投料比为1:1的
时,在刚性反应器中以投料比为1:1的 与
与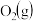 反应:
反应:
其中
 二聚为
二聚为 的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示
的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示 时,
时, 完全反应
完全反应 。
。 | 0 | 40 | 80 | 160 | 260 | 700 | |
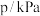 | 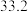 | 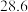 | 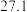 |  | 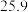 | 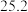 | 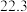 |
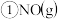 与
与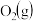 合成的反应速率
合成的反应速率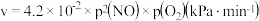 ,
,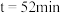 时,测得体系中
时,测得体系中 ,则此时的
,则此时的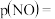

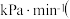 计算结果保留1位小数
计算结果保留1位小数 。
。 若升高反应温度至
若升高反应温度至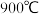 ,则
,则 与
与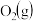 完全反应后体系压强
完全反应后体系压强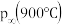
 填“大于”“等于”或“小于”
填“大于”“等于”或“小于”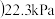 ,原因是
,原因是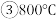 时,反应
时,反应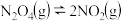 的平衡常数
的平衡常数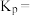
 为以分压表示的平衡常数,计算结果保留2位小数
为以分压表示的平衡常数,计算结果保留2位小数 。
。 对于反应
对于反应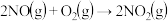 ,科研工作者提出如下反应历程:
,科研工作者提出如下反应历程:第一步:
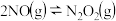 快速平衡
快速平衡第二步:
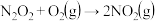 慢反应
慢反应下列表述正确的是
 填标号
填标号 。
。A.
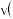 第一步的逆反应
第一步的逆反应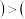 第二步反应
第二步反应
B.反应的中间产物为
C.第二步中
 与
与 的碰撞全部有效
的碰撞全部有效D.第二步反应活化能较低
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】采用H2或CO催化还原NO以达到消除污染的目的,在氮氧化物尾气处理领域有着广泛应用。回答下列问题:
(1)用CO处理NO时产生两种无毒、无害的气体,该反应的氧化产物为___________ 。
(2)已知:氢气的燃烧热为285.8kJ/mol
2NO(g)=N2(g)+O2(g) △H=-180.5 kJ/mol
H2O(g)=H2O(1) △H=-44 k/mol
写出用H2处理NO生成水蒸气和1molN2的热化学方程式______________________ 。
(3)针对上述H2处理NO生成水蒸气和1molN2的反应,回答下列问题:
①研究表明,上述反应中,正反应速率为v正=k正c2(NO)c2(H2),其中k正为速率常数,此处只与温度有关。当t=t1时,v正=v1,若此刻保持温度不变,将c(NO)增大到原来的2倍,c(H2)减少为原来的1/2,v正=v2。则有v1_______ v2(填“>”、“<”或“=”)
②在温度T下,容积固定的密闭容器中充入3molNO和2molH2发生上述反应,起始压强为p0,一段时间后,反应达到平衡,此时压强p=0.9p0,则NO的平衡转化率a(NO)=___________ (结果保留三位有效数字),该反应的平衡常数Kp=___________ (用含p的代数式表示,Kp为以分压表示的平衡常数,且某气体的分压=总压×该气体的物质的量分数)
(4)实验室常用NaOH溶液吸收法处理NOx,反应方程式如下:(已知:NO不能与NaOH溶液反应。)
NO+NO2+ 2NaOH= 2NaNO2 +H2O
2NO2+ 2Naoh= NaNO2+ NaNO3+ H2O
①若NOx(此处为NO和NO2的混合气体)能被NaOH溶液完全吸收,则x的取值范围为___________ 。
② 1molNO2和溶质物质的量为1mol的NaOH溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序为______________________ 。
(5)一氧化氮-空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如果所示,写出放电过程中负极的电极反应式___________ ,若过程中产生2molHNO3,则消耗标准状况下O2的体积为___________ L。

(1)用CO处理NO时产生两种无毒、无害的气体,该反应的氧化产物为
(2)已知:氢气的燃烧热为285.8kJ/mol
2NO(g)=N2(g)+O2(g) △H=-180.5 kJ/mol
H2O(g)=H2O(1) △H=-44 k/mol
写出用H2处理NO生成水蒸气和1molN2的热化学方程式
(3)针对上述H2处理NO生成水蒸气和1molN2的反应,回答下列问题:
①研究表明,上述反应中,正反应速率为v正=k正c2(NO)c2(H2),其中k正为速率常数,此处只与温度有关。当t=t1时,v正=v1,若此刻保持温度不变,将c(NO)增大到原来的2倍,c(H2)减少为原来的1/2,v正=v2。则有v1
②在温度T下,容积固定的密闭容器中充入3molNO和2molH2发生上述反应,起始压强为p0,一段时间后,反应达到平衡,此时压强p=0.9p0,则NO的平衡转化率a(NO)=
(4)实验室常用NaOH溶液吸收法处理NOx,反应方程式如下:(已知:NO不能与NaOH溶液反应。)
NO+NO2+ 2NaOH= 2NaNO2 +H2O
2NO2+ 2Naoh= NaNO2+ NaNO3+ H2O
①若NOx(此处为NO和NO2的混合气体)能被NaOH溶液完全吸收,则x的取值范围为
② 1molNO2和溶质物质的量为1mol的NaOH溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序为
(5)一氧化氮-空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如果所示,写出放电过程中负极的电极反应式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】CO、CH4和N2H4都可以作为燃料。回答下列问题:
(1)工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H=+206.4kJ·mol-1。该反应能自发进行的条件为_______ 。(选填“任何条件”、“低温”、“高温”、“任何条件均不能自发”)
(2)对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是_______ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)恒温恒容条件下,以下能说明该反应达到平衡状态的是_______ 。
a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为_______ 。
(1)工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H=+206.4kJ·mol-1。该反应能自发进行的条件为
(2)对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)恒温恒容条件下,以下能说明该反应达到平衡状态的是
a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____ CO2↑+ ____ MnSO4 + ____ K2SO4+ ____ H2O
(2)焦炭可用于制取水煤气。测得12 g碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为______________________________________________________ 。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) △H=akJ/mol 。
CH3OH(g) △H=akJ/mol 。
下表所列数据是反应在不同温度下的化学平衡常数(K)。
①判断反应达到平衡状态的依据是_____________ 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c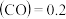 mol/L,则以H2表示的反应速率v(H2)=
mol/L,则以H2表示的反应速率v(H2)=___________ 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和Na2CO3 的熔融盐混合物作电解质, CO为负极燃气,空气与CO2的
混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其正极反应式:
O2 + 2CO2+4e-=2CO32- ,则 负极反应式:______________________________________ 。
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=
BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=___________ 。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(2)焦炭可用于制取水煤气。测得12 g碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为
(3)工业上在恒容密闭容器中用下列反应合成甲醇:
CO(g)+2H2(g)
 CH3OH(g) △H=akJ/mol 。
CH3OH(g) △H=akJ/mol 。下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①判断反应达到平衡状态的依据是
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c
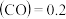 mol/L,则以H2表示的反应速率v(H2)=
mol/L,则以H2表示的反应速率v(H2)=(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和Na2CO3 的熔融盐混合物作电解质, CO为负极燃气,空气与CO2的
混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其正极反应式:
O2 + 2CO2+4e-=2CO32- ,则 负极反应式:
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)
 BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=
BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮及其化合物在工农业生产和生命活动中起着重要的作用。同时,氮氧化物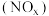 是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物
是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物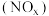 的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
用 还原氮氧化物
还原氮氧化物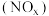 是消除氮氧化物
是消除氮氧化物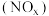 污染的重要方法。
污染的重要方法。
已知 还原
还原 的反应原理如下:
的反应原理如下:
①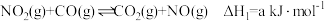
②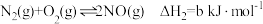
③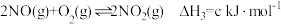
(1) 与
与 反应生成无污染气体的热化学方程式为
反应生成无污染气体的热化学方程式为_______ 。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向 恒容的密闭容器中加入足量的活性炭和一定量的
恒容的密闭容器中加入足量的活性炭和一定量的 ,发生反应:
,发生反应: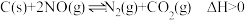 。其中
。其中 和
和 的物质的量变化如下表所示。
的物质的量变化如下表所示。
①根据上表数据分析 时,该反应在
时,该反应在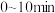 内的平均反应速率
内的平均反应速率
_______ ; 时反应的平衡常数
时反应的平衡常数
_______ 。
② 后,只改变某一条件,根据上表的数据判断改变的条件可能是
后,只改变某一条件,根据上表的数据判断改变的条件可能是_______ (填字母)。
A.适当升高温度 B.加入合适的催化剂 C.加入一定的固体碳 D.移走一定量的
(3)工业上通常采用氨还原法脱硝: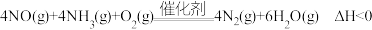 脱硝效率与氨物质的量之比及温度的变化关系如图1所示,据图示可知氨氮物质的量之比一定时,在
脱硝效率与氨物质的量之比及温度的变化关系如图1所示,据图示可知氨氮物质的量之比一定时,在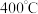 时,脱硝效率最大,其可能的原因是
时,脱硝效率最大,其可能的原因是_______ 。

(4)一种电解法间接除 的工作原理如图2示,已知:
的工作原理如图2示,已知: 是一种弱酸。
是一种弱酸。

①电解时的阴极电极反应式为_______ 。
②电路中转移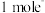 ,理论上可以除去
,理论上可以除去_______ 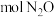 。
。
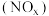 是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物
是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物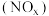 的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:用
 还原氮氧化物
还原氮氧化物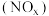 是消除氮氧化物
是消除氮氧化物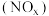 污染的重要方法。
污染的重要方法。已知
 还原
还原 的反应原理如下:
的反应原理如下:①
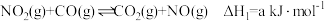
②
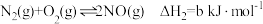
③
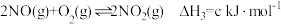
(1)
 与
与 反应生成无污染气体的热化学方程式为
反应生成无污染气体的热化学方程式为(2)用活性炭还原法也可以处理氮氧化物,某研究小组向
 恒容的密闭容器中加入足量的活性炭和一定量的
恒容的密闭容器中加入足量的活性炭和一定量的 ,发生反应:
,发生反应: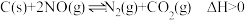 。其中
。其中 和
和 的物质的量变化如下表所示。
的物质的量变化如下表所示。物质的量/ |  | 改变某一条件 | |||||
| 0 |  |  |  |  |  |  | |
 | 2.0 | 1.16 | 0.80 | 0.80 | 0.60 | 0.50 | 0.50 |
 | 0 | 0.42 | 0.60 | 0.60 | 0.70 | 0.75 | 0.75 |
①根据上表数据分析
 时,该反应在
时,该反应在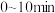 内的平均反应速率
内的平均反应速率
 时反应的平衡常数
时反应的平衡常数
②
 后,只改变某一条件,根据上表的数据判断改变的条件可能是
后,只改变某一条件,根据上表的数据判断改变的条件可能是A.适当升高温度 B.加入合适的催化剂 C.加入一定的固体碳 D.移走一定量的

(3)工业上通常采用氨还原法脱硝:
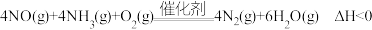 脱硝效率与氨物质的量之比及温度的变化关系如图1所示,据图示可知氨氮物质的量之比一定时,在
脱硝效率与氨物质的量之比及温度的变化关系如图1所示,据图示可知氨氮物质的量之比一定时,在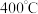 时,脱硝效率最大,其可能的原因是
时,脱硝效率最大,其可能的原因是
(4)一种电解法间接除
 的工作原理如图2示,已知:
的工作原理如图2示,已知: 是一种弱酸。
是一种弱酸。
①电解时的阴极电极反应式为
②电路中转移
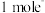 ,理论上可以除去
,理论上可以除去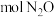 。
。
您最近一年使用:0次
【推荐3】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
(1)在上图构想的物质和能量循环中太阳能最终转化为__________ 能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
①平衡时,氧气的物质的量浓度为____ ;用H2O(g)表示0~3 min内该反应的平均反应速率为_____ 。
②能说明该反应已达到平衡状态的是_____________ 。
A.n(CH3OH) :n(O2)=2 :3 B.容器内气体密度保持不变
C.容器内气体压强保持不变 D.υ正(H2O)=2υ逆(CO2)
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则氧气应通入该燃料电池的________ 极(填“正”或“负”),通入甲醇的一极的电极反应式为________________ 。

(1)在上图构想的物质和能量循环中太阳能最终转化为
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)
 2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
②能说明该反应已达到平衡状态的是
A.n(CH3OH) :n(O2)=2 :3 B.容器内气体密度保持不变
C.容器内气体压强保持不变 D.υ正(H2O)=2υ逆(CO2)
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则氧气应通入该燃料电池的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】 是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
Ⅰ.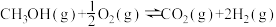 的能量变化如图所示。
的能量变化如图所示。
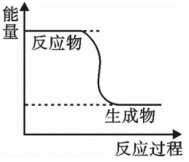
(1)下列说法错误的是___________(填字母)。
Ⅱ. 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、
燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、 (电解质溶液)构成,其中负极反应式为
(电解质溶液)构成,其中负极反应式为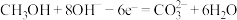 .
.
(2)下列说法正确的是___________ (填序号)。
①电池放电时通入空气的电极为正极
②电池放电时,电解质溶液的碱性逐渐增强
③电池放电时每消耗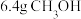 转移1.2
转移1.2 电子
电子
Ⅲ.将 转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入
转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入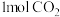 和
和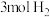 ,一定条件下发生反应:
,一定条件下发生反应: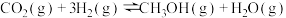
该反应一般认为通过如下分步反应来实现:
①
②
上述反应的能量变化如图所示。
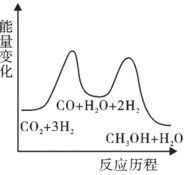
(3)则上述分步反应②为___________ (填吸热或放热)反应。
(4)测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
①a=___________ ;3~6 内,
内,
___________  。
。
②能说明上述反应达到平衡状态的是___________ (填标号)。
A.混合气体的压强不随时间的变化而变化
B.反应中 与
与 的物质的量浓度之比为1:1
的物质的量浓度之比为1:1
C.单位时间内生成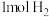 ,同时生成
,同时生成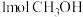
D.混合气体的平均相对分子质量不随时间的变化而变化
③上述反应12 末时,混合气体中
末时,混合气体中 和
和 的物质的量之比是
的物质的量之比是___________ , 的体积分数是
的体积分数是___________ 。
④第3 时
时
___________ (填“>”、“<”、“=”或“无法比较”)第9 时
时 。
。
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。Ⅰ.
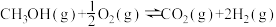 的能量变化如图所示。
的能量变化如图所示。(1)下列说法错误的是___________(填字母)。

A. 转变成 转变成 的过程是一个吸收能量的过程 的过程是一个吸收能量的过程 |
B. 的生成速率与 的生成速率与 的消耗速率之比为1:2 的消耗速率之比为1:2 |
| C.化学变化不仅有新物质生成,同时也伴随着能量变化 |
D.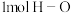 键断裂的同时有 键断裂的同时有 键断裂,则反应达到平衡状态 键断裂,则反应达到平衡状态 |
Ⅱ.
 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、
燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、 (电解质溶液)构成,其中负极反应式为
(电解质溶液)构成,其中负极反应式为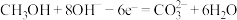 .
.(2)下列说法正确的是
①电池放电时通入空气的电极为正极
②电池放电时,电解质溶液的碱性逐渐增强
③电池放电时每消耗
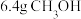 转移1.2
转移1.2 电子
电子Ⅲ.将
 转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入
转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入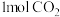 和
和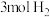 ,一定条件下发生反应:
,一定条件下发生反应: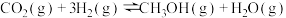
该反应一般认为通过如下分步反应来实现:
①

②

上述反应的能量变化如图所示。

(3)则上述分步反应②为
(4)测得
 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0 | 3 | 6 | 9 | 12 |
 | 0 | 0.50 | 0.65 | 0.74 | 0.74 |
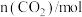 | 1 | 0.50 | a | 0.26 | 0.26 |
①a=
 内,
内,
 。
。②能说明上述反应达到平衡状态的是
A.混合气体的压强不随时间的变化而变化
B.反应中
 与
与 的物质的量浓度之比为1:1
的物质的量浓度之比为1:1C.单位时间内生成
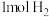 ,同时生成
,同时生成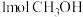
D.混合气体的平均相对分子质量不随时间的变化而变化
③上述反应12
 末时,混合气体中
末时,混合气体中 和
和 的物质的量之比是
的物质的量之比是 的体积分数是
的体积分数是④第3
 时
时
 时
时 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如表,请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式: ∆H=
∆H=_______ kJ·mol-1
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则示意图符合题意的是_______ (填选项序号)。(图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
A.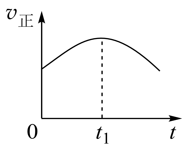 B.
B. 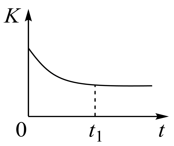 C.
C. 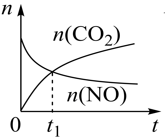 D.
D. 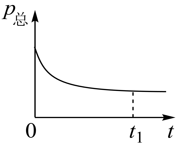
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO,测得不同时间NO和CO的物质的量如表,t1℃时该反应的平衡常数K=_______ ,既能增大反应速率又能使平衡正向移动的措施是_______ 。(写出一种即可)
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响_______ ,给出合理的解释:_______ 。

(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如表,请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式:
 ∆H=
∆H=| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(kJ/mol) | 632 | 1072 | 750 | 946 |
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则示意图符合题意的是
A.
 B.
B.  C.
C.  D.
D. 
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO,测得不同时间NO和CO的物质的量如表,t1℃时该反应的平衡常数K=
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g) CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
①K的表达式为____________________ ;
②该反应的正反应为__________ 反应(“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是____________ (填字母代号)。
A.容器中压强不变 B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl,溶液呈碱性的有__________ (填序号);常温下0.01 mol/L HCl溶液的pH=________ ;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________ 。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
①若向该溶液中滴加NaOH溶液,则先沉淀的是____________ (填离子符号);
②判断Ksp[Mg(OH)2]____________ Ksp[Fe(OH)2](填“>”、“=”或“<”)。
(4)电解装置如图所示:

①当用惰性电极电解时,d电极的反应式为____________ ;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量发现两极质量差为16 g,则电路中转移的电子为____________ mol。
 CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下:| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为
②该反应的正反应为
③下列选项中,能判断该反应已经达到化学平衡状态的是
A.容器中压强不变 B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl,溶液呈碱性的有
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是
②判断Ksp[Mg(OH)2]
(4)电解装置如图所示:

①当用惰性电极电解时,d电极的反应式为
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量发现两极质量差为16 g,则电路中转移的电子为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】我国力争于2030年前实现碳达峰,2060年前实现碳中和,在这种背景下,CO2的利用和转化成为研究重点。回答下列问题:
(1)2021年9月,我国科学家在《科学》杂志发表了二氧化碳人工合成淀粉的研究成果。合成淀粉的重要反应包括二氧化碳制备甲醇的反应: ,该反应在有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态):
,该反应在有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态):

使用催化剂的曲线是___________ (填“甲”或“乙”),催化剂可使反应历程中决速步骤的活化能降低___________ eV,达到化学平衡后再降低温度,平衡___________ (填“正向”“逆向”或“不”)移动。
(2)一定条件下,向某密闭容器中通入x mol CO2,y mol H2,在催化剂存在下发生反应: 。
。
①恒压条件下,当x:y=___________ 时,平衡体系中CH3OH的体积分数最大。
②恒容条件下,当x=2,y=6,温度为T1K时,反应起始压强为8MPa,经10min,反应达到平衡状态,CO2的平衡转化率为50%。则T1K时平衡常数Kp=___________ 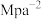 (Kp为以分压表示的平衡常数,分压=总压×物质的量分数),0~10 min内,v(H2)=
(Kp为以分压表示的平衡常数,分压=总压×物质的量分数),0~10 min内,v(H2)=___________  。
。
(1)2021年9月,我国科学家在《科学》杂志发表了二氧化碳人工合成淀粉的研究成果。合成淀粉的重要反应包括二氧化碳制备甲醇的反应:
 ,该反应在有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态):
,该反应在有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态):
使用催化剂的曲线是
(2)一定条件下,向某密闭容器中通入x mol CO2,y mol H2,在催化剂存在下发生反应:
 。
。①恒压条件下,当x:y=
②恒容条件下,当x=2,y=6,温度为T1K时,反应起始压强为8MPa,经10min,反应达到平衡状态,CO2的平衡转化率为50%。则T1K时平衡常数Kp=
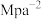 (Kp为以分压表示的平衡常数,分压=总压×物质的量分数),0~10 min内,v(H2)=
(Kp为以分压表示的平衡常数,分压=总压×物质的量分数),0~10 min内,v(H2)= 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】在体积为10 L的密闭容器中,起始投入1 molN2和3mol H2,发生反应:N2(g)+3H2(g) 2NH3(g)∆H<0。回答下列问题:
2NH3(g)∆H<0。回答下列问题:
(1)恒容时,经过4s后反应达到平衡,此时测得氨气的物质的量为1.2 mol。
①0~4s内,v(H2)=_______ mol·L-1·s-1,c(N2)=_______ mol·L-1。
②反应达到平衡后,若降低温度,N2的转化率_______ (填“增大”、“减小”或“不变”)。
(2)恒温时,H2的平衡转化率α与压强p的关系如图所示。
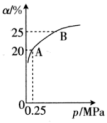
①此温度下,该反应的平衡常数Kp=_______ MPa-2(气体的分压=气体总压强×气体的物质的量分数)。
②平衡状态由A变到B时,平衡常数K(A)_______ (填“>”、“<”或“=”)K(B),设A状态容器的体积为V1,B状态容器的体积为V2,则V1:V2=_______ 。
(3)若在恒温恒容密闭容器中发生上述反应,下列选项表明反应一定达到了平衡状态的是_______ (填标号)。
A.压强不再变化
B.密度不再变化
C.混合气体的平均相对分子质量不再变化
D.相同时间内,断开H-H键的数目和生成N-H键的数目相等
 2NH3(g)∆H<0。回答下列问题:
2NH3(g)∆H<0。回答下列问题:(1)恒容时,经过4s后反应达到平衡,此时测得氨气的物质的量为1.2 mol。
①0~4s内,v(H2)=
②反应达到平衡后,若降低温度,N2的转化率
(2)恒温时,H2的平衡转化率α与压强p的关系如图所示。

①此温度下,该反应的平衡常数Kp=
②平衡状态由A变到B时,平衡常数K(A)
(3)若在恒温恒容密闭容器中发生上述反应,下列选项表明反应一定达到了平衡状态的是
A.压强不再变化
B.密度不再变化
C.混合气体的平均相对分子质量不再变化
D.相同时间内,断开H-H键的数目和生成N-H键的数目相等
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】研究CO2的资源综合利用,对实现“碳达峰”和“碳中和”有重要意义。在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41kJ·mol-1
CO(g)+H2O(g) ΔH2=+41kJ·mol-1
反应Ⅲ.CO(g)+2H2(g) CH3OH(g) ΔH3=-90kJ·mol-1
CH3OH(g) ΔH3=-90kJ·mol-1
向体积为 的密闭容器中,投入
的密闭容器中,投入 和
和 ,平衡时CO或CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图:
,平衡时CO或CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图:
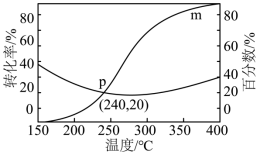
已知反应Ⅱ的反应速率 ,
,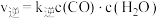 ,
, 为速率常数,c为物质的量浓度。
为速率常数,c为物质的量浓度。
(1)图中m代表的物质是______ 。
(2) 范围内,随着温度升高,H2O的平衡产量的变化趋势是
范围内,随着温度升高,H2O的平衡产量的变化趋势是______ 。
(3)在p点时,若反应Ⅱ的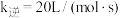 ,此时该反应的
,此时该反应的
______ mol·L-1·s-1;
(4)已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp;p点时体系总压强为 ,反应Ⅱ的Kp=
,反应Ⅱ的Kp=______ (保留2位有效数字)。
(5)由实验测得,随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态,原因是______ 。
反应Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1反应Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41kJ·mol-1
CO(g)+H2O(g) ΔH2=+41kJ·mol-1反应Ⅲ.CO(g)+2H2(g)
 CH3OH(g) ΔH3=-90kJ·mol-1
CH3OH(g) ΔH3=-90kJ·mol-1向体积为
 的密闭容器中,投入
的密闭容器中,投入 和
和 ,平衡时CO或CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图:
,平衡时CO或CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图:
已知反应Ⅱ的反应速率
 ,
,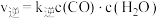 ,
, 为速率常数,c为物质的量浓度。
为速率常数,c为物质的量浓度。(1)图中m代表的物质是
(2)
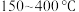 范围内,随着温度升高,H2O的平衡产量的变化趋势是
范围内,随着温度升高,H2O的平衡产量的变化趋势是(3)在p点时,若反应Ⅱ的
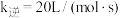 ,此时该反应的
,此时该反应的
(4)已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp;p点时体系总压强为
 ,反应Ⅱ的Kp=
,反应Ⅱ的Kp=(5)由实验测得,随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态,原因是
您最近一年使用:0次



